急性ST段抬高心肌梗死患者體內(nèi)循環(huán)微粒對血管內(nèi)皮功能的影響
李 蕓, 張 偉
(1延安大學(xué)附屬醫(yī)院心腦專科分院電生理室,延安 716000; 2延安大學(xué)附屬醫(yī)院心腦專科分院心血管內(nèi)科一病區(qū))
急性ST段抬高心肌梗死患者體內(nèi)循環(huán)微粒對血管內(nèi)皮功能的影響
李 蕓1, 張 偉2
(1延安大學(xué)附屬醫(yī)院心腦專科分院電生理室,延安 716000;2延安大學(xué)附屬醫(yī)院心腦專科分院心血管內(nèi)科一病區(qū))
目的 探討急性ST段抬高心肌梗死(STEMI)患者體內(nèi)循環(huán)微粒(MPs)對離體大鼠血管內(nèi)皮功能影響的差異。 方法 通過離心提取正常志愿者(正常對照組,n=35),急性心肌梗死并心電圖顯示ST段抬高患者(STEMI組,n=40)體內(nèi)的MPs,然后用分別用正常對照組和STEMI組的MPs孵育離體SD大鼠血管,進而用Western blot檢測兩組MPs對離體SD大鼠血管內(nèi)皮素-1(ET-1)蛋白、內(nèi)皮一氧化氮合酶(eNOS)蛋白表達影響的差異;用一氧化氮(NO)試劑盒檢測兩組MPs對離體SD大鼠血管NO水平影響的差異。 結(jié)果 與來自正常對照組的MPs比較,STEMI組的MPs明顯抑制離體SD大鼠血管eNOS蛋白的表達、NO的產(chǎn)生(P<0.05),同時促進離體SD大鼠血管ET-1蛋白的表達(P<0.05)。 結(jié)論 急性STEMI患者體內(nèi)MPs可能通過eNOS和ET-1途徑影響血管內(nèi)皮功能。
急性ST段抬高心肌梗死; 循環(huán)微粒; 內(nèi)皮素-1; 內(nèi)皮一氧化氮合酶
循環(huán)微粒(circulating microparticles,MPs)是內(nèi)皮細胞、血小板、白細胞等血管或血液相關(guān)細胞被激活或凋亡時分泌的微小顆粒[1,2]。目前研究認為它不僅是內(nèi)皮細胞是否受損的標志物,而且在炎癥反應(yīng)、凝血狀態(tài)、血管功能障礙和血管再生等方面起著重要生物學(xué)作用,參與多種血管相關(guān)疾病的發(fā)生發(fā)展[3,4]。急性ST段抬高心肌梗死(ST-segment elevation myocardial infarction,STEMI)包括疾病前期的炎癥狀態(tài)、冠狀動脈血管粥樣硬化斑塊的破裂、血小板黏附、聚集、活化和血管痙攣等。鑒于MPs及STEMI在內(nèi)皮及血小板方面的重疊,本研究以STEMI患者及正常健康志愿者為研究對象,對比兩者體內(nèi)MPs對內(nèi)皮功能影響的差異,以進一步明確MPs在心肌梗死病理生理過程中的作用機制。
1 資料與方法
1.1 研究對象
STEMI患者(STEMI組,40例)為2016-01~2016-08期間就診于延安大學(xué)附屬醫(yī)院心內(nèi)科,心電圖提示相應(yīng)導(dǎo)聯(lián)ST段明顯抬高的心肌梗死者。STEMI組年齡33-55歲,平均(41.35±6.62)歲;同時排除患糖尿病、高血壓、嚴重感染性疾病、腎功能衰竭等可能影響機體MPs含量的疾病者。正常對照組(35例)為2016-01~2016-08期間于延安大學(xué)附屬醫(yī)院行健康體檢者, 年齡30-55歲,平均( 39.64±8.85)歲。所有參與者均簽署知情同意書,本研究已通過延安大學(xué)附屬醫(yī)院倫理委員會批準。
1.2 血漿MPs提取
按文獻[5]描述進行MPs提取:首先經(jīng)肘靜脈抽取正常對照組(體檢當(dāng)天)及STEMI組(入院翌日)參與者的清晨空腹血液樣本,經(jīng)低溫運送至實驗室后離心(11 000×g,4 ℃,2 min)。離心結(jié)束后提取上層乏血小板血漿2 ml再次離心(13 000×g,4 ℃,45 min)。離心結(jié)束后棄去上層血漿,MPs為微量白色沉淀,若擔(dān)心離心管管壁殘留血漿影響后續(xù)結(jié)果,此次離心結(jié)束后可向離心管內(nèi)加入2 ml生理鹽水后重復(fù)第二次離心。將沉淀于離心管底部的MPs用RPMI1640培養(yǎng)基(GIBCO公司)懸浮后凍存于-80 ℃?zhèn)溆谩?/p>
1.3 血管內(nèi)皮細胞一氧化氮合酶(eNOS)及內(nèi)皮素-1(ET-1)的表達
實驗所用SD大鼠均購至延安大學(xué)實驗動物中心。斬頭處死大鼠后迅速分離取出大鼠胸主動脈并置于預(yù)冷的Kreb’s平衡液(NaCl 119.0 mmol/L,NaHCO325.0 mmol/L,glucose 11.1 mmol/L,CaCl21.6 mmol/L,KCl 4.7 mmol/L,KH2PO41.2 mmol/L,MgSO41.2 mmol/L,pH 7.4,所用試劑均為國產(chǎn)分析純) 內(nèi)。仔細分離血管周圍脂肪組織(避免用力牽拉血管及破壞血管內(nèi)膜)后將血管沿縱軸剖開。將剖開的血管置入37 ℃的Kreb’s平衡液中并置入細胞孵育箱平衡30 min后加入MPs孵育1 h[6]。實驗分空白組(blank組,不處理)、正常對照組(加正常對照組MPs)、STEMI組(加STEMI組MPs)。孵育結(jié)束后用PBS(GIBCO 公司)清洗3次,用預(yù)冷的RIPA細胞裂解液(CST公司)裂解和提取細胞蛋白,經(jīng)超聲進一步破碎后離心(4 ℃,12 000 r/min 10 min)取上層蛋白液,用BCA蛋白濃度測定試劑盒(Thermo公司)測定蛋白濃度后用Western blot檢測eNOS及ET-1蛋白的表達變化。
1.4 血管內(nèi)皮細胞一氧化氮(NO)水平的檢測
依步驟1.3中所述分離SD大鼠胸主動脈血管并孵育MPs 1 h。實驗分空白組(blank組,不處理)、陽性對照組(vascular endothelial growth factor,VEGF,50 ng/ml,R&D公司)、正常對照組(加正常對照組MPs)、STEMI組(加STEMI組MPs)。孵育結(jié)束后棄取去孵育液,用含鈣鎂的HBSS(GIBCO公司)清洗細胞3次后將血管加入500 μl含鈣鎂的HBSS(含L-arginine 25 mmol/L)再次孵育細胞30 min后吸取孵育液用一氧化氮檢測試劑盒(南京建成公司)測定NO含量。孵育結(jié)束后將血管烘干稱重用來換算最終每克血管的NO產(chǎn)量(μmol/g)。
1.5 統(tǒng)計學(xué)方法

2 結(jié)果
2.1 一般臨床數(shù)據(jù)比較
除血脂水平外(STEMI組參與者血脂水平偏高),對照組與STEMI組在年齡、性別、體質(zhì)量指數(shù)上無明顯統(tǒng)計學(xué)差異(見表1)。

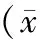

組別n年齡(歲)男/女血脂(mmol/L)膽固醇甘油三酯高密度脂蛋白低密度脂蛋白體質(zhì)量指數(shù)(kg/m2)正常對照組3539.64±8.8519/164.36±0.871.35±0.531.05±0.203.18±0.8721.52±0.95STEMI組4041.35±6.6223/176.08±1.132.86±0.970.96±0.424.87±0.9822.55±0.87 P0.4620.2170.0130.0270.0440.0210.363
與對照組比較,*P<0.05
2.2 MPs對血管內(nèi)皮eNOS及ET-1蛋白表達的影響
與空白組比較,正常對照組MPs對血管內(nèi)皮eNOS蛋白的表達無影響(P>0.05,見圖1),STEMI組MPs明顯抑制了血管內(nèi)皮eNOS蛋白的表達(P<0.05,見圖1)。與空白組比較,正常對照組MPs對血管內(nèi)皮ET-1蛋白的表達無影響(P>0.05,見圖1),STEMI組MPs明顯刺激了血管內(nèi)皮ET-1蛋白的表達(P<0.05,見圖1)。
2.3 MPs對血管內(nèi)皮NO水平的影響
與空白組比較,VEGF組明顯促進內(nèi)皮細胞NO的產(chǎn)生(P<0.05),提示試驗操作有效;正常對照組MPs對血管內(nèi)皮NO的產(chǎn)生無影響(P>0.05);STEMI組MPs明顯抑制血管內(nèi)皮NO的產(chǎn)生(P<0.05,見圖2)。

與空白組和對照組比較, *P<0.05圖1 各組MPs對血管內(nèi)皮eNOS及ET-1表達變化的影響Figure 1 Effect of MPs on the expression of eNOS and ET-1 in vascular endothelial cells

與空白組和對照組比較,*P<0.05;與對照組和VEGF組比較,#P<0.05圖2 各組MPs對血管內(nèi)皮NO含量的影響Figure 2 Effect of MPs from each group on the content of NO in vascular endothelial cells
3 討論
本研究通過離心提取健康志愿者(正常對照組)和STEMI患者(STEMI組)的MPs,對比兩組MPs對血管內(nèi)皮功能的影響發(fā)現(xiàn):與正常對照組比較,STEMI組MPs明顯抑制血管內(nèi)皮eNOS蛋白的表達和NO的產(chǎn)生(P<0.05);STEMI組MPs顯著促進血管內(nèi)皮ET-1蛋白的表達(P<0.05)。提示STEMI患者體內(nèi)MPs可能通過下面兩個方面影響血管舒張和收縮的平衡:抑制eNOS蛋白的表達和NO的產(chǎn)生影響血管舒張因子;刺激血管內(nèi)皮ET-1蛋白的表達影響血管收縮因子。
近些年,EMPs作為一種內(nèi)皮細胞、血小板、白細胞等血管細胞在受到外界激活或凋亡時,以“出泡”方式分泌的微小顆粒。目前認為它在細胞激活、損傷或凋亡時可由內(nèi)皮細胞或血小板分泌,具有反映內(nèi)皮細胞功能的作用[7]。MPs包含磷脂和表面蛋白,這些成分可以反映他們的起源細胞。例如內(nèi)皮細胞表面抗原CD31、血小板內(nèi)皮細胞黏附分子-1(PECAM-1)或CD62[8]。目前研究認為MPs不僅是反映內(nèi)皮細胞是否受損的標志物,還在炎癥反應(yīng)、凝血狀態(tài)、血管功能障礙和血管再生等方面起到重要的生物學(xué)作用,參與了多種血管相關(guān)疾病的發(fā)生發(fā)展[9,10]。2010-2011年期間,Circulation Research雜志以專題的形式連續(xù)報道了數(shù)篇有關(guān)微粒的綜述評論,文章涉及細胞內(nèi)信號傳導(dǎo)、血管新生、血管功能、動脈粥樣硬化等方面[9-12]。
STEMI的病理生理包含了疾病早期機體的炎癥反應(yīng),以及心肌梗死發(fā)生時冠狀動脈粥樣硬化中不穩(wěn)定斑塊的破裂,進而激活體內(nèi)血小板而致使血小板發(fā)生黏附和聚集,這些病理生理的改變必然影響冠狀動脈內(nèi)皮功能而發(fā)生冠狀動脈痙攣和血栓形成,最終影響患者的生命安全。鑒于MPs的產(chǎn)生過程與SREMI的病理生理過程中的共性,也是我們本次研究的假設(shè)和宗旨。本研究通過MPs孵育大鼠離體胸主動脈后檢測與血管內(nèi)皮功能血管的指標發(fā)現(xiàn):來自STEMI患者體內(nèi)的MPs明顯抑制了血管內(nèi)皮eNOS蛋白的表達(見圖1A)和NO的產(chǎn)生(見圖2);來自STEMI患者體內(nèi)的MPs明顯刺激血管內(nèi)皮ET-1蛋白的表達(見圖1B)。NO主要通過一氧化氮合酶(NOS)的活化從L-精氨酸轉(zhuǎn)化而來。NO是維持細胞功能的重要物質(zhì),同時是反映內(nèi)皮細胞功能的重要指標[13-15]。ET-1為血管收縮肽,可以收縮動脈平滑肌,ET-1的水平升高與血管阻力、動脈壓呈正相關(guān)[16,17]。
綜上所述,本研究顯示STEMI患者體內(nèi)的MPs抑制血管內(nèi)皮eNOS活化及NO的產(chǎn)生,同時促進血管內(nèi)皮ET-1的產(chǎn)生,最終導(dǎo)致血管舒張和收縮因子的失衡,導(dǎo)致疾病的惡化。因此MPs有作為血管內(nèi)皮功能受損標志物的潛能。
[1] Horstman LL,Jy W,Jimenez JJ,etal.Endothelial microparticles as markers of endothelial dysfunction[J].Front Biosci,2004,9:1118-1135.
[2] Chironi GN,Boulanger CM,Simon A,etal.Endothelial microparticles in diseases[J].Cell Tissue Res,2009,335(1):143-151.
[3] Dignat-George F,Boulanger CM.The many faces of endothelial microparticles[J].Arterioscler Thromb Vasc Biol,2011,31(1):27-33.
[4] Piccin A,Murphy WG,Smith OP.Circulating microparticles:pathophysiology and clinical implications[J].Blood Rev,2007,21(3):157-171.
[5] Boulanger CM,Scoazec A,Ebrahimian T,etal.Circulating microparticles from patients with myocardial infarction cause endothelial dysfunction[J].Circulation,2001,104:2649-2652.
[6] Fu L,Hu XX,Lin ZB,etal.Circulating microparticles from patients with valvular heart disease and cardiac surgery inhibit endothelium-dependent vasodilation[J].J Thorac Cardiovasc Surg,2015,150(3):666-672.
[7] van Ierssel SH,Hoymans VY,van Craenenbroeck EM,etal.Endothelial microparticles for the assessment of endothelial function:aninvitroandinvivostudy on possible interference of plasma lipids[J].PLoS One,2012,7(2):e31496.
[8] Jimenez JJ,Jy W,Mauro LM,etal.Endothelial cells release phenotypically and quantitatively distinct microparticles in activation and apoptosis[J].Thromb Res,2003,109:175-180.
[9] Martinez MC,Andriantsitohaina R.Microparticles in angiogenesis:Therapeutic potential[J].Circ Res,2011,109(1):110-119.
[10] Mause SF,Weber C.Microparticles:protagonists of a novel communication network for intercellular information exchange[J].Circ Res,2010,107(9):1047-1057.
[11] Owens AP 3rd,Mackman N.Microparticles in hemostasis and thrombosis[J].Circ Res,2011,108(10):1284-1297.
[12] Rautou PE,Vion AC,Amabile N,etal.Microparticles,vascular function,and atherothrombosis[J].Circ Res,2011,109(5):593-606.
[13] Aicher D,Urbich C,Zeiher A,etal.Endothelial nitric oxide synthase in bicuspid aortic valve disease[J].Ann Thorac Surg,2007,83(4):1290-1294.
[14] Crabtree MJ,Smith CL,Lam G,etal.Ratio of 5,6,7,8-tetrahydrobiopterin to 7,8-dihydrobiopterin in endothelial cells determines glucose-elicited changes in NO vs.superoxide production by eNOS[J].Am J Physiol Heart Circ Physiol,2008,294(4):H1530-H1540.
[15] Ou ZJ, Wei W,Huang DD,etal.L-arginine restores endothelial nitric oxide synthase-coupled activity and attenuates monocrotaline-induced pulmonary artery hypertension in rats[J].Am J Physiol Endocrinol Metab,2010,298(6):E1131-1139.
[16] 尹清茹,劉恒亮.厄貝沙坦對高血壓患者纖溶活性內(nèi)皮素一氧化氮降鈣素基因相關(guān)肽的影響[J].中國臨床保健雜志,2005,8(2):110-112.
[17] Yamamoto K,Ikeda U,Mito H,etal.Endothel in production in pulmonary circulation of patient with mitral stenos is[J].Circulation,1994,89(5):2093-2098.
Effect of circulating microparticles on endothelial function in patients with acute ST-segment elevation myocardial infarction
LI Yun1, ZHANG Wei2
(1DepartmentofElectrophysiology,CardiovascularSpecialistBranch,AffiliatedHospitalofYan’anUniversity,Yan’an716000,China;2DepartmentofCardiology,CardiovascularSpecialistBranch,AffiliatedHospitalofYan’anUniversity)
ObjectiveTo investigate the effect of circulating microparticles(MPs) on endothelial function in patients with acute ST-segment elevation myocardial infarction(STEMI).MethodsMPs of healthy subjects(control group,n=35) and patients with acute ST-segment elevation myocardial infarction(STEMI group,n=40) were obtained by centrifuge. Then, the effects of MPs on expression of endothelial nitric oxide synthase(eNOS) and endothelial-1(ET-1) were tested by Western blot, and the levels of nitric oxide(NO) in isolated SD rat vessels were detected by NO Kit.ResultsCompared with control group, MPs significantly inhibited the expression of eNOS and the generation of NO, but increased expression of ET-1 in STEMI group(P<0.05).ConclusionMPs in STEMI patients may affect endothelial function through eNOS and ET-1 pathway.
acute ST segment elevation myocardial infarction; circulating microparticles; endothelin-1; endothelial nitric oxide synthase
國家自然科學(xué)基金專項基金資助項目(81341112)
李蕓,女,1979-02生,學(xué)士,主治醫(yī)師
2016-11-24
R542.22
A
1007-6611(2017)02-0106-04
10.13753/j.issn.1007-6611.2017.02.003

