亞低溫療法聯合依達拉奉對大鼠腦缺血再灌注損傷的保護作用
吳達榮 曾志芬 陶恩祥△
1)深圳市龍崗中心醫院,廣東 深圳 518116 2)中山大學附屬第二醫院,廣東 廣州 510120
亞低溫療法聯合依達拉奉對大鼠腦缺血再灌注損傷的保護作用
吳達榮1)曾志芬2)陶恩祥2)△
1)深圳市龍崗中心醫院,廣東 深圳 518116 2)中山大學附屬第二醫院,廣東 廣州 510120
目的 探討亞低溫療法聯合依達拉奉對大鼠腦缺血再灌注損傷后的保護作用。方法 采用線栓法建立局灶性腦缺血再灌注模型,缺血6 h后再灌注,并分為假手術組、模型組、依達拉奉組、亞低溫聯合依達拉奉組,再灌注24 h后進行神經功能缺損評分,采用TTC染色測定腦梗死體積和用免疫組化的方法檢測Bax和Bcl-2的陽性細胞數。結果 與模型組比較,依達拉奉未能減少腦梗死體積,但能通過下調Bax及上調Bcl-2減少細胞的凋亡,對腦細胞有保護作用;與模型組、依達拉奉組比較,亞低溫聯合依達拉奉組能通過上調Bcl-2及下調Bax明顯降低大鼠神經缺陷評分及減少腦梗死體積。 結論 亞低溫療法聯合依達拉奉對大鼠腦缺血再灌注損傷具有很好的保護作用。
亞低溫;腦缺血;依達拉奉;Bax;Bcl-2;大鼠
缺血性腦卒中發病率、致殘率和病死率均高,已成為嚴重危害人類健康的疾病之一。腦梗死溶栓后,可產生血流再灌注損傷,加重腦損傷,與自由基產生、細胞凋亡有關。近年來研究表明,亞低溫對缺血性腦損傷具有保護作用,是一種療效肯定的治療措施。依達拉奉是一種新型自由基清除劑,具有抗細胞凋亡和神經保護的作用。本研究旨在探討亞低溫療法聯合依達拉奉對大鼠腦缺血再灌注損傷后的保護作用,為臨床治療提供實驗依據。
1 材料和方法
1.1 動物分組 健康雄性SD大鼠80只(清潔級,中山大學實驗動物中心提供),體質量280~330 g 。依達拉奉注射液(必存),南京先聲東元制藥有限公司。TTC (2,3,5-氯化三苯基四氮唑),威佳生物技術公司。兔抗鼠Bax、Bcl-2多克隆抗體,美國Santa Cruz公司。將大鼠隨機分為假手術組、模型組、依達拉奉組、亞低溫聯合依達拉奉組各20只。
1.2 方法 假手術組僅進行手術,不造成缺血狀態,其余3組均采用線栓法建立大鼠大腦中動脈的局灶性腦缺血模型,于缺血6 h后實施再灌注。依達拉奉給藥組于缺血時及再灌注后立即予依達拉奉3 mg·kg-1腹腔內注射。模型組給予等劑量生理鹽水腹腔內注射。亞低溫聯合依達拉奉組在缺血后立即采用噴灑酒精和電扇降溫的方法在10 min內使肛溫降至30 ℃,相應的腦溫為33 ℃[1-2]。33 ℃為最適腦溫,恢復快,并發癥少[3]。維持亞低溫6 h后,實施再灌注,然后把大鼠轉移到溫度為5 ℃的房間內,調節肛溫30 ℃,維持24 h[4]。
1.3 動物模型的制作 線栓法建立大鼠大腦中動脈(middle cerebral artery occlusion,MCAO)的局灶性腦缺血模型[5]。大鼠腹腔注射10 %水合氯醛(0.3 mL/100 g) 麻醉后,仰臥固定在手術臺上,75 %乙醇消毒頸部皮膚,正中頸部切口,分離并暴露右側頸總動脈(common carotid artery,CCA)、頸外動脈(external carotid artery,ECA)、頸內動脈(internal carotid artery,ICA),游離ECA主干及分支,距離分叉部約4mm處結扎ECA,電凝ECA 的分支,分離ICA主干至翼腭動脈(pterygopalatine artery,PPA)并將其從根部結扎。在術野中CCA近心端、ICA遠心端分置動脈夾夾閉,于ECA主干置一不扎緊的縫線,殘端用眼科手術剪剪一0.3 mm的切口,將預先制備好的頭端成球狀、直徑為0.26處mm的栓線插入,扎緊ECA主干上的縫線,松開ICA遠心端的動脈夾,輕推魚絲線沿ICA入顱,魚絲線插入深度(18.5±0.5)mm,扎緊ECA上絲線,松開CCA上的動脈夾,縫合皮膚切口。待達到缺血時間后,把線頭往外輕拉,感到阻力時,表明魚絲線的頭端已經回到ECA的主干中,貼近皮膚剪去魚絲線,實現再灌注,術后常規青霉素肌注預防感染,麻醉清醒后大鼠出現以左前肢為主的偏癱作為模型成功的標志。假手術組魚絲線插入深度為13 mm,其余步驟同實驗組。
1.4 觀察指標
1.4.1 神經功能缺損評分:再灌注后30 h行神經功能評分,采用Longa評分分級標準,即0分:無神經系統功能缺損癥狀,活動正常;1分:對側前肢不能完全伸展;2分:爬行時向對側轉圈;3分:行走時身體向偏癱側傾倒;4分:不能自主行走,意識喪失;5分:死亡。1~4分為造模成功。
1.4.2 腦梗死體積百分比測定:用10%水合氯醛腹腔注射麻醉后,迅速剪開胸腔暴露心臟,經左心室先用100 mL肝素化生理鹽水快速灌注,隨后立即斷頭取腦,置于-20 ℃冰箱中冷凍20 min,從腦額極開始,每間隔2 mm作一冠狀切片,層厚2 mm。置于2%TTC(2,3,5-氯化三苯基四氮唑)溶液中,嚴格避光,37 ℃水浴中孵育30 min,梗死區不著色,正常腦組織著紅色。隨即用4%多聚甲醛液固定,根據蒼白區觀察梗死灶范圍。采用全自動圖像分析系統計算每張切片的梗死灶面積及總面積,根據公式V = 2 (A 1 + A 2 + A n)計算梗死體積及總體積,其中2 為切片厚度,A 為面積[6]。腦梗死體積百分比=梗死體積/全腦體積。
1.4.3 組織學觀察:斷頭取腦,取大腦視交叉前緣始向前的2 mm厚冠狀切片,置于含4%多聚甲醛溶液中固定,常規脫水、透明、石蠟包埋、連續冠狀切片,切片厚度5 μm,切片貼附于預處理的載玻片上。相鄰切片分別作Bax 、Bcl-2免疫組化染色。胞漿著色呈棕黃色為陽性細胞。每張切片于高倍鏡(×400)下將缺血灶周邊區皮質和紋狀體的5個視野計數[7]。
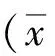
2 結果
2.1 各組神經功能缺損評分、腦梗死體積百分比比較 除假手術組外,其余各組均出現大鼠神經功能缺損。模型組與依達拉奉組比較無顯著性差異(P>0.05)。亞低溫聯合依達拉奉可降低大鼠神經功能缺陷評分,與模型組比較有顯著性差異(P<0.01),與依達拉奉組比較亦有顯著性差異(P<0.05)。假手術組未出現腦梗死灶。模型組與依達拉奉組比較無顯著性差異。亞低溫聯合依達拉奉組能減小腦梗死體積,與模型組、依達拉奉組比較差異有統計學意義(P<0.05)。見表1。
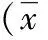
表1 各組神經功能評分、腦梗死體積百分比比較±s)
注:與模型組比較,#P<0.01;與依達拉奉組比較,▲P<0.05;與模型組、依達拉奉組比較,△P<0.05
2.2 免疫組織化學
2.2.1 各組Bax陽性細胞數比較:胞漿著色為棕黃色為Bax陽性細胞。假手術組Bax陽性細胞數為1.64±1.15,模型組為63.80±6.15,依達拉奉組為50.00±7.38,亞低溫聯合依達拉奉組為35.40±4.20,各組與假手術組比較均有明顯差異(P<0.01)。亞低溫聯合依達拉奉組Bax表達的陽性細胞數與模型組、依達拉奉組比較均有所減少。依達拉奉組Bax陽性細胞數小于模型組。見圖1。

圖1 不同組Bax陽性細胞數 胞漿染成棕黃色為陽性 Bar is 100 μm.(DAB 染色,×400) A:假手術組 B:模型組 C:依達拉奉組 D:亞低溫聯合依達拉奉組
2.2.2 Bcl-2陽性細胞數比較:Bcl-2陽性細胞為胞漿著色為棕黃色。假手術組Bcl-2陽性細胞數為1.58±0.84,模型組為30.00±2.10,依達拉奉組為40.62±2.09,亞低溫聯合依達拉奉組為50.84±3.18,各組與假手術組比較均有明顯差異(P<0.01)。亞低溫聯合依達拉奉組Bcl-2表達的陽性細胞數明顯多于模型組、依達拉奉組(P<0.01)。依達拉奉組Bcl-2陽性細胞數與模型組比較差異有統計學意義(P<0.01)。見圖2。

圖2 不同亞組Bcl-2陽性細胞數 胞漿染成棕黃色為陽性。 Bar is 100 μm.(DAB 染色,×400) A:假手術組 B:模型組 C:依達拉奉組 D:亞低溫聯合依達拉奉組
3 討論
以往研究表明,腦梗死后血流下降最嚴重的是梗死中心區域,細胞發生壞死,周圍缺血半暗帶區的血流出現不同程度下降,與凋亡密切相關[8]。腦缺血缺氧后有多種蛋白被誘導表達,其中Bax 和Bcl-2是細胞凋亡的重要調控蛋白,Bax表達增加促進細胞凋亡,而Bcl-2是抗凋亡蛋白。Bax 和Bcl-2形成了細胞凋亡的正負調控,兩者比例決定了細胞是否趨向凋亡。本研究免疫組化結果顯示,Bax、Bcl-2陽性細胞更多的出現于缺血半暗帶區,Bax、Bcl-2陽性細胞胞漿染色,胞核尚未著色。結果顯示,腦梗死發生后,Bax及Bcl-2陽性細胞明顯增多,提示參與了細胞的凋亡,與以往研究結果相一致。依達拉奉是一種自由基清除劑,可清除自由基,抑制脂質過氧化,從而抑制腦細胞、血管內皮細胞、神經細胞的氧化損傷[9]。本實驗表明,與模型組相比較,依達拉奉未能降低神經功能缺陷評分及未能減少腦梗死體積,但能通過下調Bax及上調Bcl-2減少細胞的凋亡,對腦細胞有保護作用。亞低溫對缺血區域的神經元具有保護作用,其機制可能與降低腦氧代謝率、改善細胞能量代謝、減少興奮性氨基酸的釋放、減少氧自由基的生成、減少細胞內鈣超載、減輕腦水腫等有關。文獻[10]報道,亞低溫能通過下調Bax及上調Bcl-2對腦梗死缺血區域的腦細胞發揮腦保護作用。因此理論上,亞低溫聯合依達拉奉對缺血腦組織將有更大的保護作用。而本實驗的研究結果也證明了該設想,亞低溫聯合依達拉奉較單用依達拉奉有更好的腦保護作用,體現在能明顯降低大鼠功能神經缺陷評分及減小腦梗死體積方面,其機制可能是更大程度的上調了Bcl-2及下調了Bax。
本實驗表明,亞低溫聯合依達拉奉比單用依達拉奉能更大程度的上調Bcl-2及下調Bax,從而降低大鼠神經功能缺陷評分,抑制神經元的凋亡,減小腦梗死體積,阻止腦梗死的進展。
[1] 吳達榮,陳世文,潘經銳,等.亞低溫療法對大鼠腦缺血再灌注損傷的保護作用[J].中國實用神經疾病雜志,2014,17(4):57-59.
[2] Yenari MA,Onley D,Hedehus M,et al.Diffusion- and perfusion-weighted magnetic resonance imaging of focal cerebral ischemia and cortical spreading depression under conditions of mild hypothermia[J].Brain Res,2000,885(2):208-219.
[3] Shinada T,Hata N,Kobayashi N,et al.Efficacy of therapeutic hypothermia for neurological salvage in patients with cardiogenic sudden cardiac arrest:the importance of prehospital return of spontaneous circulation[J].J Nippon Med Sch,2013,80(4):287-295.
[4] Kawai N,Okauchi M,Morisaki K,et al.Effect of delayed intraischemic and postischemic hypothermia on a focal model of transient cerebral ischemic in rats[J].Stroke,2000,31(8):1 982-1 989.
[5] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6] Sch?ller K,Zausinger S,Baethmann A,et al.Neuroprotection in ischemic stroke-combination drug therapy and mild hypothermia in a rat model of permanent focal cerebral ischemia[J].Brain Res,2004,1 023(2):272-278.
[7] Wang GJ,Deng HY,Maier CM,et al.Mild hypothermia reduces ICAM-1 expression,neutrophil infiltration and microglia/monocyte accumulation following experimental stoke[J].Neuroscience,2002,114(4):1 081-1 090.
[8] Vela L,Gonzalo O,Naval J,et al.Direct interaction of Bax and Bak with Bcl-2 Homology domain-3 (BH3)-only proteins in living cells revealed by fluorescence complementation[J].J Biol Chem,2013,288(7):4 935-4 946.
[9] Nakagomi T,Yamakawa K,Sasaki T,et al.Effect of edaravone on cerebral vasospasm following experimental subarachnoid hemorrhage[J].J Stroke Cerebrovasc Dis,2003,12(1):17-21.
[10] Zhang P,Li J,Liu Y,et al.Human neural stem cell tr-ansplantation attenuates apoptosis and improves neurological functions after cerebral ischemia in rats[J].Acta Anaesthesiol Scand,2009,53(9):1 184-1 191.
(收稿2017-04-02)
Protective effects of mild hypothermia combined with edaravone on rats with cerebral ischemic reperfusion injury
WuDarong*,ZengZhifen,TaoEnxiang
*LonggangCentralHospitalofShenzhen,Shenzhen518116,China
Objective To observe protective effects of mild hypothermia combined with edaravone on rats with cerebral ischemic reperfusion injury.Methods Six hours after the establishment of focal cerebral ischemia by suture method,we performed reperfusion.And 24 hours after successful reperfusion injury,neurological functional deficits in sham-operation group,model group,edaravone group and mild hypothermia combined with edaravone group (combined group) were evaluated.Cerebral ischemic volume was measured by TCC staining and the number of positive Bax and Bcl-2 cells was tested by immunohistochemistry method.Results Compared with model group,edaravone group failed to reduce the infarct volume,but managed to decrease cell apoptosis via down-regulating Bax and up-regulating Bcl-2 for the purpose of protective effect.In addition,compared with model group and edaravone group,the combined group significantly lowered the degree of ischemic reperfusion injury and reduced infarct volume through the up-regulation of Bcl-2 and down-regulation of Bax.Conclusion Mild hypothermia combined with edaravone has good effects on rats with cerebral ischemic reperfusion injury.
Mild hypothermia;Cerebral ischemia;Edaravone;Bax;Bcl-2;Rats
深圳市衛生計生系統科研項目(項目編號:201402121);深圳市龍崗區科技計劃醫療衛生項目(項目編號:YLWS20140605174929210)
R-332
A
1673-5110(2017)12-0005-03
△通訊作者:陶恩祥,E-mail:taoenxiang@yahoo.com.cn

