藍豬耳花粉萌發和花粉管生長的影響因素
陳素紅 鄒璞 廖景平
摘要 [目的]探討藍豬耳花粉管的最佳培養條件,為建立植物離體受精體系奠定基礎。[方法]采用離體培養技術,研究了藍豬耳花粉離體萌發和花粉管體外生長的主要影響因素。[結果]藍豬耳花粉萌發及花粉管生長的最佳培養基為:5.00%(V/V)蔗糖、0.01%(V/V)氯化鈣、0.01%(V/V)硼酸和0.01%(V/V)磷酸二氫鉀,其培養基的滲透壓主要靠蔗糖調節。[結論]硼是藍豬耳花粉萌發中必不可少的微量元素;鈣對花粉管生長起著非常重要的調節作用,并推測鈣離子主要是通過電壓依賴型鈣通道進入花粉管內部。
關鍵詞 藍豬耳;花粉萌發;花粉管生長;影響因素
中圖分類號 Q942.5 文獻標識碼 A 文章編號 0517-6611(2017)18-0011-04
Abstract [Objective] To explore the optimum culture conditions for the pollen tube of Torenia fournieri. [Method] Using the techniques of in vitro culture, the main influencing factors of pollen germination and pollen tubes growth in vitro of T. fournieri were studied. [Result] The suitable culture medium for pollen germination and pollen tubes growth in vitro of T. fournieri was as follows:5% (V/V) sucrose, 0.01% (V/V) CaCl2, 0.01% (V/V) boric acid and 0.01% (V/V) KH2PO4. The osmotic pressure of the medium was mainly regulated by sucrose. [Conclusion] Boron is an essential microelement in pollen germination of T. fournieri. Calcium plays an important role in pollen tubes growth. It is deduced that voltagedependent Ca2+ channels may be a main calcium influx pathway through which Ca2+ entered into pollen tube.
Key words Torenia fournieri;Pollen germination;Pollen tube growth;Influencing factors
花粉管在植物受精過程中起著傳遞、運輸雄配子到達受精作用靶細胞區的作用,因此花粉萌發和花粉管生長是高等植物有性生殖過程的重要生理環節。花粉管自身存在“自我組織調控網絡”,使之具有極性生長特性[1]。因此,花粉管常被作為植物細胞運動、定向生長、頂端或極性生長、胞內外信號轉導及細胞骨架變化等研究的模式體系。
Ca2+ 是花粉萌發和花粉管生長的核心調控因子,在囊泡的運輸和融合、細胞骨架的組裝、細胞壁性狀等方面起調節作用[2]。關于花粉離體萌發的研究表明,花粉水合后萌發孔或萌發溝部位的鈣離子濃度升高,從而啟動并促進花粉萌發[3-5]。花粉管的生長對鈣的需求具有濃度效應,只有適宜的外源鈣濃度才能促進花粉管生長,鈣濃度過高或過低均抑制花粉管生長。在花粉萌發孔和花粉管中存在從頂端至基部的鈣梯度[6-7],尖端高濃度的鈣是胞外鈣經活化的鈣通道內流產生的,消除鈣梯度會抑制花粉管生長[8]。鈣通道和鈣離子梯度等共同控制著花粉萌發和花粉管生長及其定向性。
硼對花粉萌發和花粉管的生長亦起促進作用。細胞中大部分的硼位于細胞壁上,Blevins等[9]研究發現硼與果膠類物質GR-Ⅱ(鼠李半乳糖醛酸-Ⅱ)結合使酸性果膠變成酯化果膠。在花粉管中,酯化果膠集中在花粉管頂端,使頂端存在一定的延展性;酸性果膠遍及整個花粉管,使細胞壁有足夠的機械強度[10]。硼酸可防止酚類物質的積累,促進花粉管的生長[11]。
藍豬耳是玄參科(Scrophulariaceae)蝴蝶草屬(Torenia L.)植物,具有半裸露的胚囊結構。研究者利用其獨特的胚囊特征,建立了藍豬耳花粉管定向生長至胚囊的離體試驗技術,首次驗證了受精過程中助細胞是引導花粉管定向進入胚囊的靶位點[12]。創建離體受精體系是研究高等植物有性生殖的熱點領域。藍豬耳是被子植物受精生物學研究的模式植物,研究藍豬耳花粉離體萌發和花粉管離體生長的影響因素是建立藍豬耳離體受精體系的前提。筆者研究鈣和硼對藍豬耳花粉離體萌發和花粉管離體生長的影響,探索花粉管的最佳培養條件。
1 材料與方法
1.1 試驗材料
藍豬耳種植在中國科學院華南植物園,每年4—12月開花,6—10月為盛花期。藍豬耳是二強雄蕊,兩長花絲上的花藥在柱頭上方,自花、異花授粉都能受精、結實。當開花后2 d,花藥有開裂,取柱頭上的兩枚花藥,用于花粉離體萌發和花粉管生長試驗。
1.2 試驗方法
花粉萌發的培養液基本成分包括:磷酸二氫鉀、氯化鈣、硼酸和蔗糖。花粉管培養基配制方法如下:①蔗糖濃度梯度設置為3%、5%、7%、10%和15%(V/V),磷酸二氫鉀、氯化鈣和硼酸濃度均為0.01%(V/V),確定花粉萌發率最高時蔗糖的濃度(即蔗糖最佳濃度);②當蔗糖為最佳濃度,磷酸二氫鉀濃度為0.01%(V/V)時,Ca2+ 和H3BO3濃度梯度分別為0、0.001%、0.010%和0.100%(V/V)。
在培養皿中用凡士林制出若干個小室,將花粉萌發培養液放于其中,用微針從花藥中挑取花粉灑入培養液中,花粉要均勻遍及液體表面,然后將培養皿置于黑暗、22 ℃恒溫條件下萌發。分別在花粉培養1和3 h,取出培養皿在倒置顯微鏡下觀察,每1微室取6個視野,每個視野的花粉粒達30粒以上;每種培養液重復3次,取萌發率平均值。花粉萌發以花粉管長度大于或等于萌發孔直徑為萌發標準。
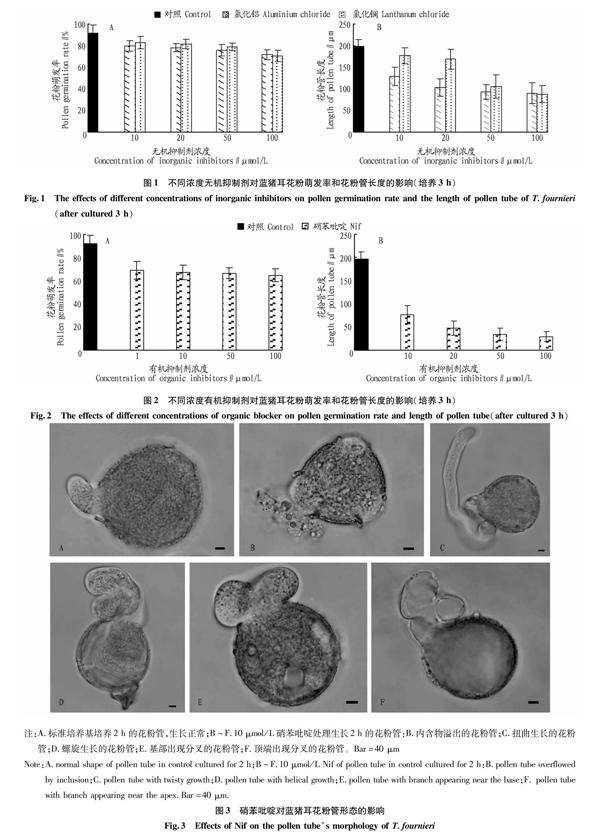
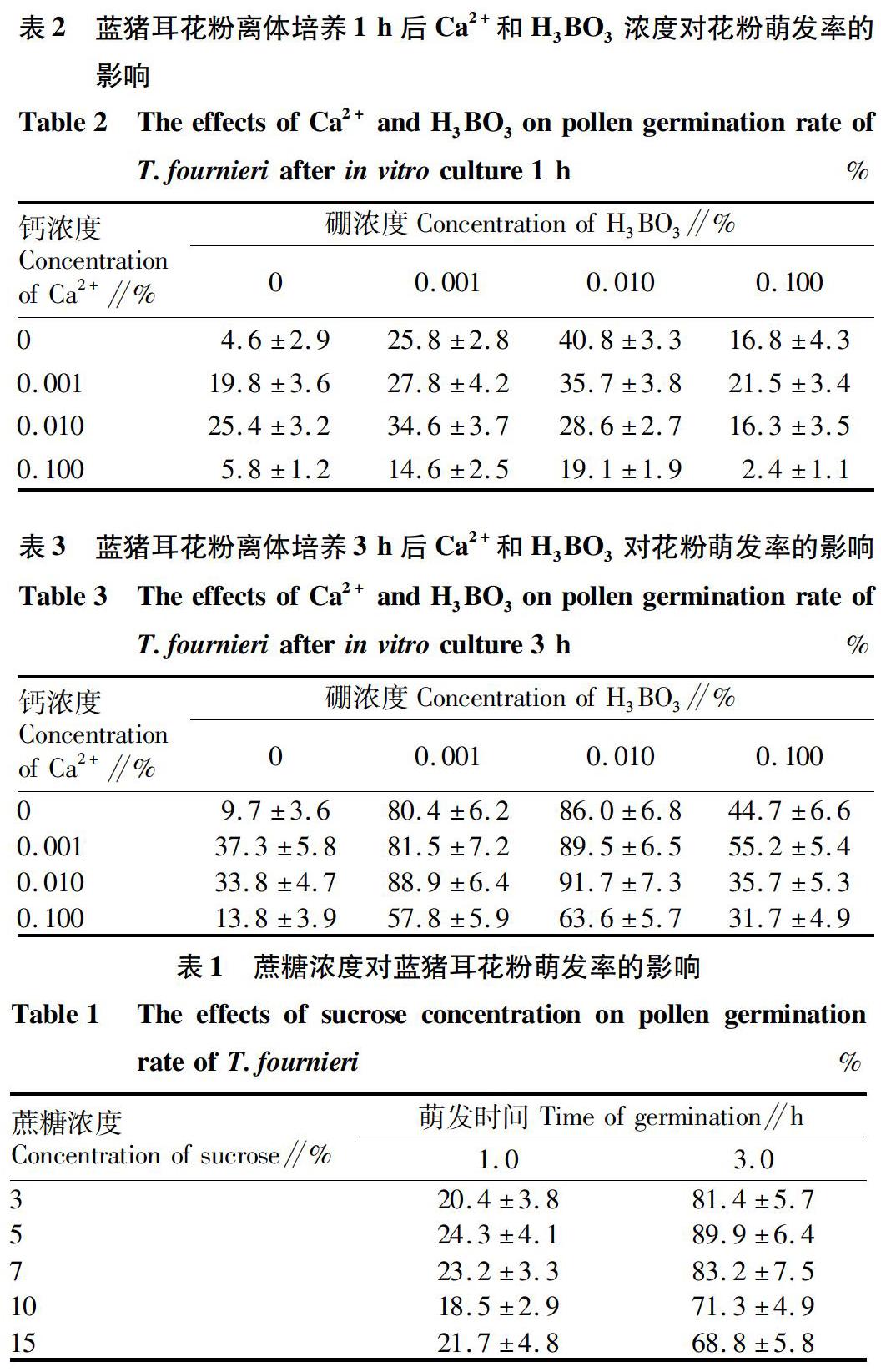
硝苯吡啶(Nif)、Al3+、La3+為鈣通道抑制劑。在上述花粉萌發最好的培養液中加入有機抑制劑硝苯吡啶和無機抑制劑氯化鋁、氯化鑭,在倒置顯微鏡下觀察不同濃度不同鈣通道抑制劑培養液中花粉管萌發情況,統計萌發率和花粉管長度。同時,對50 μmol/L硝苯吡啶培養液中生長3 h的花粉管拍照。
2 結果與分析
2.1 藍豬耳花粉的離體萌發
藍豬耳的花粉需要在含少量糖的培養基上才能較好的萌發。花粉培養1 h時,5個濃度的蔗糖培養液中花粉萌發率都不高,花粉正處于剛開始萌發階段,彼此之間萌發率相差不大;花粉培養3 h時,在5%的蔗糖培養液中,花粉萌發率達最高,而在3%和7%的蔗糖培養液中,萌發率也比較高,與5%的相差不大,隨著蔗糖濃度的升高,萌發率呈下降趨勢(表1)。這表明蔗糖濃度5%為藍豬耳花粉萌發的最佳濃度。
確定最佳蔗糖濃度后,改變鈣和硼的濃度研究二者對花粉萌發和花粉管生長的影響。
當藍豬耳花粉離體培養1 h,在無鈣條件下,隨硼濃度的升高,花粉萌發率逐漸升高,當硼濃度為0.010%時,花粉萌發率達最高,然后隨硼濃度的繼續升高,花粉萌發率反而下降;在無硼條件下,改變鈣的濃度,花粉萌發率都很低;同時,在無鈣無硼條件下,花粉萌發率相當低。從花粉離體培養1 h的試驗結果來看,在無鈣且硼酸濃度為0.010%時,花粉萌發率最高,達40.8%(表2)。
當藍豬耳花粉離體培養3 h,在無鈣條件下,當硼濃度小于0.010%時,隨著硼濃度的升高,花粉萌發率驟升,直到硼濃度為0.010%,萌發率達到最大值(86.0%),然后隨著硼濃度的繼續增加,萌發率開始降低;在無硼條件下,雖然有鈣加入,但萌發率仍然不高,當鈣濃度為0.001%時,萌發率最高(37.3%),然而在無硼、無鈣條件下,花粉萌發率仍然很低,只有9.7%。同時改變鈣和硼的濃度,當鈣和硼濃度均為0.010%時,花粉萌發率最高,達91.7%(表3)。
以上結果表明,藍豬耳花粉萌發時可不需要外源鈣,但高鈣會抑制花粉的萌發;硼在花粉萌發時起重要的作用,是花粉萌發必不可少的微量元素。
2.2 鈣通道抑制劑對花粉萌發和花粉管生長的影響
在含有鈣通道無機抑制劑(3價陽離子)的培養基中,藍豬耳花粉萌發率比對照稍低,花粉管長度低于對照水平(圖1)。抑制劑對花粉萌發和花粉管生長的抑制效果與其濃度密切相關,分別加入10、20、50、100 μmol/L 的氯化鋁和氯化鑭處理后,花粉萌發率受影響不大,在體外培養3 h,萌發率在70%左右。然而,鈣通道無機抑制劑對花粉管生長的抑制效果較明顯,濃度越高,培養3 h的花粉管長度就越短;將氯化鋁和氯化鑭2種抑制劑進行比較,鋁抑制花粉管生長的效果比鑭明顯。
在含有鈣通道有機抑制劑硝苯吡啶的培養基中,藍豬耳花粉萌發率低于對照,花粉管長度明顯低于對照水平(圖2)。抑制劑對花粉萌發和花粉管生長的抑制效果與其濃度密切相關,分別加入1、10、50、100 μmol/L 的硝苯吡啶處理后,花粉萌發率雖然比對照的降低較多,但在體外培養3 h,萌發率仍達60%以上。然而,鈣通道有機抑制劑對花粉管生長的抑制效果很明顯,當加入1 μmol/L 的硝苯吡啶時,培養3 h的花粉管長度只有對照的1/3。硝苯吡啶濃度越高,花粉管長度越短。當硝苯吡啶濃度為100 μmol/L時,花粉管長度僅有(29.25±10.97)μm。這表明有機抑制劑對藍豬耳花粉管生長的抑制作用最強。
2.3 硝苯吡啶對藍豬耳花粉管形態的影響
定時觀察花粉管的形態,發現藍豬耳花粉管在適宜的培養液中形態正常。當10 μmol/L硝苯吡啶處理時,在抑制花粉管生長的同時,還導致花粉管形態異常。其形態異常主要表現為:萌發孔處破裂,溢出花粉內含物;花粉管扭曲,螺旋生長;花粉管分枝生長,其中有的分叉出現在基部,有的在生長一段時間后在頂部出現分叉(圖3)。
3 討論與結論
從花粉離體萌發所需培養基來看,不同植物對培養基成分的要求不同[13]。藍豬耳花粉離體萌發的培養基需要恰當平衡的鹽/糖、適宜的鈣和硼。目前,大量研究表明硼對花粉的萌發有促進作用,硼作為Ca2+誘導劑引導胞外Ca2+進入細胞內,提高細胞內的Ca2+濃度以促進花粉萌發,對花粉管的生長發育有重要的影響[5]。在藍豬耳花粉離體萌發中,硼的需求顯得格外重要,在無硼的培養基中花粉萌發率相當低;然而,外源鈣的影響顯得不甚明顯。一般認為,花粉內存在較多的鈣,而缺乏硼,因此萌發時胞外鈣對萌發率的影響不如硼顯著[14]。藍豬耳花粉中的鈣量足以滿足花粉萌發,而硼則需要外援。雖然硼和鈣在花粉萌發中的作用被一致認為是2個相當獨立的過程,但是在藍豬耳花粉離體萌發試驗中雙向調節硼和鈣的濃度,發現花粉萌發和花粉管生長所需的最佳鈣和硼濃度是一致的,表明二者是協同促進花粉萌發。
鈣離子參與花粉管生長過程中的許多調節過程,外源鈣濃度可能通過花粉管上的鈣通道調節花粉管內的鈣動態影響花粉管的生長,尤其是在花粉管的極性、頂端的定向生長過程中,鈣過高,牽拉型的鈣通道受到傷害,致使花粉管生長受到抑制[3,15]。筆者通過采用一些常用的鈣通道抑制劑處理花粉,觀察它們對花粉萌發率的影響不是很明顯,表明在藍豬耳花粉中存在足夠的鈣作用于花粉萌發過程。然而,花粉培養3 h后,觀察發現抑制劑對花粉管的生長產生了強烈抑制作用。據此推測,在藍豬耳花粉管生長過程中,外援鈣主要通過對這些抑制劑敏感的鈣通道進入細胞內,由于這些抑制劑主要作用于電壓依賴的鈣通道,所以電壓依賴鈣通道很可能是花粉管生長中從體外環境中吸收鈣離子的重要途徑。Véry等[16]在研究擬南芥根毛伸長生長過程中參與鈣離子內流的鈣通道時指出,鈣離子是通過超級化激活的電壓依賴型鈣通道進入根毛細胞內部的。根毛的生長與花粉管存在相似之處,因此推測在花粉管生長的過程中,類似的鈣通道很可能同樣發揮重要作用。該試驗結果表明,鈣通道對2種無機抑制劑氯化鋁和氯化鑭較為敏感,尤其對L-型鈣通道抑制劑硝苯吡啶表現出更高的敏感性。因此,推測藍豬耳花粉管生長過程中,參與鈣離子吸收的鈣通道可能和根毛的類似。
該試驗結果表明,藍豬耳花粉萌發和花粉管生長對培養基的滲透壓有特殊的要求,主要靠蔗糖來調節滲透壓;硼是藍豬耳花粉萌發中必不可少的微量元素;鈣對花粉管生長起著非常重要的調節作用,并推測鈣離子主要是通過電壓依賴型鈣通道進入花粉管內部。
參考文獻
[1] QIN Y,YANG Z B.Rapid tip growth:Insights from pollen tubes [J].Seminars in cell & developmental biology,2011,22(8):816-824.
[2] STEINHORST L,KUDLA J.Calciuma central regulator of pollen germination and tube growth [J].Biochimica et biophys actamolecular cell research,2013,1833(7):1573-1581.
[3] FEIJ J A,MALH R,OBERMEYER G.Ion dynamics and its possible role during in vitro pollen germination and tube growth[J].Protoplasma,1995,187(1):155-167.
[4] 尚忠林,王永飛,錢洪,等.百合花粉細胞中鈣離子的熒光測定法[J].植物生理學通訊,2001,37(4):319-322.
[5] 徐國華,張紹鈴,張超英,等.梨自花與異花授粉后花粉胞內游離Ca2+分布的變化[J].植物生理與分子生物學學報,2003,29(2):97-103.
[6] HOLDAWAYCLARKE T L,FEIJ J A,HACKETT G R,et al.Pollen tube growth and the intracellular cytosolic calcium gradient oscillate in phase while extracellular calcium influx is delayed [J].Plant cell,1997,9(11):1999-2010.
[7] IWANO M,SHIBA H,MIWA T,et al.Ca2+ dynamics in a pollen grain and papilla cell during pollination of Arabidopsis[J].Plant physiology,2004,136(3):3562-3571.
[8] PIESON E S,MILLER D D,CALLAHAM D A,et al.Tiplocalized calcium entry fluctuates during pollen tube growth [J].Dev Biol,1996,174(1):160-173.
[9] BLEVINS D G,LUKASZEWSKI K M.Boron in plant structure and function [J].Ann Rev Plant Physiol Plant Mol Biol,1998,49:481-500.
[10] LI Y Q,CHEN F,LINSKENS H F,et al.Distribution of unesterified and esterified pectins in cell walls of pollen tubes of flowering plants [J].Sex Plant Reprod,1994,7(3):145-152.
[11] 楊曉冬,孫素琴,李一勤.硼缺乏導致花粉管細胞壁多糖分布的改變[J].植物學報,1999,41(11):1169-1176.
[12] HIGASHIYAMA T,YABE S,SASAKI N,et al.Pollen tube attraction by the synergid cell [J].Science,2001,293(5534):1480-1483.
[13] 胡適宜.被子植物生殖生物學[M].北京:高等教育出版社,2005:46,106,143-148.
[14] 沈捷,祝晨辰,徐進,等.硼、鈣離子對杉木花粉萌發和花粉管生長影響[J].林業科技開發,2010,24(6):57-59.
[15] MALH R,TREWAVAS A J.Localized apical increases of cytosolic free calcium contro pollen tube orientation [J].Plant cell,1996,8(11):1935-1949.
[16] VRY A A,DAVIS J M.Hyperpolarizationactivated calcium channels at the tip of Arabidoosis root hairs [J].Proc Natl Acad Sci USA,2000,97(17):9801-9806.

