色素上皮衍生因子對大鼠視神經夾傷模型視網膜組織中Caspase-3和Bax表達的影響
王斌 趙軍波 蘇春勇
·論著·
色素上皮衍生因子對大鼠視神經夾傷模型視網膜組織中Caspase-3和Bax表達的影響
王斌 趙軍波 蘇春勇
目的 探討色素上皮衍生因子對大鼠視神經夾傷模型視網膜組織中天冬氨酸特異性半胱氨酸蛋白酶3(Caspase-3)、Bax表達的影響。方法 90只SD大鼠隨機分為空白對照組、模型組、色素上皮衍生因子(PEDF)組,每組30只。除空白對照組外,均建立視神經夾傷大鼠模型,均取左側眼球為標本,造模成功后,模型組玻璃體腔內注射平衡鹽溶液5 μl,PEDF組玻璃體內注射PEDF 5 μl(濃度0.2 μg/μl),模型組和PEDF組1周、2周再分2次分別向玻璃體腔注射平衡鹽溶液5 μl和PEDF 5 μl。 3組大鼠均在第3周時取視網膜組織,電鏡下觀察視網膜組織超微結構的改變,采用免疫組化染色法觀察Caspase-3、Bax表達情況,以及視網膜神經節細胞凋亡情況。結果 透射電鏡觀察模型組與PEDF組同空白對照組相比,均存在線粒體水腫、胞質濃縮軸突腫脹。同模型組相比,PEDF組胞質濃縮軸突腫脹輕,線粒體結構較完整。TUNEL法細胞凋亡監測:空白對照組染色陰性,模型組和PEDF組均可檢測到染色陽性的RGCs,PEDF組TUNEL染色陽性的RGCs表達較模型組顯著降低(P<0.05)。PEDF組Caspase-3呈弱陽性表達,模型組呈強陽性表達,PEDF組Caspase-3光密度值顯著低于模型組(P<0.05);模型組、PEDF組Bax表達高于空白對照組(P<0.05),PEDF組Bax表達又低于模型組,差異有統計學意義(P<0.05)。結論 Caspase-3、Bax是誘導RGCs細胞凋亡的重要因子,采用PEDF干預治療能夠降低Caspase-3、Bax表達,減輕RGCs損傷。
視神經夾傷;色素上皮衍生因子;凋亡;Caspase-3; Bax
外傷性視神經損傷主要是眉弓及額部撞擊造成視神經管骨折后出血、水腫、骨折片直接壓迫或管內單一的出血、水腫而造成的視神經損傷。常與顱腦損傷并發,占頭部閉合性損傷的0.5%~5%,該病變多導致視力嚴重受損[1],目前仍然缺乏較好的治療方法。研究表明視神經鉗夾傷后,視網膜神經元存在凋亡是導致視網膜神經節細胞(RGCs)死亡的重要方式[2]。一些與視網膜神經節細胞凋亡有關的基因研究結果表明,天冬氨酸特異性半胱氨酸蛋白酶3(cysteine-containing aspartate-specific proteases-3,caspase-3)介導蛋白酶級聯級反應在視神經損傷中有其重要作用[3]。Bax是促凋亡因子,其在細胞凋亡的多種途徑中均能夠起到相應的作用[4]。色素上皮衍生因子(pigment epithelium-deriverd factor,PEDF)是一種有效的內生性多功能因子,可減輕活體感光細胞光損傷程度及氧化應激中增加視網膜細胞存活,減少局部缺血所致RGCs凋亡[5]。因此,為探討PEDF對視神經夾傷大鼠視網膜組織Caspase-3及Bax表達的影響,本研究建立各視神經夾傷大鼠模型,并給予PEDF治療。
1 材料與方法
1.1 實驗動物 選取健康成年雌性SD大鼠90只(河北醫科大學實驗動物中心提供),體重200~250 g,隨機分為空白對照組、模型組、PEDF組,每組30只,眼部檢查無眼疾。實驗期間3組大鼠自由攝食飲水,通風干燥,光線恒定。
1.2 主要儀器、試劑與藥物 儀器:德國萊卡公司RM-2015型切片機,德國萊卡公司UC-7型超薄切片機,日本三洋公司MIR-153型干燥箱,浙江臨安愛迪儀器廠TMY781B型醫用微波爐,日本OLYMPUS公司BX51T-PHD-J11型光學顯微鏡,中國海爾SC-278 L冰箱,北京離心機廠LDZ-5型離心機,日立H-700型透射光鏡,美國Media Cybernetics公司Image-Pro Plus 6.0多功能真彩色細胞圖像分析管理系統。試劑與藥物:美國Peprotech公司PEDF試劑,滄州光明藥業有限公司氧氟沙星滴眼液,美國Vector Laboratories免疫組化試劑盒,美國Santa Cruz Biotechnology公司caspase-3抗體,美國Santa Cruz Biotechnology公司Bax抗體 ,美國sigma-Aldrich公司3-二胺基聯苯胺鹽酸鹽,北京化學試劑廠水合氯醛等。
1.3 動物模型制作:模型組和PEDF組在禁食12 h后以10%水合氯醛(0.35 ml/100 g)腹腔注射麻醉,采用視神經鉗夾法將左眼制成視神經損傷模型,在球后2 mm 處用壓力恒定(98 g)的反向鑷鉗夾視神經,時間20 s,造成視神經不全損傷。待大鼠瞳孔散大觀察眼底無出血為成功造模。右眼為自身對照眼不予處理。模型組制作視神經損傷模型成功后即刻向玻璃體腔注射平衡鹽溶液5 μl。PEDF組在視神經損傷模型制作成功后即刻向玻璃體腔注射PEDF 5 μl。模型組之后的1周及2周分別再次向玻璃體腔注射平衡鹽溶液5 μl,而PEDF組同樣在1周及2周時分別向玻璃體腔注射PEDF 5 μl。空白組不給予藥物干預。
1.4 取材及切片制備:造模第3周,10%水合氯醛腹腔注射麻醉,于球后視神經2 mm處剪斷視神經,摘除眼球,放入4%多聚甲醛固定24 h后取下角膜、眼前節和玻璃體,將后段眼環用0.9%氯化鈉溶液沖洗血跡4%多聚甲醛固定,4℃冰箱保存。
1.5 電鏡標本的制作與觀察 隨機在3組各取10只大鼠的后段眼環組織將其分割切成較小的組織條,選擇位于視乳頭周圍組織,標記后送電鏡室,由專業人員進行固定、脫水、浸透、包埋將其制成50 nm超薄切片,染色后透射電鏡(型號:日本日立H-7500)觀察、照相。
1.6 視網膜神經節細胞TUNEL免疫組化染色 石蠟切片脫蠟脫水,經孵育、PBS沖洗后滴加TUNEL反應混合溶液,再孵育、PBS沖洗,加入轉化劑-POD后孵育、PBS沖洗,加入DAB底物溶液孵育、PBS沖洗。蘇木素復染細胞核,封片,光學顯微鏡觀察。每張組織標本切片在視乳頭周圍1.5 mm處4個方向對稱各取1個視野,每個眼球只抽取和使用1張切片,采用顯微圖像分析系統進行分析,測定凋亡陽性細胞平均光密度(AOD)值。
1.7 免疫組化 Caspase-3、Bax表達測定。采用免疫組化染色法,嚴格參照試劑使用說明操作,二甲苯脫蠟,梯度酒精水化,緩沖液沖洗,0.3% H2O2孵育,緩沖液沖洗,正常山羊血清封閉,去多余血清,緩沖液稀釋,孵育0.5 h,緩沖液沖洗,滴二抗孵育0.5 h,緩沖液沖洗5 min,過氧化物酶底物溶液孵育,自來水沖洗,復染、分化、透明、中性樹膠封片,光學顯微鏡下觀察Caspase-3、Bax在視網膜表達情況。并采用顯微圖像分析系統進行分析,測定視網膜Caspase-3、Bax光密度值,取其平均值作為該標本的統計數據,
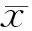
2 結果
2.1 大鼠視神經的超微結構改變 空白對照組視神經髓鞘完整軸漿均勻,軸漿內可見清晰的正常微管、微絲和線粒體,線粒體結構正常無腫脹。模型組出現不同階段的凋亡征象,核膜分辨不清,核質、胞質水腫,細胞器減少,線粒體水腫空泡化,粗面內質網擴張,顆粒融合、脫顆粒現象。PEDF組染色質邊移,輕度厚薄不勻,線粒體數量較模型對照組多,且結構較完整,胞質濃縮軸突腫脹輕。見圖1。


空白對照組模型組PEDF組
圖1 電鏡下大鼠視神經超微結構(×15 000)
2.2 3組大鼠視網膜神經細胞凋亡檢測 空白對照組染色陰性,未見明顯神經細胞凋亡。模型組和PEDF組均可檢測到染色陽性的RGCs,陽性反應細胞呈黃色或棕黃色。模型組可見較多的陽性細胞,PEDF組可見部分TUNEL陽性細胞(3.560±0.012),PEDF組TUNEL染色陽性細胞表達明顯少于模型組陽性細胞表達(8.426±0.013),組間兩兩比較,差異有統計學意義(P<0.01)。見圖2,表1。


空白對照組模型組PEDF組
圖2 視網膜(TUNEL染色×400)
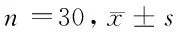

組別凋亡Caspase-3Bax空白對照組00.097±0.0210.095±0.009模型組8.426±0.013*0.194±0.020*0.150±0.008*PEDF組3.560±0.012#0.152±0.008#0.136±0.003#
注:與空白對照組比較,*P<0.05;與模型組比較,#P<0.05
2.3 視網膜組織Caspase-3表達 Caspase-3在視網膜的陽性表達呈棕黃色或褐色,多表達于細胞的胞質內,少量見于細胞核內,Caspase-3在空白對照組視網膜組織基本無表達,模型組視網膜呈強陽性表達,PEDF組Caspase-3呈弱陽性表達,空白對照組視網膜內Caspase-3的平均光密度值(0.097±0.021)低,PEDF組視網膜組織Caspase-3的平均光密度(0.152±0.008)高于空白組,差異有統計學意義(P<0.05)。PEDF組視網膜組織Caspase-3的平均光密度值高于空白對照組而低于模型組的(0.194±0.020),差異有統計學意義(P<0.05)。見圖3,表1。
2.4 視網膜組織Bax的表達 Bax在視網膜的陽性表達呈黃色或深棕黃色,多表達于視網膜的胞質內或細胞核內。空白對照組視網膜內Bax可見一定表達,模型組、PEDF組Bax光密度值較空白對照組均有上升,其中PEDF組光密度值上升的幅度低于模型組。PEDF組(0.136±0.003)的平均光密度值高于空白對照組(0.095±0.009),差異有統計學意義(P<0.05),同時PEDF組(0.136±0.003)的平均光密度值低于模型組的(0.150± 0.008),差異有統計學意義(P<0.05)。見圖4,表1。


空白對照組模型組PEDF組
圖3 視網膜caspase-3(免疫組化染色×400)


空白對照組模型組PEDF組
圖4 視網膜Bax(免疫組化染色×400)
3 討論
近年來,由于意外傷害、交通事故的增多,傷后發現急性視神經損傷造成視力急劇下降的患者較以前明顯增高。目前仍然缺乏較好的治療方法,導致治療效果欠佳,同時治療方面的有關基礎研究也相對薄弱。因此如何使外傷后急性損傷的視神經減輕損害,使已經開始發生凋亡的神經節細胞產生修復,已經成為眼外傷研究領域目前需要迫切解決的問題。有研究發現,視神經損傷后RGCs數量減少是引起患者視覺功能降低的主要原因,同時細胞凋亡及壞死則是引起RGCs數量減少的原因[6]。Caspases是神經損傷后細胞凋亡的一個重要介質,Caspases是負責特異性酶切作用的半胱氨酸蛋白酶。Caspases家族中Caspase-3是重要的凋亡因子,其對凋亡抑制蛋白有著明確的對抗作用。正常生理條件下,其以無活性前Caspase-3形式存在,細胞凋亡時,受上游蛋白酶切割活化的影響,Caspase-3活化,并切割下游底物,并促使其參與DNA損傷修復過程,導致DNA依賴性蛋白激酶活性喪失,引起細胞凋亡形態學變化,導致染色質濃縮,并激活核酸酶,參與DNA斷裂過程,并出現核固縮表現[7]。而Caspases抑制劑可以抑制其促凋亡功能。本研究發現,模型組、PEDF組Caspase-3光密度值均明顯比空白對照組增高,與何家全等[8]研究結果一致,表明Caspase-3在視神經損傷病理過程中有著極其重要的作用。
Bax也是目前所知的與視神經細胞凋亡有關的因子,Bax 本身可形成同源二聚體,使細胞處于凋亡狀態,當機體細胞接受到凋亡信號信息傳遞后,Bax便開始從胞液移動到線粒體外膜,致使線粒體通透性轉換孔開發并導致細胞色素C釋放,激活線粒體介導的細胞凋亡,導致DNA鏈斷裂,使神經節細胞受到嚴重損傷[9]。此外還有學者提出Bcl-2/Bax的動態平衡也是維持細胞穩定的一個因素, Bcl-2/Bax兩者的動態平衡遭受破壞,就可啟動凋亡程序[1]。
PEDF作為一種神經營養因子而首次被發現是1989年Tombran-Tink等[10]從胎兒視網膜色素上皮細胞培養液中發現的。目前已知PEDF在眼部視網膜層、角膜組織、脈絡膜等多種組織中存在,并對神經系統中的許多部位有分化、營養和保護作用,例如初級海馬神經元、小腦顆粒細胞(CGCs)和脊髓運動神經元等[11]。有研究顯示其濃度為0.1 nmol/L時就可以促進細胞生存和軸突生長[12],并能夠使雞胚胎的脊髓運動神經元分化加快,并促進存活[11]。Pang等[13]研究表明,PEDF對視網膜神經節細胞的神經保護功能對體內、體外培養均起作用,并且其作用要強于相同濃度的一些神經營養因子。Houenou等[12]通過切斷新生小鼠坐骨神經后對運動神經元凋亡的觀察實驗證實 PEDF除了保護脊髓和中樞神經系統外還能夠保護周圍神經元,將 PEDF應用于手術部位,則使神經元存活數量明顯增加、殘存的神經元的損傷減輕[14]。此外在一些動物實驗中顯示 PEDF可以調節鈣離子在細胞內外的濃度,而這種調節作用可能是其保護神經的一種作用方式,可能是影響到鈣泵、鈉鈣交換、結合蛋白等,從而起到抗神經毒,抑制凋亡的作用[14]。另外, PEDF 能夠誘導細胞外信號調節激酶蛋白磷酸化使其活化,而對氧化應激狀態下的視網膜色素上皮細胞發揮保護作用[15],這可能也是PEDF神經保護的一個途徑。本實驗采用PEDF玻璃體內注射的方法對視神經夾傷大鼠模型進行干預,應用透視電鏡通過超微結構觀察PEDF組及模型組的細胞器形態、位置的改變,發現PEDF組相比模型組病變胞質濃縮軸突腫脹輕,線粒體結構較完整,同時應用TUNEL法觀察神經細胞凋亡情況,免疫組化染色法觀察Caspase-3、Bax表達情況,結果顯示PEDF組視網膜神經節細胞TUNEL陽性細胞表達、Caspase-3、Bax表達水平均明顯低于模型組,從而肯定PEDF在視神經損傷中的治療作用。
綜上所述,Caspase-3、Bax均參與視神經損傷病理過程,是誘導RGCs細胞凋亡的重要原因,而采用PEDF干預可產生視神經保護作用,降低Caspase-3、Bax表達,減輕RGCs細胞損傷。但目前關于PEDF營養神經、保護神經的研究多集中在動物實驗,臨床研究不多,并且其作用機制仍未完全透徹,仍需不斷深入研究。
1 Warner N,Eggenberger E.Traumatic optic neuropathy:a review of the current literature.Curr Opin Ophthalmol,2010,21:459-462.
2 吳香麗,卞曉蕓,王曉慶.銀杏葉提取物對大鼠視神經挫傷后視網膜形態及視神經GAP-43表達的影響.眼外傷職業眼病雜志,2010,32:321-324.
3 劉恬,劉奕志,鐘惟德,等.色素上皮衍生因子對晶狀體上皮細胞生長的促進作用及其機制.中華實驗眼科雜志,2015,33:342-346.
4 Volkmann N,Marassi FM,Newmeyer DD,et al.The rheostat in the membrane:BCL-2 family proteins and apoptosis.Cell Death Differ,2014,21:206-215.
5 秦柏,管懷進,張俊芳,等.視神經夾傷合并晶狀體損傷大鼠視網膜中神經元型一氧化氮合酶的表達.眼科新進展,2013,33:1128-1131.
6 林琳,王茜,買買江·阿不力孜,等.視神經減壓及地塞米松干預視神經損傷模型兔視網膜Nogo-A Caspase-3的變化.中國醫藥導刊,2015,17:390-396.
7 張靜,李平華.米諾環素對急性視神經炎視神經軸突及Caspase-3表達的影響.國際眼科雜志,2011,11:1337-1339.
8 何家全,楊忠,蔡文琴,等.大鼠視神經的發育學研究.西部醫學,2015,27:486-489.
9 祝文文,曹永亮,王曉莉,等.MSC移植對缺血再灌注損傷視網膜神經節細胞Bcl-2/Bax表達的影響.眼科新進展,2011,31:404-406.
10 Tombran-Tink J,Johnson LV.Neuronal differentiation of retinoblastoma cells induced by medium conditioned by human RPE cells.Invest phthalmol Vis Sci,1989,30:1700-1707.
11 李銳,盛文利.色素上皮源性因子-神經營養和保護因子.國外醫學神經病學神經外科分冊,2005,32:289-292.
12 Houenou LJ,D’Costa AP,Li L,et al.Pigmentepithelium-derivedfactor promo-tes the survival and differentiation of developing spinalmotor neurons.J Comp Neurol,1999,412:506-514.
13 Pang IH,Zeng H,Fleenor DL,et al.Pigment epithelium-derived factor protects retinal ganglion cells.BMC Neurosci,2007,8:11-15.
14 李銳,盛文利.色素上皮源性因子——一種新的神經營養和保護因子.中山大學研究生學刊,2004,25:21-27.
15 李瑞霞,陳海冰.色素上皮衍生因子與氧化應激.醫學綜述,2012,18:1968-1970.
Effects of pigment epithelium derived factor on the expressions of Caspase-3 and Bax in retinal tissues of rat models with optic nerve injury
WANGBin*,ZHAOJunbo,SUChunyong.
*DepartmentofNeurology,CentralHospitalofHandanCity,Hebei,Handan056008,China
Objective To investigate the effects of pigment epithelium derived factor (PEDF) on the expressions of Caspase-3 and Bax in retinal tissues of rat models with optic nerve injury.Methods Ninety healthy female SD rats were randomly divided into three groups:blank control group,model group and PEDF group (experimental group),with 30 rats in each group.Except for blank control group,the rat models with optic nerve injury were established in model group and experimental group.After the animal models were successfully established,the left eye was taken as experimental specimen.The balanced salt solution 5μl was injected into vitreous cavity of rats in model group,and PEDF 5μl (0.2μg/μl) was injected into vitreous cavity of rats in experimental group,moreover, the balanced salt solution 5μl and PEDF 5μl was again injectd into vitreous cavity of rats in modle group and experimental group,respectively on 1 week and on 2 week. On the third week,the retinal tissues of rats in three groups were taken,and the ultrastructural changes of retinal tissues were observed by electron microscopy,and the expression levels of Caspase-3,Bax and the apoptosis of retinal ganglion cells were observed by immunohistochemical staining.Results The mitochondria edema and cytoplasm condensed axon swelling were observed in model group and experimental group. TUNEL cell apoptosis monitoring showed that it was negative in blank control group,however, positive staining of RGCs was found in model group and experimental group,moreover, the positive expression levels of RGCs in experimental group were significantly lower than those in model group (P<0.05).The expression of Caspase-3 was weakly positive in experimental group,which was strong positive in model group. the optical density value of Caspase-3 in experimental group was significantly lower than that in model group (P<0.05).Moreover the expression levels of Bax in model group and experimental group were significantly higher than those in blank control group (P<0.05).However the expression levels of Bax in experimental group were significantly lower than those in model group (P<0.05).Conclusion The Caspase-3 and Bax are important factors inducing apoptosis of RGCs cells.The intervention therapy of PEDF can reduce the expression levels of Caspase-3 and Bax so as to relieve the damage of RGCs.
optic nerve crush injury;pigment epithelium derived factor;apoptosis;Caspase-3;Bax
10.3969/j.issn.1002-7386.2017.13.003
056008 河北省邯鄲市中心醫院神經內四科(王斌),眼科(趙軍波),胸外科(蘇春勇)
趙軍波,056008 河北省邯鄲市中心醫院眼科;
E-mail:hdzxyyyk@126.com
R 774
A
1002-7386(2017)13-1934-05
2016-12-21)

