強精片對雷公藤所致不育癥大鼠精液質量的影響及機制
曲曉偉,陳帝昂,李廣森,常德貴,張培海
(1鄭州人民醫院,鄭州 450003;2 成都中醫藥大學臨床醫學院;3 成都中醫藥大學附屬醫院;4成都中醫藥大學第二附屬醫院)
·基礎研究·
強精片對雷公藤所致不育癥大鼠精液質量的影響及機制
曲曉偉1,陳帝昂2,李廣森3,常德貴4,張培海3
(1鄭州人民醫院,鄭州 450003;2 成都中醫藥大學臨床醫學院;3 成都中醫藥大學附屬醫院;4成都中醫藥大學第二附屬醫院)
目的 探討益腎活血利濕中藥強精片對雷公藤所致不育癥大鼠精液質量的影響及其機制。方法 實驗動物為50只雄性SD大鼠,10只作為空白組,另40只以雷公藤灌胃制作不育癥模型并隨機等分為模型組及強精片低、中、高劑量組,四組均予雷公藤20 mg/(kg·d)灌胃;強精片低、中、高劑量組同時分別予強精片58、105、233 mg/(kg·d)灌胃;空白組予等量生理鹽水灌胃;均1次/d。灌胃后4周檢測各組精液質量、血清性激素水平及睪丸組織Cx43蛋白表達。結果 各強精片組精液質量均好于模型組,血清睪酮水平及睪丸組織Cx43蛋白表達均高于模型組,且呈現出一定的量效關系(P<0.05或<0.01)。結論 益腎活血利濕中藥強精片可改善不育癥大鼠的精液質量,其作用機制可能為調節血清睪酮水平及睪丸組織Cx43蛋白表達。
不育癥;精液質量;強精片;中藥;性激素;細胞間隙連接蛋白;大鼠
近年來不孕不育的發病率呈不斷上升趨勢。歐洲泌尿學協會(EAU)指出,截止2013年,約15%夫婦在結婚1年內不能懷孕,需干預性治療,其中約50%的夫婦被發現男方精液參數存在異常[1]。目前,西醫治療不育癥的臨床效果尚不令人滿意,而傳統醫學在此方面具有一定的優勢[2,3]。強精片是在成都中醫藥大學附屬醫院院內制劑增精1號、增精顆粒基礎上優選而成,主要作用為益腎活血利濕。2013年1月~2014年1月,本研究觀察了強精片對不育癥模型大鼠精液質量的影響,現分析結果并探討其機制,旨在為該藥用于不育癥的治療提供理論依據。
1 材料與方法
1.1 材料 實驗動物:清潔級雄性SD大鼠50只,由成都中醫藥大學動物實驗中心提供(川實動管質第114號),2.5~3個月齡,體質量210~230 g。實驗期間飼養室溫度20~30 ℃,12 h光、12 h暗,自由攝食全價大顆粒飼料及飲水,馴養l周后備實驗用。實驗藥物及試劑:強精片由成都中醫藥大學附屬醫院提供(批號:000613),規格為0.35 g/片,100片/瓶。將強精片研末,并溶于1%的羧甲基纖維素鈉溶液(CMC-Na)中,配制成實驗所需濃度混懸液備用。雷公藤多甙片(以下稱雷公藤)由上海醫科大學紅旗制藥廠生產(批號:990219),規格為10 mg/片。將雷公藤研末,溶于1%的CMC-Na中,配制成濃度為2 mg/mL混懸液備用。睪酮(T)、促卵泡成熟激素(FSH)、黃體生成激素(LH)放射免疫分析試劑盒(天津德普生物技術和醫學產品有限公司),考馬斯亮藍染液(PA101,北京天根生化公司),BA200 Digital數碼三目攝像顯微攝像系統(麥克奧迪實業集團有限公司),DYY-7C型轉印電泳儀器、DYCZ-24DN型電泳儀(北京六一儀器廠),顯影定影液(日本柯達公司),Gel-Pro Analyzer免疫印跡分析軟件(中國上海Informax Inc.),Image-Pro Plus6.0圖像分析系統(美國Media Cybernetics公司),WLJY-9000型精子質量檢測系統(CASA)。1.2 不育癥模型制作及干預 取10只大鼠為空白組;取40只大鼠為造模組,制作不育癥模型[4~6]:以雷公藤混懸液(濃度2 mg/mL)灌胃,1次/d,連續3周。3周后兩組各隨機抽取10只行模型評價。造模組附睪精子密度、活力及活率均降低,與空白組比較有極顯著差異,說明模型大鼠睪丸及附睪功能障礙,生殖力降低,提示造模成功。驗證模型成功后,將40只模型大鼠隨機分為模型組及強精片低、中、高劑量組,各10只。四組均繼續予雷公藤20 mg/(kg·d)灌胃,同時強精片低、中、高劑量組分別予強精片58、105、233 mg/(kg·d)灌胃;另設空白組(10只),予等量生理鹽水灌胃。灌胃均1次/d,共4周。實驗過程中各組大鼠均自由攝食、飲水。實驗過程中模型組2只、強精片高劑量組1只死亡。
1.3 相關指標觀察 各組于末次灌胃2 h行腹主動脈取血10 mL,室溫靜置30 min后,2 500 r/min離心25 min,取血清。摘取大鼠雙側睪丸,去除白膜及大血管,液氮凍存,并留取電鏡標本。
1.3.1 精液質量檢測 摘取大鼠雙側睪丸即刻,參考俞莉春等[7]、商學軍等[8]收集檢測精液方法稍加改進,應用擴散法收集附睪尾部精子。取附睪尾部放入37 ℃生理鹽水(提前預熱)3 mL中,剪碎組織,放置1~2 min,取精子混懸液,加入1 mL M199中,37 ℃恒溫水浴5 min,取適量加到預溫的血細胞計數板上,應用WLJY-9000型精子質量檢測系統行精子質量分析。將經處理的精子混懸液涂于計數載玻片上,取4個視野,于2 min內完成檢測。檢測指標:精子密度(1×106個/mL)、精子活力(%)、精子活率(%)。1.3.2 睪丸組織病理學觀察 睪丸組織行HE染色,光學顯微鏡下觀察組織病理學變化。
1.3.3 睪丸組織Cx43蛋白表達檢測 取各組液氮冷凍睪丸組織約100 mg,放入1 mL預冷的RIPA組織裂解液中,在玻璃勻漿器中勻漿破碎細胞,操作在冰上進行,每次勻漿約1 min,間隔5 min勻漿1次,共5次。4 ℃下放置2 h。4 ℃下12 000 r/min離心約5 min,取上清液。分裝少量上清液用于總蛋白濃度的測定,其余的加入等體積2×加樣緩沖液,100 ℃水浴10 min,分裝后-20 ℃保存。依照BCA蛋白濃度測定試劑盒說明書進行操作:配置濃度為0.5 mg/mL的蛋白標準液,用于標準曲線的繪制。參考使用說明,完成樣品的上樣、轉膜、NC膜的封閉與抗體孵化、顯影。在X線片機下對曝光后的X片照相,應用Gel-Pro Analyzer4.0圖像分析軟件對蛋白條帶的灰度值參數進行測量計算。采用Gel-Pro Analyzer免疫印跡分析軟件對圖像多次檢測條帶OD值,取平均值。
1.3.4 血清性激素水平測定 采用放射免疫法測定各組血清T、FSH、LH。按試劑盒說明操作。
1.4 統計學方法 采用SPSS19.0統計軟件。多組比較采用單因素方差分析,方差齊性用LSD、S-N-K檢驗,方差不齊采用秩和檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組精液質量比較 見表1。
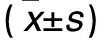
表1 各組精液質量檢測結果比較
注:與空白組比較,△P<0.01;與模型組比較,#P<0.05,▲P<0.01;與強精片低、中劑量組比較,●P<0.05。
2.2 各組睪丸組織病理學變化 空白組睪丸生精小管圓而飽滿,生精上皮完整,管壁生精細胞、支持細胞分層排列有序, 支持細胞間緊密連接,精原細胞致密規律排列,管腔內見大量成熟精子,生精小管間見疏松間質組織,間質無充血水腫,無炎細胞浸潤及纖維結締組織增生。模型組睪丸生精小管管徑大小不一,管壁細胞減少,排列紊亂,生精上皮變薄,部分基底膜破裂溶解,初級、次級精母細胞和精細胞銳減,細胞間隙增大,支持細胞間連接變寬,部分管腔阻塞或塌陷,成熟精子消失,間質水腫、輪廓不清。強精片各組生精小管基膜基本完整,管壁厚而圓,可見各個發育階段的生精細胞和支持細胞,管腔中有較多成熟的精子,間質細胞成群分布于生精小管之間的疏松結締組織內,且呈現出一定的量效關系。2.3 睪丸組織Cx43蛋白表達 空白組、模型組及強精片低、中、高劑量組睪丸組織Cx43蛋白相對表達量分別為0.562 7±0.029 0、0.449 9±0.035 0、0.475 1±0.048 5、0.504 0±0.023 0、0.507 6±0.047 0,模型組與空白組比較P<0.05,強精片中、高劑量組與模型組比較,P均<0.05。見圖1。

注:BG為空白組;MG為模型組;QJPL/QJPM/QJPH分別為強精片低、中、高劑量組。
2.4 各組血清性激素水平 見表2。
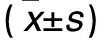
表2 各組血清T、FSH、LH水平比較
注:與空白組比較,△P<0.01;與模型組比較,#P<0.05,▲P<0.01;與強精片低、中劑量組比較,●P<0.01。
3 討論
強精片為臨床經驗方藥增精1號、增精顆粒優選而成,主要成分為人參、鹿角、當歸、枸杞子、菟絲子、淫羊藿等,具有益腎活血利濕之功。前期相關研究表明,該經驗方可增加附睪重量和管壁厚度,促進損傷附睪上皮恢復和上皮細胞的分泌,從而改善附睪精子成熟功能,提高精子質量[9~11];強精片的具體作用效果及機制尚不明了。且當前傳統醫學在此領域的理論基礎尚不完善和系統,其改善精子質量的作用機制尚不明晰,特別是對睪丸精子發生微環境等方面的研究尚不夠深入。
本研究結果顯示,與空白組比較,模型組精子密度、活力、活率明顯降低;強精片各組在用藥4周后精子密度、活力、活率均有提高,且呈現出一定的量效關系,其中以高劑量組對精液質量改善效果最為顯著,低劑量組與中劑量組比較差異無統計學意義。提示強精片能夠改善精液質量。本研究睪丸組織病理學結果顯示,強精片各組睪丸組織病理改變程度明顯輕于模型組,且呈現出一定的量效關系。提示強精片可促進損傷附睪上皮恢復和上皮細胞分泌。
丘腦-垂體-性腺軸調控系統作為人體內重要的激素調控網絡,是睪丸生理功能正常發揮的前提條件。下丘腦分泌的促性腺激素釋放激素刺激垂體分泌LH和FSH。睪丸間質細胞在LH脈沖式釋放的生理刺激下連續不斷的生成和分泌T。T經血液循環進入精曲小管,供精子生成所需。FSH隨著血液循環到睪丸,與精曲小管的支持細胞膜受體結合,刺激性激素結合蛋白(TBG)的生成,高濃度TBG使精曲小管腔內的T濃度維持在較高的水平,可促進生殖細胞分化為成熟的精子[12]。研究發現,大鼠睪丸中睪酮的消除可導致生殖細胞凋亡的增加,證實睪酮可能具有細胞存活因子的功能,可阻止生殖細胞凋亡,亦表明男性體內的睪酮是一種關鍵的生殖細胞存活因子[13]。本研究結果顯示,雷公藤對血清性激素水平影響不大,但空白組相比模型組血清睪酮值明顯降低,與國內學者的研究結果基本一致,這可能與雷公藤的灌胃濃度、灌胃次數及時間等因素有關[14]。研究發現,雷公藤在一定濃度下能夠抑制Sertoli細胞、Leydig細胞的細胞活性,這可能是雷公藤導致睪酮下降的原因之一[15]。本研究強精片各組血清睪酮明顯高于模型組,但各組血清FSH、LH水平無明顯統計學差異,說明強精片可調節大鼠血清睪酮水平;其機制可能是通過擬性激素樣作用直接調控丘腦及垂體、抗氧化應激、抑制生殖細胞衰老基因表達、激活性腺軸系統相關酶活性及促進激素分泌等方式,最終改善和調整性腺軸系統的器官形態結構,從而改善睪丸生精功能,提高生殖能力。
睪丸組織內主要包括生精細胞、間質細胞及支持細胞三種功能細胞。其中生精細胞為產生精子的“原料”,間質細胞和支持細胞則輔助生精細胞生成精子,對精子的生成和睪丸正常功能的維持具有重要作用。睪丸支持細胞構成血睪丸屏障、維持睪丸內正常微環境,對生殖細胞起著支持和營養作用;睪丸間質細胞則分泌雄激素等活性物質以調節生殖功能。研究表明,這兩種細胞的作用與其細胞間的縫隙連接(GJ)功能密切相關。GJ是細胞間的一種特殊通道,溝通相鄰細胞的胞質,介導細胞間直接的信號傳遞。GJ由特殊的連接蛋白組成,Cx43作為睪丸中表達最豐富的連接蛋白,是睪丸內細胞間通信的重要物質基礎。睪丸支持細胞表達Cx43占90%以上;睪丸間質細胞則僅表達Cx43。由Cx43組成的GJ介導睪丸支持細胞對生精細胞的支持和營養作用,對睪丸間質細胞的內分泌活動也起重要調節作用[16~18]。雷公藤能夠從RNA水平干擾Cx43蛋白的合成,降低生殖細胞Cx43蛋白表達量,影響生精細胞和其周圍體細胞間的代謝交換和內分泌、旁分泌生長因子的傳遞,從而影響睪丸生殖功能[19]。本研究模型組睪丸組織內Cx43蛋白表達量明顯下降,提示雷公藤可能通過抑制Cx43表達,影響了睪丸內支持細胞、間質細胞的功能以及支持細胞對生精細胞的調節。這與其他雷公藤生殖毒性機制的相關研究結果相符。本研究強精片中、高劑量組Cx43蛋白表達量明顯高于模型組,提示強精片能提高Cx43蛋白在睪丸組織內的表達,但其對Cx43蛋白調節的具體分子機制,尚需后續研究進一步明確。
綜上所述,強精片可明顯改善不育癥大鼠的精液質量,提高其生殖功能。推測其機制可能與調節血清睪酮水平及促進睪丸組織Cx43蛋白表達有關,尚有待進一步深入研究。
[1] Jungwirth A, Giwercman A, Tournaye H, et al. European association of urology guidelines on male infertility: the 2013 update[J]. European urology, 2013,62(2):324-332.
[2] 郭軍,宋春生,耿強,等.六五生精湯治療少弱精子癥不育的臨床觀察[J].中國中西醫結合雜志,2007,27(11):986-988.
[3] 姚重華,賓彬.中醫藥治療男性不育癥研究進展[J].山東中醫雜志,2006,25(3):212-214.
[4] 余白蓉,秦達念,楊奇華.菟絲子黃酮與淫羊藿黃酮對雄性生殖功能影響的比較研究[J].中華實用中西醫雜志,2003,16(6):842-844.
[5] 冷會勇,石炳娟,張言敏,等.十八味中藥組方對雄性大鼠不育模型生殖系統的影響[J].生殖醫學雜志,2008,17(2):114-117.
[6] 俞晶華,卞慧敏,張啟春,等.補天育麟顆粒對雷公藤多苷致大鼠不育癥模型的影響[J].南京中醫藥大學學報,2007,23(5):313-315.
[7] 俞莉春,王沭沂,楊小芳,等.應用計算機輔助精子分析系統檢測鎘對大鼠精子運動能力的影響[J].中華勞動衛生職業病雜志,2000,18(4):223-225.
[8] 商學軍,劉清珍,王玲玲,等.L-肉堿對奧硝唑致大鼠精子及生育力損傷的保護作用觀察[J].山東醫藥,2010,50(50):11-13.
[9] 杜位良,常德貴,張太君,等.增精顆粒對大鼠附睪功能性指標GPC及SA的影響[J].中國男科學雜志,2004,18(1):22-25.
[10] 杜位良,常德貴,張太君,等.增精顆粒對大鼠附睪精子質量的影響[J].中華男科學雜志,2004,10(2):155-159.
[11] 常德貴,張培海,胡志萍,等.增精1號膠囊對少精子癥患者精子動態及形態的影響[J].中國中西醫結合雜志,2009,29(11):1029-1030.
[12] 蔡新,王禮文,何映.男性不育癥中醫證型與精液參數及血清性激素關系的初步探討[J].中華男科學雜志,2003,9(5):396-399.
[13] 查樹偉,查佶,黃宇烽,等.男性抗生育藥與細胞凋亡[J].中華男科學雜志,2008,14(1):75-78.
[14] 俞晶華,卞慧敏,張啟春.補天育麟顆粒對雷公藤多苷致大鼠不育癥模型的影響[J].南京中醫藥大學學報,2007,23(5):313.
[15] 景曉平,何麗.補腎中藥對雷公藤多苷所致生殖損傷雄性幼鼠血清睪酮及睪丸組織P450scc的影響[J].中國實驗方劑學雜志,2013,19(10):242-245.
[16] Gilleron J, Carette D, Durand P, et al. C/onnexin 43 a potential regulator of cell proliferation and apoptosis within the seminiferous epithelium[J]. Int J Biochem Cell Biol, 2009,41(6):1381-1390.
[17] Brehm R, Zeiler M, Ruttinger C, et al. A sertoli cell-specific knockout of connexin 43 prevents initiation of spermatogenesis[J]. Am J pathol, 2007,171(1):19-31.
[18] 鄭素平,洪曉婷,王琴,等.以siRNA表達載體穩定抑制縫隙連接蛋白43表達的睪丸間質細胞和睪丸支持細胞系的建立[J].中國藥理學通報,2010,26(10):1285-1289.
[19] 楊涓,高慧,韓冰,等.雷公藤多苷對大鼠卵泡發育及其旁分泌調控機制的影響[J].中國藥房,2011,22(31):2886-2889.
國家自然科學基金資助項目(81302983)。
張培海(E-mail: zhangpeihai@126.com)
10.3969/j.issn.1002-266X.2017.20.008
R698.2
A
1002-266X(2017)20-0028-04
2016-03-24)

