腰椎后路內固定術后椎間融合器移位原因分析及對策探討
詹吉恒,王羽豐,王高蔚
(1.廣州中醫藥大學第二臨床醫學院,廣東 廣州 510405;2.廣東省中醫院骨一科,廣東 廣州 510120)
?
臨床經驗
腰椎后路內固定術后椎間融合器移位原因分析及對策探討
詹吉恒1,王羽豐2,王高蔚1
(1.廣州中醫藥大學第二臨床醫學院,廣東 廣州 510405;2.廣東省中醫院骨一科,廣東 廣州 510120)
目的 探討后路腰椎椎間融合術后融合器移位的相關危險因素及處理對策。方法 收集2010年1月至2015年4月期間我科行腰椎后路椎間融合內固定術的1 332例患者的臨床資料,隨訪期間融合器位置較初次手術發生改變者共42例,其中通過影像學確診為融合器明顯移位的共有8例,對這8例患者的臨床資料特點進行回顧性分析,分析各種可能引起融合器移位的危險因素并探討對應的處理措施。結果 本組7例患者融合器向后移位,1例塌陷進入相鄰椎體中,總體發生率為0.6%(8/1 332)。其發生與融合器的選擇不恰當、術前未對影像學資料進行合理評估、手術操作不規范、未行有效的后路內固定以及患者的一系列基礎疾病等有關,多數病例為多種因素的共同作用。結論 引起腰部融合術后融合器移位的相關因素有很多,原因復雜,包括融合器及內固定因素、手術操作及患者的自身因素等。術后因融合器移位出現神經壓迫癥狀,經保守治療未見好轉者則必須行翻修手術治療。
腰椎后路融合術;手術并發癥;融合器移位;翻修手術
后路椎間融合內固定術作為針對腰椎退行性變的一種有效治療手段,可以維持脊柱軸向穩定性,恢復椎間隙高度,對壓迫的神經行有效減壓[1-4]。即便如此,術后椎間融合器(Cage)移位這一并發癥卻時有發生,其文獻報道的發生率在0.8%~4.7%之間[5],因隨訪時間長短而有所差異,其中以向后移位以及椎體內下沉為多見。雖然發生率不高,但一旦出現便可能導致神經受壓損傷、融合失敗等嚴重后果。因此這一術后并發癥受到了國內外學者的廣泛關注,對其發生的高危因素也進行了充分的研究。本文對可能的原因進行總結分析并探討其治療措施,現報告如下。
1 資料與方法
1.1 一般資料 本組1 332例為我科2010年1月至2015年4月期間行腰椎后路椎間融合內固定術的患者,隨訪期間Cage位置較初次術后發生改變者共42例,占3.1%。病例分布:男性20例,女性22例;年齡42~77歲,平均(61.2±8.8)歲。腰椎間盤突出癥手術6例,腰椎管狹窄癥手術24例,腰椎滑脫癥手術12例,其中Ⅰ°滑脫11例,Ⅱ°滑脫1例。這42例患者中有20例為雙節段病變,6例為多節段(≥3個)病變。本組共融合66個間隙,使用的Cage包括PEEK材料、碳纖維材料以及納米材料,并附加鈦合金材料的椎弓根釘棒系統固定。依據術者的習慣和術中具體情況選擇使用不同形狀和大小的融合器,其中19個間隙使用箱型融合器,47個間隙使用子彈型融合器;根據矢狀位CT或MRI,將病變椎間隙的形態進行分類,其中上下平行形28個間隙,梭形10個間隙,梨形7個間隙,開口形21個間隙。
1.2 手術方式 全麻成功后,患者俯臥于手術床,透視確定手術節段。沿腰部正中作縱形切口,依次切開皮下組織、筋膜,從棘突及椎板表面分離椎旁肌肉及軟組織,充分暴露關節突、橫突、峽部以及椎弓根釘進針點,使用骨刀去除病變間隙上位椎體下關節突及部分下位椎體上關節突,顯露并保護硬膜囊和神經根,切開纖維環,摘除髓核組織,去除椎間盤,使用不同型號終板處理器刮除軟骨終板,直至露出骨性終板,由小到大打入融合器試模,逐漸撐開椎間隙,沖洗后在間隙前部分及對側內填充自體碎骨塊并壓實,根據試模選擇合適大小的椎間融合器,在其內填塞滿碎骨屑,斜行置入間隙內。在病變間隙的上下椎體置入椎弓根釘,安裝鈦棒,透視椎間隙高度、螺釘和融合器位置均理想后,在置入融合器側先行加壓椎間隙,旋緊釘棒連接螺母,然后再加壓對側,緊固釘棒各連接處。再次探視神經根并確認減壓充分。生理鹽水沖洗術區,充分止血;清點無誤后,放置引流管,逐層緊密縫合切口。
1.3 術后處理 術后根據引流量拔除引流管,常規應用抗生素、營養神經及消水腫藥物。早期指導患者進行踝泵以減少下肢深靜脈血栓的發生,進行直腿抬高及床上踩單車訓練以減輕術后神經根黏連,加強腰背肌功能鍛煉,2~3 d后在腰圍保護下下地進行活動。
1.4 隨訪標準 所有患者分別于術后1、3、6、12個月及末次隨訪行腰椎X線檢查,必要時行CT及MRI檢查。若影像學檢查提示融合器周圍有連續的骨小梁形成或融合節段過伸、過屈側位X線片提示椎體間角度小于5°,則判斷為臨床愈合。
2 結 果
對術后Cage位置發生改變的42例患者均再進行3~18個月的隨訪。位置發生輕度改變者(小于3 mm)34例,占2.5%,其中19例無明顯特殊癥狀,余下15例患者出現一定程度的腰骶部酸痛不適,予以保守治療,至末次隨訪時影像學檢查提示融合器未進一步發生移位,并出現不同程度骨性融合,腰部癥狀均明顯緩解。術后出現融合器明顯移位者(大于3 mm)共8例(見表1),7例向后移位至椎管內,1例在相鄰椎體內塌陷,發生率為0.6%(8/1 332),均有不同程度的腰痛,其中6例出現典型神經根性痛,相應下肢肌力、感覺和大小便障礙,對此6例患者予更換新的融合器或行椎間植入髂骨塊代替;另外2例因深部感染所致者則予拆除原內固定器械并徹底清創,臥床休息并限制活動。二次術后至末次隨訪腰部癥狀和神經根性、馬鞍區癥狀均完全改善,其中6例重新行椎間融合的患者影像學提示翻修的融合器或髂骨塊位置良好,無明顯移位,均達骨性融合,椎弓根螺釘未發生松動等表現;2例感染患者手術椎間隙出現輕度塌陷,椎體前后緣出現不同程度骨贅增生并連接成骨橋,動力位X線片未見明顯不穩,下地行走活動正常,炎癥指標均恢復至正常水平。
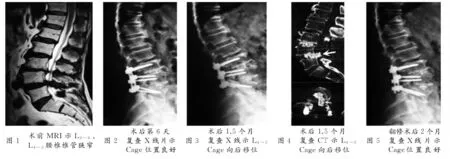
典型病例為一71歲男性患者,診斷為L3~4、L4~5腰椎椎管狹窄癥,行L3~5椎間盤切除+椎間植骨融合內固定術。術后第6天復查X線見Cage位置良好。術后1.5個月出現腰痛及神經根性癥狀,復查X線及CT提示L4~5Cage向后移位,行二次手術更換為大號Cage重新置入。翻修術后2個月復查Cage位置良好。手術前后影像學資料見圖1~5。
3 討 論
腰椎融合手術從單純使用植骨融合發展至聯合使用椎間融合器和釘棒系統,手術的損傷亦趨于微創。但術后融合器移位這一并發癥卻仍然存在,盡管發生率很低,但卻嚴重影響手術療效。該現象的原因十分復雜,通過回顧性分析本組以及參考相關文獻,可歸納為以下因素。
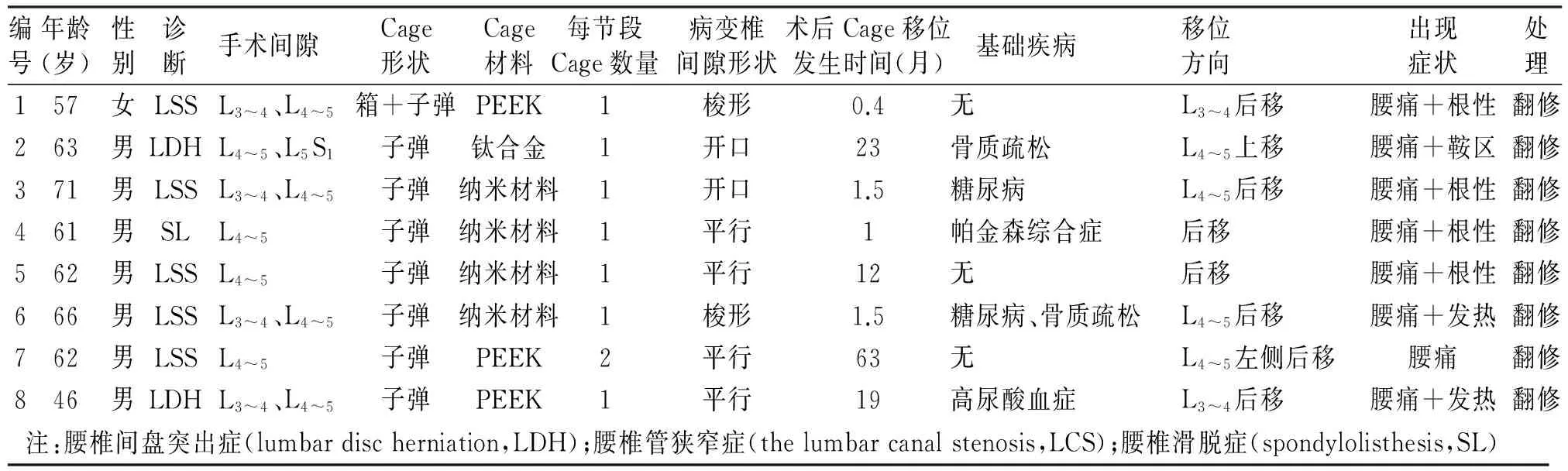
表1 8例明顯融合器移位患者情況比較
3.1 融合器的選擇應用 融合器作為腰椎融合手術的重要一環,當選擇的融合器不恰當就容易出現術后Cage的移位[6]。a)融合器過小時不能與相鄰椎體形成良好接觸,從而降低了融合成功率[7]。融合器過大則會提高置入難度,且因Cage與終板間的應力過大而增加其陷入相鄰椎體內的概率。為了選取更適合的Cage型號,在術前對影像學資料進行充分測量以及術中試模是必不可少的[8]。對術前椎間隙高度明顯丟失者,應盡量撐開椎間隙,選擇比術前椎間隙高度大的融合器,使“撐開-壓縮”原理更好地作用于融合器;而對于術前椎間隙高度正常者,則需選擇與椎間隙高度一致的融合器,置入Cage后對椎間隙進行充分的加壓鎖緊,均可有效預防術后Cage移位的發生[9]。b)目前較為主流的融合器是子彈型(解剖型)以及箱型兩種。前者考慮到椎體終板的生理形態,其上下緣設計為微凸面,與大多數相鄰椎體上下終板的凹面相吻合,使之相互貼合更緊密,載荷的分布也更加平均[10]。而箱型融合器主要依靠8個角與終板相接觸,相對于前者,其應力更為集中導致椎體內塌陷現象的高發。為了使融合器與終板更好地貼合,提高融合成功率,建議水平形椎間隙者選用箱型Cage,而梭形者則選用子彈型Cage。c)以往研究較少對融合器材料進行觀察,有限元模型分析[11]發現PEEK材料的融合器與終板間的應力更小,可以有效防止Cage塌陷的發生;且其中填充的自體骨承受的應力較鈦合金材料者大,其融合率更高。生物力學研究還發現[12],PEEK材料產生更小的應力遮擋,能夠刺激骨的生長,取得良好的融合效果。納米羥基磷灰石作為仿生材料,其彈性模量與人體相近,在融合術后患者腰部的長期活動中,Cage除因產生應力遮擋效應外[13]還由于其上下緣齒紋吸收磨蝕變淺致移位。d)對于融合器放置的位置,現今仍存在一定的爭論[14]。Abbushi[15]通過對椎體的終板進行生物力學研究,發現當融合器在椎間隙后緣靠中央時其移位率最低。國內學者亦提出類似觀點[16],認為融合器植入位置靠后時,將造成Cage前緣與椎體終板貼合不佳,融合器承重面積減小,勢必影響骨性融合和自身穩定性。另外在擴張管道下行微創經椎間孔入路腰椎椎間融合術(minimally invasive surgery-transforaminal lumbar interbody fusion,MIS-TLIF)時,術中透視確保管道與椎間隙平行是避免融合器在術后即時發生椎體內塌陷的重要方法。e)與放置單枚Cage相比,單間隙使用2枚Cage時移位的發生率更高。置入2枚Cage時,融合器往往會偏心放置,其頭端容易發生相互碰撞[17]。且置入2枚Cage時不可避免地要過多地破壞脊柱的后方穩定結構[18],這些均能導致術后融合器移位的發生。
3.2 病變節段的椎間隙形狀與處理 a)本研究首次提出根據術前影像學資料,將椎間隙歸納為四種(見圖6):上下平行、梭形、梨形以及開口形。這也與Abbushi[15]、Kimura[19]及Aoki[3]等的理論總結相符合。在術前通過了解手術節段椎間隙的形態使術者在選取合適形狀的Cage時更有把握。b)椎間隙內殘余的髓核組織過多會導致界面的結合不佳,置入融合器后會影響Cage與椎體的良好接觸[5],因此在置入融合器前,務必反復確認椎間隙是否有殘余的髓核組織。c)椎體的上下終板與融合器直接接觸,保留骨性終板是達到自體椎間融合理想生物力學的基礎[1],同時是防止融合器塌陷的重要結構。當骨性終板去除過多時,Cage陷入相鄰的椎體內的概率相應增高。在腰椎融合術中,對于骨性終板的處理各研究有不同的主張[20-21],我們主張把軟骨終板連同纖維環及髓核組織一并除去,并同時保留骨性終板。
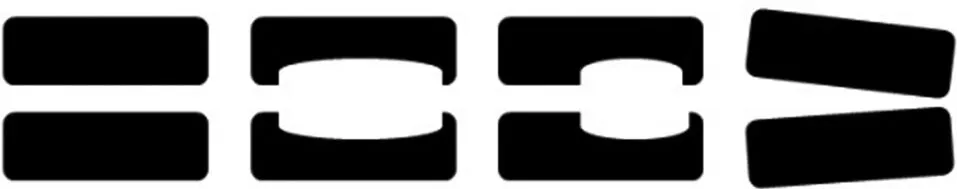
a 上下平行 b 梭形 c 梨形 d 開口
圖6 病變椎間隙的不同形態
3.3 內固定的使用情況 a)早期使用Titanium-Threaded Cage及BAK Cage時[22-23],有較多文獻報道術后假關節的現象,這也是術后早期(3個月內)融合器移位發生率較高的原因。早期的Cage大多是帶有螺紋或較深齒紋的,增加了與椎體的接觸面積及把持力。然而現在常用的融合器其突起的齒紋較淺且咬合力差[23],為了達到減壓的目的需要行次全椎板或全椎板切除減壓,導致脊柱穩定性進一步降低,難以單獨依靠Cage達到椎間穩定性[22]。因此使用后路內固定系統是必須的,它可以顯著增加減壓后腰椎的軸向穩定性,并有效降低融合器的移位[24]。b)雖然Duncan等[25]通過隨機對照研究發現單側固定術后融合器移位發生率(23%)較雙側固定者(11%)高,但Aoki[3]對于大量單邊釘固定者進行長時間隨訪,發現單雙側固定對Cage移位影響的差異性沒有統計學意義。但是在腰椎過屈及旋轉時,單邊釘的穩定性遠低于雙邊釘固定者。在合并有脊柱退變性側彎的患者中,使用單邊釘固定會增加脊柱失穩及Cage移位發生率。
3.4 患者自身因素 在確保手術操作得當后,還應該關注患者基礎疾病。a)對于腰椎融合術而言,感染所引起的局部炎性滲出會阻擋融合器與椎體間的接觸,所以術后感染的患者其椎間融合率較低而Cage移位的發生率和內固定松脫概率均較高。切口局部的淺表感染,處理不當會演變成為椎間隙的深部感染[26],最終被迫取出原內固定裝置。此外,肥胖和糖尿病患者常相互并存[15,26-27],均是引起術后感染的危險因素。b)骨質疏松患者由于骨密度比一般人群低,在使用椎間融合器時,與相鄰椎體間彈性模量差異大,在術后長期生活中Cage會逐漸發生塌陷。Chen等[1]的研究發現當Cage下沉進入相鄰椎體時,腰椎的生理前凸角度及椎間隙的高度均有所丟失。當腰椎存在不穩且合并有骨質疏松時,椎體的活動可導致融合器的移位[22]。而術后積極的抗骨質疏松治療能有效減慢這一進程[28]。c)Babat[29]在行脊柱內植物手術的帕金森患者的研究中,發現因神經系統異常引起的微細顫動及長期的駝背畸形可能是這類患者脊柱內固定手術失敗的原因。
3.5 對策探討 腰椎融合術后Cage移位會引起椎管的進一步狹窄[15],導致對神經的直接壓迫,最終阻礙椎間融合,但該并發癥主要是因為手術操作不當及術前缺乏合理規劃引起[30],因此是可防可治的。術前準確觀察并測量椎間隙的形態以及大小,術中再次試模,務求做到融合器與椎間隙相匹配。置入Cage前應妥善處理殘余的髓核等軟組織,并保留骨性終板;所選Cage與椎體的接觸面應盡量大,以PEEK材料為佳,放置在椎間隙后緣近中央處其穩定性最好。對于年老且存在骨質疏松、糖尿病及帕金森綜合征等高危因素的患者因積極做好基礎疾病的治療。術后一旦發現Cage移位,因明確具體原因,對于位置發生輕度改變而無明顯繼發癥狀者可保守治療,制動腰部直至椎間隙達到骨性融合的穩定狀態。國外文獻報道融合器移位、脫出、位置不佳致神經受壓等需要再次手術的發生率(4.4%~15%)[31-32]明顯高于本研究,當Cage發生明顯移位時通常伴隨明顯的神經損傷癥狀,需通過翻修手術更換為大號的Cage重新置入并充分加壓。再次手術重點在于使用融合器試模由小至大逐級撐開椎間隙到合適高度,同時注意清理殘留的髓核組織和/或軟骨終板。對于內固定周圍存在深部感染病灶者,需通過徹底清創為椎間隙提供良好的骨接觸面,為了保證融合成功率并避免異物排除反應,應將Cage更換為自體骨塊。術后配合廣譜或敏感抗生素使用以控制感染病情,必要時需徹底拆除原內固定器械。
[1]Chen L,Yang H,Tang T.Cage migration in spondylolisthesis treated with posterior lumbar interbody fusion using BAK cages[J].Spine (Phila Pa 1976),2005,30(19):2171-2175.
[2]潘杰,錢列,譚軍.微創經椎間孔腰椎椎體間融合術的研究進展[J].中國矯形外科雜志,2009(21):1624-1628.
[3]Aoki Y,Yamagata M,Nakajima F,et al.Examining risk factors for posterior migration of fusion cages following transforaminal lumbar interbody fusion:a possible limitation of unilateral pedicle screw fixation[J].J Neurosurg Spine,2010,13(3):381-387.
[4]張國威,林宏生,吳昊,等.TLIF與PLIF治療腰椎退變性疾病的療效對比[J].暨南大學學報(自然科學與醫學版),2012,23(6):591-596.
[5]王建平,蔡林,胡東才.腰椎融合術后融合器移位的原因及處理對策[J].臨床外科雜志,2014,22(5):317-319.
[6]楊文成,董有海.腰椎椎間融合研究進展[J].國際骨科學雜志,2011(01):37-39.
[7]Lee JG,Lee SM,Kim SW,et al.Repeated migration of a fusion cage after posterior lumbar interbody fusion[J].Korean J Spine,2013,10(1):25-27.
[8]Yan D,Pei F,Li J,et al.Comparative study of PILF and TLIF treatment in adult degenerative spondylolisthesis[J].European Spine Journal,2008,17(10):1311-1316.
[9]Yu CH,Wang CT,Chen PQ.Instrumented posterior lumbar interbody fusion in adult spondylolisthesis[J].Clin Orthop Relat Res,2008,466(12):3034-3043.
[10]苗驚雷,張朝躍,詹瑞森,等.置入椎間融合器行腰椎融合后Cage移位的原因[J].中國組織工程研究與臨床康復,2011,15(39):7307-7310.
[11]Vadapalli S,Sairyo K,Goel VK,et al.Biomechanical rationale for using polyetheretherketone (PEEK) spacers for lumbar interbody fusion-A finite element study[J].Spine (Phila Pa 1976),2006,31(26):E992-E998.
[12]李慶春,覃格姬,喬鎮,等.后路腰椎椎間融合器的優化設計[J].中國組織工程研究,2013,17(4):658-662.
[13]馬金梁,汪洋,黃帆,等.部分可吸收椎間融合器的設計及有限元分析[J].第二軍醫大學學報,2012,33(8):837-841.
[14]Labrom RD,Tan JS,Reilly CW,et al.The effect of interbody cage positioning on lumbosacral vertebral endplate failure in compression[J].Spine (Phila Pa 1976),2005,30(19):E556-E561.
[15]Abbushi A,cabraja M,Thomale U,et al.The influence of cage positioning and cage type on cage migration and fusion rates in patients with monosegmental posterior lumbar interbody fusion and posterior fixation[J].European Spine Journal,2009,18(11):1621-1628.
[16]張凱,張鋒,趙長清,等.腰椎椎間融合術后融合器后移的原因分析及再手術策略[Z].2016,36(17):1093-1098.
[17]張亞峰,楊惠林,唐天駟,等.后路椎體間融合術后融合器脫出的原因及其翻修術[J].中國脊柱脊髓雜志,2006,16(12):909-912.
[18]裴勇,吳廣良,侯秀偉,等.腰椎椎間融合器應用的并發癥原因分析及對策[J].中原醫刊,2007,34(21):7-9.
[19]Kimura H,Shikata J,Odate S,et al.Risk factors for cage retropulsion after posterior lumbar interbody fusion[J].Spine,2012,37(13):1164-1169.
[20]Uzi E A,Dabby D,Tolessa E,et al.Early retropulsion of titanium-threaded cages after posterior lumbar interbody fusion:a report of two cases[J].Spine (Phila Pa 1976),2001,26(9):1073-1075.
[21]王洪立,姜建元,呂飛舟,等.腰椎融合器后移的原因分析及處理對策[J].中華骨科雜志,2012,32(10):916-921.
[22]李欽亮,劉藝,陳鳴,等.單、雙箱型椎間融合器在PLIF手術治療腰椎不穩癥中的比較研究[J].頸腰痛雜志,2009,30(5):393-396.
[23]石巖,崔文崗,肖德明.腰椎椎間融合器臨床研究進展[J].國際骨科學雜志,2013,34(1):45-48.
[24]張樺,葉曉健,王長峰,等.單側關節突關節切除對腰椎間融合器長期融合效果的影響[J].中國組織工程研究與臨床康復,2009,13(13):2470-2474.
[25]Duncan JW,Bailey RA.An analysis of fusion cage migration in unilateral and bilateral fixation with transforaminal lumbar interbody fusion[J].Eur Spine J,2013,22(2):439-445.
[26]姜宇,朱國興,楊玉生.肥胖和正常體質量腰椎融合患者并發癥的比較[J].中國組織工程研究,2013,17(22):4055-4061.
[27]宋友東,李書綱,紀強,等.合并糖尿病的腰椎管狹窄癥患者手術治療效果分析[J].中國骨與關節外科,2014,17(1):5-8.
[28]Okuda S,Oda T,Miyauchi A,et al.Surgical outcomes of posterior lumbar interbody fusion in elderly patients[J].J Bone Joint Surg(Am),2006,88(12):2714-2720.
[29]Babat LB,Mclain RF,Bingaman W,et al.Spinal surgery in patients with Parkinson’s disease:construct failure and progressive deformity[J].Spine (Phila Pa 1976),2004,29,3(18):2006-2012.
[30]吳李勇,王越,凌廣烽,等.通道下經椎間孔腰椎椎體間融合術后融合器移位原因分析[J].頸腰痛雜志,2015,36(6):482-485.
[31]Kuslich SD,Ulstrom CL,Griffith SL,et al.The Bagby and Kuslich method of lumbar interbody fusion.History,techniques,and 2-year follow-up results of a United States prospective,multicenter trial[J].Spine (Phila Pa 1976),1998,23(11):1267-1278;1279.
[32]Elias WJ,Simmons NE,Kaptain GJ,et al.Complications of posterior lumbar interbody fusion when using a titanium threaded cage device[J].J Neurosurg,2000,93(1 Suppl):45-52.
1008-5572(2017)06-0534-05
R681.5
B
2016-10-28
詹吉恒(1990- ),男,研究生在讀,廣州中醫藥大學第二臨床醫學院,510405。
詹吉恒,王羽豐,王高蔚.腰椎后路內固定術后椎間融合器移位原因分析及對策探討[J].實用骨科雜志,2017,23(6):534-538.

