探究金屬鎂與銨鹽反應的原理
石錦惠
有一定的化學基礎者都知道金屬鎂能夠與酸反應產生氫氣,進入高中后學生也明確了鎂條可以與熱水反應產生氫氣。實驗表明,常溫下金屬鎂不僅能在水溶液中呈酸性銨鹽(強酸弱堿鹽,即(NH4)2SO4、NH4Cl、NH4NO3)溶液里反應。而金屬鎂能否在中性銨鹽(如CH3COONH4)的溶液、堿性銨鹽(如NH4HCO3、(NH4)2CO3)的溶液里發生反應呢?
1.實驗探究為銨鹽的水溶液與金屬鎂反應提供真實的來源
實驗:用滴定管向試管中加入10滴 0.1mol·L-1NH4Cl溶液,用砂紙除去鎂條表面氧化膜,將鎂條投入溶液,開始鎂條表面產生大量的氣體,收集氣體發現氣體具有可燃性(經檢驗其中含H2)。一段時間后,用蘸有濃鹽酸的玻璃棒靠近試管口產生白煙的氣體。將上述實驗中的NH4Cl溶液換成(NH4)2 SO4溶液,實驗的現象完全相同。
結論:開始鎂條表面產生大量的氣體,收集氣體發現氣體具有可燃性,說明是H2。一段時間后,用蘸有濃鹽酸的玻璃棒靠近試管口產生白煙的氣體,產生的是NH3。
反思:一方面,本實驗采用0.1mol·L-1NH4Cl溶液或(NH4)2SO4溶液是防止NH4NO3的酸性溶液中NO3-具有氧化性;另一方面,上述實驗反應產生H2的原因可以從下列兩個方面考慮:
(1)Mg直接與NH4+反應:Mg+2NH4+=Mg2++2NH3↑+H2↑;
(2)NH4+水解出來的H+與Mg反應:NH4++H2O NH3·H2O+H+;Mg+2H+=Mg2++H2↑。
2.理論分析為銨鹽的水溶液與金屬鎂反應作出正確的指導
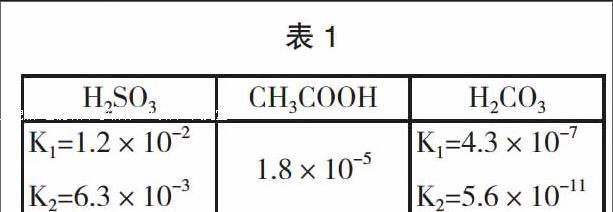
通過銨鹽的水溶液與金屬鎂反應產生氫氣和氨氣,學生更多地傾向(2)中NH4+水解出來的H+與Mg反應。為了證明Mg直接與NH4+反應成立,學生查閱了資料,已知NH3·H2O的Kb=1.8×10-5,幾種弱酸常溫下的電離平衡常數表1所示:
從表中數據進行分析,對NH4HSO3或(NH4)2SO3溶液來講,Ka大于與Kb,因為NH3·H2O比SO32-或HSO3-的電離常數小,說明SO32-或HSO3-比NH4+水解程度小,所以溶液呈酸性;類似的,Ka小于Kb,溶液成堿性,故NH4HCO3或(NH4)2CO3溶液堿酸性;若Ka等于與Kb,溶液呈中性,如CH3COONH4溶液呈中性,這是因為NH3·H2O和CH3COOH的電離常數相同,說明CH3COO-和NH4+水解程度相同,所以CH3COONH4溶液呈中性。當實驗選擇與Mg反應的銨鹽為CH3COONH4,若實驗過程中也產生H2和NH3,則就可以充分說明是NH4+與直接Mg反應的結果。
學生進行實驗驗證是必然的。用滴定管向試管中加入10滴 0.1mol·L-1 CH3COONH4溶液,用砂紙除去鎂條表面氧化膜,將鎂條投入溶液,鎂條表面產生大量的氣泡。用濕潤的紅色石蕊試紙接觸生成氣體變紅,說明產生了NH3;再用小試管采取排水法收集反應生成的氣體,發現氣體可以燃燒(方法是:將集滿氫氣的小試管用大拇指堵住管口,管口朝下,立即移近酒精燈火焰,試管里的氣體能點燃)。
3.深入探究為銨鹽的水溶液與金屬鎂反應構建完整的知識體系
在前面我們分析了具有酸性的NH4NO3溶液中NO3-可能具有氧化性,將金屬鎂投入NH4NO3溶液中,是否是NO3-氧化金屬鎂呢?
實驗:用滴定管向試管中加入10滴 0.1mol·L-1NH4NO3溶液,用砂紙除去鎂條表面氧化膜,將鎂條投入溶液,鎂條表面產生大量的無色氣體。收集氣體進行可燃性實驗,其氣體不可燃,并使帶火星的木條復燃;進行NH3檢驗實驗,其氣體不含NH3;氣體接觸空氣不變棕紅色。
結論:金屬鎂投入NH4NO3溶液中不再產生氫氣和氨氣,氣體也不是一氧化氮或二氧化氮,而是另有其他。
通過資料查閱發現,在微弱的酸性環境下NO3-被Mg還原生成N2O、N2等物質。其發生反應的離子方程式可以表示為:4Mg+10H++2NO3-=4Mg2++N2O↑+5H2O或5Mg+12H++2NO3-=5Mg2++N2↑+6H2O。因為實驗比較復雜,這里就不再狗尾續貂了。
另外,在堿性條件下的銨鹽與金屬鎂的反應又是何種結果呢?
實驗:在試管中加入2ml pH=8.2的 NH4HCO3溶液,將除去表面氧化膜的鎂條投入溶液,開始鎂條表面產生大量的氣體,同時有白色固體析出。對產生的氣體進行實驗分析發現,該氣體能夠使澄清的石灰水變渾濁,除去這種氣體之后,還有另一種可以燃燒的氣體,燃燒后生成水。
結論:NH4HCO3溶液與金屬鎂反應生成二氧化碳和氫氣。
反思:NH4HCO3溶液與金屬鎂反應生成二氧化碳和氫氣一定與HCO3-有關。怎樣才能驗證產生二氧化碳和氫氣原因與HCO3-有關呢?可以補充這樣的實驗:
(1)在試管中加入2ml pH=8.2的 NaHCO3溶液,將除去表面氧化膜的鎂條投入溶液,開始鎂條表面產生大量的氣體,同時有白色固體析出。這種實驗現象與pH=8.2的 NH4HCO3溶液的實驗現象完全一樣,說明與NH4+無關。
(2)將pH=8.2的 NaOH溶液中加入除去表面氧化膜的鎂條,沒有氣體產生。說明產生的H2與OH-沒有關系。
學生查閱資料發現,析出的白色固體為Mg2(OH)2CO3。這完全可以用高中化學知識作以解釋:因為NH4HCO3溶液中存在HCO3- H++CO32-平衡,Mg與H+反應生成了Mg2+,降低了H+的濃度,使平衡正向移動;同時溶液中存在HCO3-+H2O H2CO3+OH-,溶液中的Mg2+、OH-、CO32-結合就產生了難溶的Mg2(OH)2CO3。
為了確定NH4HCO3溶液與金屬鎂反應析出的白色固體是Mg2(OH)2CO3,學生又補充了下列實驗:
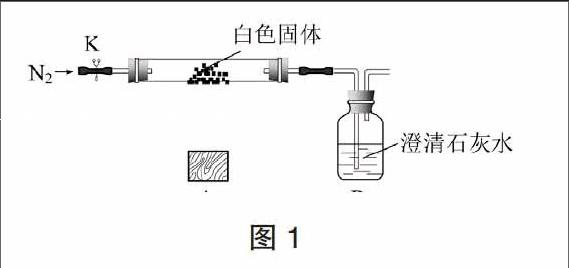
某學生設計了圖1所示裝置來探究白色固體的熱分解情況(夾持儀器省略)。打開K,先通入一段時間氮氣,然后,用酒精燈在A處加熱玻璃管,觀察B瓶溶液變渾濁,說明白色體分解產生CO2。待實驗完畢后,繼續通入氮氣至玻璃管冷卻,在硬質玻璃管的右側的內壁發現了液滴。
圖1實驗說明該析出的白色固體分解產生了水和二氧化碳,但不能說明就一定是Mg2(OH)2CO3,因為MgHCO3分解也會產生相同的現象。
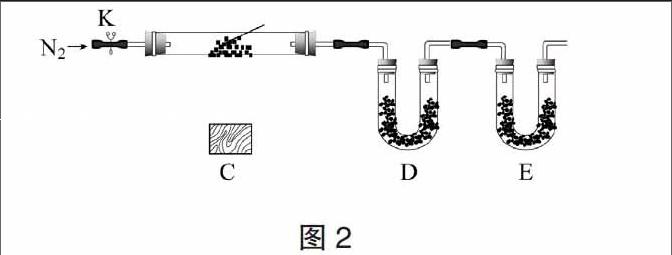
該小組對上述裝置又進行簡單改進后(如圖2),作了白色固體的定量探究。連接儀器、裝藥品,打開止水夾K,通入氮氣,加熱玻璃管。當C中硬質玻璃管的右側的內壁不再有液滴時,停止加熱,繼續通入氮氣至玻璃管冷卻。
為了確定其固體組成,在實驗設計中,學生注意了應先吸收水蒸氣,再吸收CO2,實驗D不能選用堿石灰,因為它同時吸收水蒸氣和CO2。在裝置D中應盛放氯化鈣固體,E中盛放堿石灰固體。在這一實驗中學生得出了一組數據如表2所示:
還有更多的實驗正等待著我們去探究、去開發,這里就不一一列舉了。
總之,銨鹽溶液與金屬鎂常見的反應是Mg直接與NH4+反應:Mg+2NH4+=Mg2++2NH3↑+H2↑。然而,在不同的條件下也會有不同的結果,如金屬鎂在與NH4NO3或NHHCO3溶液的反應,就是特例,但是,其反應原理還是有據可循的。我們唯有不斷地反思、不斷地探究,真理就一定會掌握在自己的手中。
參考文獻:
[1]周曉宏,張冬臨,劉曉渝.鎂與銨鹽溶液反應的教學分析[J]. 化學教育, 2007, 28(8):55.
[2]羅華榮,彭曉玲.探究鎂與氯化銨溶液的反應[J].中學化學教學參考, 2009(8):50-51.
(作者單位:福建省長樂華僑中學)

