優勢醋酸菌株的篩選鑒定及乙醇脫氫酶活性研究
張霽紅,李明澤,曾朝珍,康三江,張海燕,張永茂*
(甘肅省農業科學院農產品貯藏加工研究所,甘肅蘭州730070)
優勢醋酸菌株的篩選鑒定及乙醇脫氫酶活性研究
張霽紅,李明澤,曾朝珍,康三江,張海燕,張永茂*
(甘肅省農業科學院農產品貯藏加工研究所,甘肅蘭州730070)
為滿足蘋果醋液態深層發酵的需要,從果渣、泥土中選育出生長良好、遺傳穩定的較優醋酸菌株,實現高效率、高產量的蘋果醋中試生產。經初篩、復篩、產酸試驗、遺傳穩定性試驗、生理生化試驗和16S rDNA序列分析鑒定,優選菌株Y010鑒定為巴氏醋酸桿菌(Acetobacter pasteurianus)。進一步研究該菌株在蘋果醋發酵過程中乙醇脫氫酶(ADH)活性與產酸量、產酸速率的關系。結果表明:該菌株在醋酸發酵48 h時酶活較高,達到4.62 U/mL,產酸速率最大達到0.51 g/(L·h),發酵120 h總酸含量最高達到53.12 g/L,其ADH酶活與產酸速率變化趨勢一致。
醋酸菌屬;篩選;16S rDNA;醇脫氫酶;產酸速率

ZHANG Jihong,LI Mingze,ZENG Chaozhen,KANG Sanjiang,ZHANG Haiyan,ZHANG Yongmao*
(Agricultural Product Storage and Processing Institute,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China)
果醋發酵過程中菌種是影響品質的重要因素之一[1]。現代工業采用液態深層發酵,常用醋酸菌株為食醋菌種巴氏醋酸桿菌(Acetobacter pasteurianus)AS1.41和滬釀1.01巴氏醋酸桿菌(Acetobacterpasteurianus),不僅產酸能力低、酒精耐受力差,而且發酵果醋形成的風味不佳,同時,醋酸菌易變異、死亡,不易保存,優良的果醋發酵菌種很難實現工業化[2-3]。目前,醋酸菌的篩選、馴化多采用傳統的分離培養和分子生物學重組技術,特別是在果醋專用醋酸菌種篩選方面,研究較多,但達到市場化、工業化的菌種卻很少[4-5]。張蕾等[6]對處于對數期的醋酸菌株C1-0進行紫外線誘變,獲得三株高產醋酸的醋酸菌株C1-11、C1-27、C1-30,比初始菌株C1-0產酸量分別提高4.5%、8.6%、2.6%,且遺傳穩定性較好。鄧洪鈞等[7]從醋醅中篩選具有較好耐溫特性的醋酸菌WL021-1,并且通過常溫等離子體誘變,使得發酵周期縮短約7h,發酵效率提高約10%。TRECKJ等[8]研究表明,耐高酸醋酸菌的乙醇脫氫酶(alcohol dehydrogenase,ADH)活力遠高于低濃度生長產酸的菌株。NAKANO S等[9]利用基因工程技術分離出醋酸菌中主要由乙酸誘導合成的AatA蛋白質,過量表達的AatA蛋白質使醋酸菌細胞內的醋酸濃度維持在較低水平,有效提高了菌株的耐酸性和產酸速率。
本研究從果園泥土、腐爛蘋果中分離篩選優良醋酸菌株,在初篩、復篩等傳統醋酸菌種篩選方法基礎上,結合生理生化試驗及16SrDNA鑒定確定優選菌株的種屬。并進一步研究該菌株在蘋果醋醋酸發酵過程中乙醇脫氫酶(ADH)活性以及其與醋酸菌株產酸能力的關系,希望得到酶活力較高、遺傳穩定性好、產酸能力較高的菌株,為蘋果醋工業化生產中優良醋酸菌株的選育提供理論依據[10]。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種來源及實驗材料
醋酸菌株CICC20056、CICC 7009:中國微生物菌種保藏中心;滬釀1.01:上海市釀造科學研究所。土壤樣品取自甘肅省慶陽市西峰區仕社村蘋果園樹冠下0~20 cm處,腐爛蘋果隨機取樣于甘肅省慶陽市西峰區仕社村蘋果園自然下落的腐爛蘋果。
1.1.2 主要試劑
無水乙醇、碳酸鈣、氯化鐵、氫氧化鈉、鐵氰化鉀、硫酸鐵、十二烷基磺酸鈉、葡萄糖、磷酸氫二鈉、磷酸二氫鈉、檸檬酸、磷酸等(均為分析純):天津市光復科技發展有限公司;酵母膏、瓊脂(均為生化試劑):北京奧博星生物技術有限公司;Triton X-100:北京拜爾迪生物技術公司。
1.1.3 培養基
基礎培養基:葡萄糖10 g/L,酵母粉10 g/L,滅菌后冷卻至50℃,加入體積分數為3%的無水乙醇。
分離培養基:葡萄糖10 g/L,酵母粉10 g/L,瓊脂18 g/L,碳酸鈣15 g/L,無水乙醇體積分數3%。
斜面保藏培養基:葡萄糖10 g/L,酵母粉10 g/L,瓊脂18 g/L,碳酸鈣10 g/L,無水乙醇體積分數3%。
種子培養基:葡萄糖10 g/L,酵母粉15 g/L,磷酸二氫鉀0.5 g/L,硫酸鎂0.5 g/L,pH 6.5。
產酸培養基:葡萄糖10 g/L,酵母粉15 g/L,經滅菌冷卻后加入體積分數7%無水乙醇,分裝至250 mL三角瓶,每瓶30mL。
分離培養基和斜面保藏培養基經過165℃、30 min干熱滅菌,待溫度降至70℃時加入碳酸鈣和無水乙醇。其他培養基121℃,20 min高壓滅菌,4℃保存備用。
1.2 儀器與設備
BSA224S-CW電子天平:賽多利斯科學儀器(北京)有限公司;ZHJH-C1112B超凈工作臺、ZWY-2102恒溫培養振蕩器:上海智城分析儀器制造有限公司;LRH-250生化培養箱:上海一恒科學儀器有限公司;TGL-16MC冷凍離心機:長沙維爾康湘鷹離心機有限公司;HH-S4電熱恒溫水浴鍋:北京科偉永興儀器有限公司;UV2400紫外可見分光光度計:上海舜宇恒平科學儀器有限公司。
1.3 實驗方法
1.3.1 菌株篩選步驟[11]
(1)初篩
稱取10.0 g土樣或腐爛蘋果樣,置于90.0 mL帶有玻璃珠的無菌水中,搖床振蕩30 min,取1.0 mL菌液至基礎培養基(裝液量30 mL/250 mL),30℃、200 r/min條件下富集培養48h后,取出增值液用無菌水稀釋至10-5、10-6、10-7濃度,取各濃度稀釋液0.2mL,涂布法接種于分離培養基上,30℃恒溫培養72 h后,挑選透明圈較大的菌落純化后轉接于斜面培養基上培養保存。對保存后的單菌落菌株在碳酸鈣平板培養基上進一步分離,根據其透明圈直徑與菌落直徑之比的HC值(HC=透明圈直徑/菌落直徑)大小進行初篩。
(2)復篩
將初篩菌種分別接種于產酸培養基上,每株3次重復,在30℃靜置恒溫培養120 h后,測定總酸產量(以乙酸計)并比較。
(3)優選菌株馴化試驗
將優選出的菌株分別接種于酒精含量為6%vol的蘋果酒中進行醋酸發酵,發酵溫度30℃、150 r/min,分別振蕩培養1 d、2 d、3 d、4 d、5 d、6 d、7 d,每天取樣檢測其醋酸產量,從中篩選出產酸性能良好的醋酸菌。
(4)遺傳穩定性試驗
將篩選出的醋酸菌株進行傳代培養(傳4代),每一代活化后二級種子液接種于酒精含量為6%vol的蘋果酒中進行醋酸發酵,30℃、150r/min振蕩培養6d,測定醋酸產量,并觀察每次傳代后菌株的菌落特征、個體形態特征、以及在蘋果酒中的產酸量和變化。
1.3.2 菌株鑒定
(1)生理生化鑒定:參見張紀忠的《微生物分類學》[12]和周德慶的《微生物學教程》[13]。
(2)16S rDNA鑒定[14]
純種菌株Y010轉接于斜面送工業微生物菌種保藏中心進行16SrDNA鑒定,檢測方法參考“細菌16S rDNA檢測方法”。鑒定用細菌基因組DNA抽提試劑盒提取目標菌株Y010的總DNA,然后用設計合成的通用引物和高保真DNA聚合酶進行聚合酶鏈式反應(polymerasechainreaction,PCR)擴增,擴增產物進行DNA測序,并與數據庫中已知細菌比較獲得樣品種屬信息,選取近似菌種序列,構建系統發育樹。
1.3.3 乙醇脫氫酶活性研究
(1)粗酶液制備[15]
取相應時間的發酵液(100 mL),于4℃,8 000 r/min條件下離心10 min,用50 mmol/L(pH 5.8)的磷酸鹽緩沖液(phosphate buffered saline,PBS)洗滌2次,然后重新懸浮于該緩沖液中(0.1 g濕菌體/3 mL PBS),在冰浴下進行超聲破碎,超聲功率240 W,破碎30 s暫停30 s,總時間10 min,破碎液作為粗酶液待用。
(2)乙醇脫氫酶(ADH)活性的測定[16]
ADH酶活的測定:參照WOOD氏法[11],取0.5 mL Mcllvaine緩沖液(pH 4.0),1.0 mol/L乙醇(乙醛)溶液0.1 mL,粗酶液0.1 mL,6%Triton X-100 0.1 mL于10 mL比色管中,25℃保溫5 min后加入0.1 mol/L鐵氰化鉀溶液0.2 mL,在25℃條件下放置反應5 min(同時做空白對照),然后加入硫酸鐵-Dupanol溶液0.5 mL終止反應,25℃下放置20 min,加入3.5 mL蒸餾水混合后,用紫外可見分光光度計測定波長660 nm條件下的光密度值。以25℃、pH 4.0條件下,1 min氧化1 μmol乙醇的酶量為1個酶活力單位;4.0光密度值等
于氧化1 μmol乙醇。
酶活性(U/mL)=A660nm×1/4 ×1/5 ×1/酶液(mL)×稀釋倍數1.3.4指標測定及計算方法
總酸(以乙酸含量計)測定:采用酸堿滴定法;酒精含量測定:蒸餾瓶法。
醋酸產量(g/L)=[(CNaOH×V)/2] ×60
式中:CNaOH表示滴定的NaOH濃度,mol/L;V表示消耗NaOH的體積,mL;2表示取樣量,mL;60為乙酸摩爾質量,g/mol。
產酸速率=Δ產酸量(g/L)/Δh

2 結果與分析
2.1 菌株分離純化初篩結果
經過富集培養、分離純化和產酸定性試驗,共獲得20個單菌株。從腐爛蘋果中分離篩選出10個菌株編號為X001~X010,從蘋果園泥土中分離篩選出10個菌株編號為Y001~Y010,其HC值如表1所示。

表1 菌株初篩結果Table 1 Preliminary screening results of strains
根據其變色圈直徑與菌落直徑之比的HC值大小,對形態一致的單菌落進行初篩,由表1中可知,菌株X004、X005、X007、X008、X009、Y010、Y002、Y004的HC值較大,其值范圍在2.67~3.38。
2.2 復篩結果
對初篩出的菌株X004、X005、X007、X008、X009、Y010、Y002、Y004進一步進行產酸試驗復篩,以菌株滬釀1.01、7009、20056為對照,其結果如圖1所示。
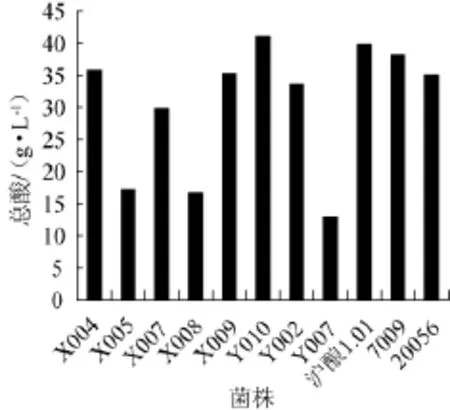
圖1 各菌株總酸產量Fig.1 Total acid production of different strains
由圖1可知,菌株Y010、X004、X009的產酸量相對較高,其產酸量分別為40.12 g/L、35.48 g/L、35.02 g/L,其中菌株Y010的產酸量高于對照菌株(其中滬釀1.01為39.12 g/L,7009為38.26g/L,20056為35.56g/L)。因此菌株Y010、X004、X009為優選菌株。
2.3 優選菌株馴化試驗結果

圖2 優選菌株發酵過程中醋酸產量變化Fig.2 Acetic acid production change of the dominate strains in fermentation process
由圖2可知,在整個發酵過程中,醋酸產量隨時間延長呈增大趨勢,發酵前96 h醋酸產量迅速增加,96 h后醋酸產量增長速度減慢,但總體酸含量增加。菌株Y010從發酵48 h后產酸速率和產酸量增加幅度大于菌株X004、X009和對照菌株滬釀1.01,故優選菌株在蘋果醋發酵液中產酸量較高,可作為蘋果醋發酵菌株進一步研究。
2.4 遺傳穩定性試驗結果
優選菌株Y010、X009、Y010以及對照菌株1.01在蘋果醋醋酸發酵中連續培養4代后,產酸量結果如下(每代相同條件下培養第6天測總酸含量)。

表2 連續培養4代后的穩定性Table 2 Stability of continuous culture of four generations
由表2可知,經4代遺傳穩定性培養后,菌株X004、X009產酸量和酒精轉化率都呈現先上升后下降的趨勢,只有菌株Y010產酸量和酒精轉化率隨傳代次數的遞增呈微上升趨勢,整個變幅在1%內,且產酸量和酒精轉化率大于對照菌株,表明其遺傳穩定性良好,產酸量較高。
2.5 菌種鑒定
2.5.1 細胞形態、菌落形態
優選菌株Y010的電鏡掃描圖及在平板上的鈣溶圈分別見圖3和圖4。

圖3 優選菌株Y010電鏡掃描圖Fig.3 Electron micrographs of the dominate strain Y010
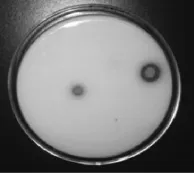
圖4 優選菌株Y010在平板上的鈣溶圈Fig.4 Dissolved calcium circle of dominate strain Y010 on the tablet
由圖3和圖4可知,優選菌株Y010菌落圓形,表面濕潤光滑、邊緣整齊、小凸起、碳酸鈣溶解圈明顯,細胞形態G-,菌體呈短桿狀,無芽孢,(0.8~1.0)μm×(1.5~2.5)μm,單個或成堆排列,有黏液物質分布。
2.5.2 生理生化特征
對菌株Y010進行生理生化試驗,測定結果見表3。

表3 菌株Y010生理生化試驗測定結果Table 3 Determination results of physiological and biochemical test of strain Y010
由表3可知,其生理生化試驗結果與伯杰細菌手冊中醋桿菌屬中巴氏醋酸桿菌的生理生化特征相近[17]。
2.5.3 16S rDNA鑒定
所得16S rDNA序列在NGBI網站經序列對比,挑選與之有較高同源性的菌株16S rDNA序列,采用MEGA5.0軟件,鄰位連接法顯示菌株產酸細菌與相關種的16S rDNA序列系統發育樹,進行1 000次的相似度重復計算,圖中發育樹節點只顯示Bootstrap值>50%,上標的“T”表示模式菌株,菌株的系統發育樹結果見圖5。

圖5 細菌Y010的16S rDNA序列系統發育樹Fig.5 Phylogenetic tree of strain Y010 based on 16S rDNA gene sequence
由圖5可知,在系統發育樹上產酸菌株Y010與醋酸桿菌(Acetobacter pasteurianussubsp.pasteurianusLMG 1262T(BACG01000075)非常接近,16S rDNA序列相似性高達100%。再結合菌落形態特征、個體形態特征、生理生化鑒定,參考《常見細菌系統鑒定手冊》[18]及《伯杰細菌鑒定手冊》鑒定菌株。確定出產酸菌株Y010為醋桿菌屬(Acetobacter sp.)巴氏醋酸桿菌(Acetobacter pasteurianus),可作為蘋果醋發酵專用菌種進一步研究。
2.6 醋酸發酵過程中乙醇脫氫酶酶活與產酸量、產酸速率之間的關系
2.6.1 乙醇脫氫酶酶活與產酸量的關系
優選菌株Y010在蘋果醋發酵過程中ADH酶活和產酸量的關系,結果如圖6所示。由圖6可知,當菌液培養48 h時,ADH酶活和產酸總量均隨著培養時間的延長而逐漸上升,即ADH酶活和產酸總量呈正相關;但是,當菌液培養48 h后,ADH酶活隨著培養時間的延長卻逐漸下降,而產酸總量隨著培養時間的延長而逐漸上升,這是因為產酸量是一個逐步積累的過程,在整個發酵過程中產酸量逐漸增大,最大達到53.12 g/L。
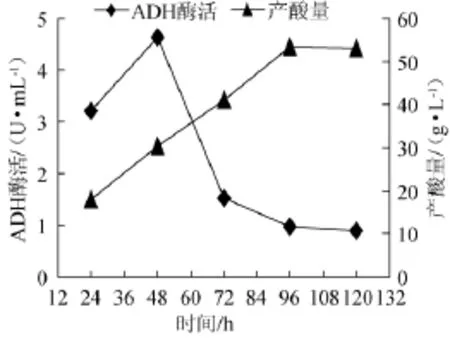
圖6 優選菌株Y010醋酸發酵過程中ADH酶活、產酸量變化曲線Fig.6 Change curve of ADH activity and total acid production of the dominate strain Y010 in fermentation process
2.6.2 乙醇脫氫酶酶活與產酸速率的關系
乙醇脫氫酶是醋酸桿菌氧化產醋酸的關鍵酶,在醋酸發酵過程中ADH酶活和產酸速率如表4所示。由表4可知,乙醇脫氫酶ADH酶活與產酸速率變化趨勢相一致,48h時,ADH酶活最大達到4.62 U/mL,此時,產酸速率也最大達到0.51 g/(L·h),故ADH酶活越高,產酸越快。故ADH酶活和產酸速率可作為優良醋酸菌選育的依據。

表4 優選菌株Y010醋酸發酵過程中ADH酶活和產酸速率Table 4 Relationship between ADH activity and acid yield of the dominate strain Y010 in fermentation process
3 結論
巴氏醋酸桿菌(Acetobacter pasteurianus)廣泛存在于水果、蔬菜、醋和飲料中,具有醋桿菌屬的特性,適于果醋發酵。本研究從腐爛蘋果、果園泥土中分離、篩選適合蘋果醋發酵的較優醋酸菌,采用傳統的菌株篩選方法,經初篩、復篩、產酸實驗、遺傳穩定性實驗、生理生化試驗以及16S rDNA鑒定結果,初步確定出優選菌株Y010為巴氏醋酸桿菌(Acetobacter pasteurianus),為工業菌株的篩選和鑒別菌株性能優劣提供重要參考依據。
通過進一步研究優選菌株Y010在蘋果醋發酵過程中,其ADH酶活與產酸速率、產酸濃度之間的關系,得到在醋酸發酵體系中ADH酶活和產酸速率呈現出較高的一致性,酶活越高產酸速率越大。發酵48 h時,菌體Y010生長活躍,ADH酶活最大,達到4.62 U/mL,產酸速率最快達到0.51 g/(L·h)。而產酸量隨著發酵時間延長逐漸增大,120 h最大達到53.12 g/L。
[1]YAMADA Y,YUKPHAN P.Genera and species in acetic acid bacteria [J].Int J Food Microbiol,2008,125:15-24.
[2]陳偉.優質醋酸菌的選育、蘋果醋酸發酵規律及酶活影響的研究[D].泰安:山東農業大學,2001.
[3]KANCHNARACH W,THEERAGOOL G,INOUE T,et al.Acetic acid fermentation ofAcetobacter pasteurianus:relationship between acetic acid resistance and pellicle polysaccharide formation[J].Biosci Biotech Biochem,2010,74(8):1591-1597.
[4]張忠明.高產醋酸菌的篩選及其形態生化特征研究[J].甘肅農業大學學報,2006,41(6):83-86.
[5]王金丹,張寶善,李亞武,等.醋酸菌耐酸機制的研究進展[J].中國釀造,2014,33(11):10-14.
[6]張蕾,郭龍,傅力.紫外線誘變選育高產醋酸的醋酸菌研究[J].新疆農業科學,2012,49(6):1120-1126.
[7]鄧洪鈞,白曉磊,方昕,等.常溫等離子體誘變選育醋酸發酵菌株[J].安徽農業科學,2015,43(32):121-124.
[8]TRECK J,TOYAMA H,CZUBA J,et al.Correlation between acetic acid resistance and characteristics of PQQ-dependent ADH in acetic acid bacteria[J].Appl Microb Cell Physiol,2006,70(3):366-373.
[9]NAKANO S,FUKAYA M,HORINOUCHI S.Putative ABC transporter responsible for acetic acid resistance inAcetobacter aceti[J].Appl Environ Microbiol,2006,72(1):497-505.
[10]陳洋,高冰,汪超,等.巴氏醋酸桿菌AS1.41產醋酸關鍵酶研究[J].中國釀造,2016,35(1):38-42.
[11]劉紹軍.食品微生物學實驗技術[M].北京:中國農業科技出版社,2000:12-14.
[12]張紀忠.微生物分類學[M].上海:復旦大學出版社,1990:12.
[13]周德慶.微生物學教程[M].北京:高等教育出版社,1993:249.
[14]WILAWAN S.Characterization of acetic acid adapted strains and analysis of alcohol dehydrogenase genes from acetobacter syzy SKU19[D]. Bangkok:Kasetsart University,2008.
[15]宋娟,胡生海,李明澤,等.蘋果醋優勢醋酸菌株的誘變選育[J].中國釀造,2016,35(7):40-44.
[16]周秉辰.食醋生產中醋酸菌乙醇脫氫酶的活性與產酸速率關系的研究[J].中國釀造,2009,28(11):58-60.
[17]R.E,布坎南,N.E,吉本斯.伯杰細菌鑒定手冊[M].北京:科學出版社,1984:362-365.
[18]東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001:21-32.
TS264.2
0254-5071(2017)05-0100-05
10.11882/j.issn.0254-5071.2017.05.021
2016-11-16
國家自然科學基金地區基金項目(31460449);甘肅省農牧廳生物技術專項(GNSW-2013-31);現代農業產業技術體系建設專項資金資助(CARS-28)
張霽紅(1977-),女,副研究員,碩士,研究方向為食品微生物。
*通訊作者:張永茂(1957-),男,研究員,本科,研究方向為果蔬加工。

