醬香白酒釀造過程中產多元醇功能酵母的篩選
白小燕,邱樹毅,雷安亮,陳美竹,黃魏,王曉丹*
(1.貴州大學貴州省發酵工程與生物制藥重點實驗室,貴州貴陽550025;2.貴州珍酒釀酒有限責任公司,貴州遵義563003;3.貴州大學釀酒與食品工程學院,貴州貴陽550025;4.貴州大學生命科學學院,貴州貴陽550025)
醬香白酒釀造過程中產多元醇功能酵母的篩選
白小燕1,4,邱樹毅1,3,雷安亮2,陳美竹1,3,黃魏1,3,王曉丹1,3*
(1.貴州大學貴州省發酵工程與生物制藥重點實驗室,貴州貴陽550025;2.貴州珍酒釀酒有限責任公司,貴州遵義563003;3.貴州大學釀酒與食品工程學院,貴州貴陽550025;4.貴州大學生命科學學院,貴州貴陽550025)
為了解醬香型白酒釀造過程中產多元醇酵母的種類和功能,以醬香型白酒大曲和酒醅中分離的酵母為研究對象,采用薄層層析法和高效液相色譜-蒸發光散射檢測器法(HPLC-ELSD)對具有產多元醇功能的酵母進行篩選和多元醇定性、定量分析。實驗結果顯示,從142株酵母菌中篩選出5株具有產多元醇功能的酵母菌婁德酵母(Lodderomyces elongisporus)FBKL2.0073、庫得畢赤酵母(Pichia kudriavzevii)FBKL2.0008、Trichosporon coremiiformeFBKL2.0310、Trichosporon coremiiformeFBKL2.0307和Trichosporonoidessp.FBKL2.0315,其中前4株菌都能產D-阿拉伯糖醇,L.elongisporusFBKL2.0073菌株產多元醇的總量最多,為(9.87±0.85)g/L。
酵母;薄層層析;高效液相色譜-蒸發光散射檢測器法;多元醇;D-阿拉伯糖醇

BAI Xiaoyan1,4,QIU Shuyi1,3,LEI Anliang2,CHEN Meizhu1,3,HUANG Wei1,3,WANG Xiaodan1,3*
(1.Guizhou Provincial Key Laboratory of Fermentation Engineering and Biological Pharmacy,Guizhou University,Guiyang 550025,China; 2.Guizhou Jane Wine Brewing Co.,Ltd.,Zunyi 563003,China;3.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;4.School of Life Sciences,Guizhou University,Guiyang 550025,China)
醬香型是中國白酒的四大基本香型之一,具有醬香突出、幽雅細膩、飽滿味長、空杯留香持久等特點。醬香型白酒的發酵窖池按出酒的風格特征分上、中、下三層,窖池上層酒醅主要產醬香酒,中層酒醅主要產醇甜型酒,下層酒醅主要產窖底香型酒[1]。甜味是一種讓人感覺比較愉悅的口感,尤其在酒精度較高的白酒中,微甜味能使酒體顯得綿柔醇厚,而目前白酒缺少醇甜的風格特征,一些生產企業為了改善白酒口感,降低成本獲取經濟利益,向其中違規添加甜味劑(糖精鈉、甜蜜素、甜味素等)[2],有研究發現,糖精鈉、甜蜜素等一些人工甜味劑具有潛在致癌、致畸、損害腎功能的副作用,這給消費者帶來巨大的安全隱患[3]。同時,強制性國家標準GB 2760—2011《食品安全國家標準食品添加劑使用標準》中明確規定白酒中不允許添加任何甜味劑[4]。為滿足市場的這一需求,有必要對醇甜型酒進行研究。
酵母是釀酒微生物家族的重要成員之一,從功能上主要分為兩大類:一類是產酒酵母[5-6];另一類是產香酵母[7]。但是從相關文獻可以看到[8-9],酵母除了具有產酒和產香的作用外,還具有產多元醇類物質的作用。SPENCER J F等[10]研究發現,耐高滲酵母在高滲條件下可產生多元醇,代謝葡萄糖產生的多元醇主要有甘油、D-阿拉伯糖醇、赤醉糖醇、山梨醇、麥芽糖醇等,其中五碳多元醇以D-阿拉伯糖醇為主[11-12]。范光先等[13]也發現在高糖環境中,高滲酵母產生的多元醇主要為D-阿拉伯醇或赤蘚糖醇,而在高鹽條件下產生的甘油居多。
多元醇是酒醅內的酵母菌在生成酒精的同時發酵糖所產生的,由于糖不能進入白酒中,因此多元醇是形成白酒中甜味的主要來源,其在酒內可起緩沖作用,使白酒更加豐滿醇厚,甜度隨羥基數增多而增強[14]。由于多元醇沸點高,屬于不揮發醇類,不易隨蒸餾進入酒中,因而在白酒中含量極低,定量分析的難度較大[15],目前,對白酒中多元醇的檢測方法主要有薄層層析法(thinlayerchromatography,TLC)、高效液相色譜-蒸發光散射檢測(high performance liquid chromatography-evaporative light-scattering detector,HPLC-ELSD)[16]、液質聯用法[17]、毛細管氣相色譜法[18]、離子色譜積分脈沖安培法[19-20]等。本實驗以課題組前期從醬香型白酒釀造過程大曲和酒醅中分離的所有酵母為研究對象,通過建立薄層層析法和高效液相色譜-蒸發光散射法對酵母菌株產多元醇種類及含量進行初步分析,研究醬香型白酒釀造過程中酵母產多元醇類物質的能力。
1 材料與方法
1.1 材料與試劑
菌株:本實驗室從醬香型白酒酒醅及大曲中篩選并保藏的142株酵母菌。
紙層析顯色劑[21]:飽和硝酸銀丙酮溶液-氫氧化鈉酒精溶液;紙層析展開劑:正丁醇∶冰乙酸∶水=5∶1∶2;多元醇標樣:取相同體積的質量濃度為0.01mg/mL的赤鮮糖醇、木糖醇、山梨糖醇、麥芽糖醇、丙三醇、阿拉伯糖醇標準溶液混合。
酵母膏胨葡萄糖瓊脂培養基(yeast extract peptone dextrose,YEPD):酵母膏1g,蛋白胨2g,葡萄糖2g,瓊脂2g,蒸餾水100 mL,121℃滅菌20 min。
高糖培養基:葡萄糖40 g,酵母粉1 g,蛋白胨2 g,瓊脂1.5 g,蒸餾水100 mL,115℃滅菌20 min。
種子培養基:葡萄糖2 g,酵母粉1 g,蛋白胨2 g,蒸餾水100 mL,121℃滅菌20 min。
發酵培養基:葡萄糖20 g,酵母粉1 g,蛋白胨2 g,蒸餾水100 mL,115℃滅菌20 min。
實驗所用試劑均來自上海博威生物科技有限公司。
1.2 儀器與設備
F254層析微晶纖維素板:武漢藥科新技術開發有限公司;404146手持式折光儀:成都泰華光學有限公司;Milli-Q Academic密理博超純水儀:密理博(上海)貿易有限公司;Agilent1260高效液相色譜儀、AgilentG4260B蒸發光檢測器、AgilentHi-plexCa柱(300 mm×7.7 mm):美國Agilent公司。
1.3 方法
1.3.1 耐高滲酵母的篩選
酵母活化:將本實驗室篩選并保藏的酵母在YEPD平板培養基上劃線,30℃培養,活化8 h。
高糖培養:將活化酵母接入高糖培養基中,30℃培養,篩選出能在高糖培養基中良好生長的酵母菌株進行下一步實驗。
1.3.2 搖瓶初篩
挑選在的高糖培養基中生長良好的耐高糖酵母,將其分別接種于含有50 mL發酵培養基的250 mL三角瓶中,30℃、160 r/min搖瓶培養3 d。用薄層層析法分析產物組成,選取產多元醇的菌株進行下一步復篩。
1.3.3 搖瓶復篩
將初篩所得菌株,進行活化,然后接入到種子培養液中在30℃、160 r/min擴培24 h,制得種子培養液,將各酵母種子液按5%的接種比例接種至含有50 mL發酵培養基的三角瓶中,30℃、160 r/min搖瓶培養5 d,每組做3個平行。分別測定發酵液中殘糖量、可溶性固形物含量,選取具有穩定性狀、多元醇產量較高的菌株作為研究對象。
1.3.4 測定方法
可溶性固形物與殘糖量測定:酵母發酵液5000r/min離心后取上清,用阿貝折光儀測定其中的可溶性固形物含量。
殘糖量測定:參見國標GB/T 5009.7—2008《食品中還原糖的測定》中的直接滴定法測定[22]。
多元醇產物進行初步定性和粗定量:根據測定單一標樣和混合標樣的展開效果,來確定一種適用于分析酵母產多元醇的薄層層析法,優化并確認的層析條件。樣品處理方法如下:取不同菌株的發酵液各1 mL,10 000 r/min離心10 min,用毛細吸管將上清點樣于微晶纖維素板上,層析時間為4 h,層析結束后自然晾干,層析圖譜的顯色采用飽和硝酸銀丙酮溶液-氫氧化鈉酒精溶液[21]。
HPLC-ELSD法測量條件:AgilentHi-plexCa柱(300mm× 7.7 mm),柱溫為70℃,進樣量為4 μL,以純水水為流動相,蒸發光散射檢測器(ELSD),霧化溫度為60℃,蒸發溫度為60℃,流速0.5 mL/min,載氣為氮氣。
準確配制葡萄糖、阿拉伯糖醇、麥芽糖醇、赤蘚糖醇、木糖醇及山梨醇質量濃度為0.8 mg/mL的標準儲備液,用0.22μm微孔濾膜過濾。準確配制5種糖醇混合儲備液,使用蒸餾水稀釋成質量濃度為0.8mg/mL、1.0mg/mL、1.5mg/mL、2.0 mg/mL、3.0 mg/mL、4.0 mg/mL的混合標準工作液。
測定前,準確吸取5mL發酵液于試管,65℃水浴10min,轉移到離心管中10 000 r/min離心10 min,上清液經C18固相萃取小柱凈化,收集濾液5 mL,用0.22 μm濾膜過濾。
2 結果與分析
2.1 耐高滲酵母的篩選
通過在高糖培養基上酵母生長的結果顯示,142株酵母有131株能生長。這可能與醬香型白酒生產過程有關,因為這些酵母是從大曲和酒醅分離培養來的,而大曲和酒醅本身就是高溫、高糖、高滲的環境,所以在這種環境下篩選出來的酵母在高糖培養基中能夠存活[23]。
2.2 搖瓶發酵初篩
將在高糖培養基上生長的酵母菌株進行搖瓶培養初篩,再借助薄層層析法對發酵液中的多元醇含量進行初步分析。結果見表1及圖1。
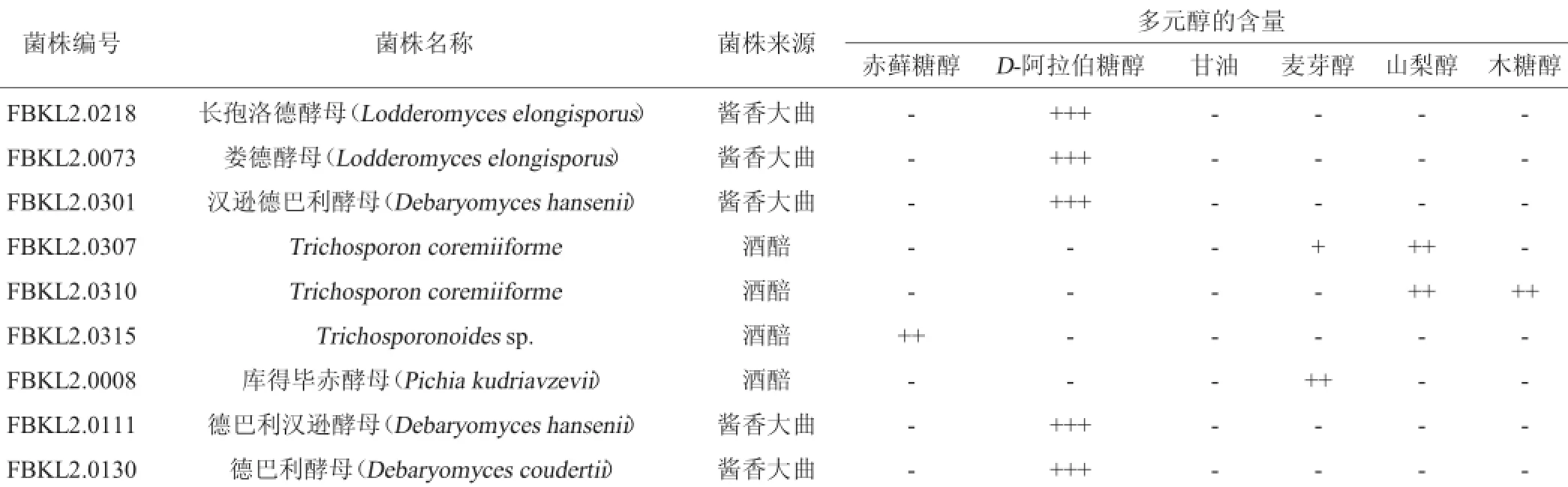
表1 產多元醇酵母的初篩結果Table 1 Preliminary screening results of polyhydric alcohol-producing yeasts

圖1 發酵液中多元醇的薄層層析圖Fig.1 TLC of polyhydric alcohols in fermentation broth
最終,選出了產D-阿拉伯醇量最多的菌株FBKL2.0218、FBKL2.0073、FBKL2.0301、FBKL2.0111、FBKL2.0130以及產山梨醇較多的菌株FBKL2.0307、產山梨醇和木糖醇的菌株FBKL2.0310、產赤蘚糖醇的菌株FBKL2.0315、產麥芽糖醇的菌株FBKL2.0008酵母菌株共9株菌。由表1可知,許多酵母具有產多元醇的能力,其中以D-阿拉伯糖醇較為常見,有的發酵液還伴隨少量的甘油生成[24]。從產多元醇酵母的來源上看,主要是來自于大曲,酒醅中較少,這可能與大曲和酒醅的環境差異有關,醬香型白酒是以小麥為原料的高溫大曲,是白酒生產的糖化發酵劑,含糖量高且溫度高,提供了高滲環境,在這種環境中篩選出來的酵母更能利用糖生成多元醇[25]。由圖1可以看出,該實驗條件下,各種糖醇能很好分開,分離效果及重現性良好,因而可以用于初步分析發酵液中的糖醇類物質,其中葡萄糖顯色斑點,說明菌株FBKL2.0301和FBKL2.0307發酵液中殘糖含量高;幾種多元醇斑點中,D-阿拉伯醇顯色斑點最大最黑,說明D-阿拉伯醇含量高。
2.3 搖瓶發酵復篩
將初篩中產多元醇含量較高的9株菌株分別接入液體發酵培養基進行搖瓶復篩。經多次重復實驗,得復篩結果如表2。

表2 產多元醇酵母的復篩結果Table 2 Secondary screening results of polyhydric alcohol-producing yeasts
由表2可知,同其他酵母相比,相同條件下,菌株FBKL 2.0073、FBKL2.0008、FBKL2.0307、FBKL2.0310、FBKL2.0315的發酵液中殘糖量更低,固形物含量與殘糖量差值更大,且結合表1和圖1可以看出,這些酵母發酵液對應的產物斑點更大,因而其多元醇產物的量可能更高。但還需要借助高效液相色譜方法來準確對酵母產多元醇的種類和產量做進一步分析。
2.4 高效液相色譜法對發酵液中多元醇產量測定
根據初篩和復篩結果,本實驗篩選出5株葡萄糖殘量低且多元醇產率相對較高的菌株FBKL2.0073、FBKL2.0008、FBKL2.0307、FBKL2.0310、FBKL2.0315作為發酵出發菌株,利用高效液相色譜法對發酵液中多元醇種類、含量進行分析。根據測得的峰面積與對應的糖醇濃度進行線性回歸,可得到5種標準品的線性回歸方程和相關系數R,結果見表3。
由表3可知,5種物質的相關系數R為0.996~0.999,在線性范圍內各種糖醇的含量與峰面積有很好的線性關系,檢出限在0.045~0.058 mg/mL范圍內,經高效液相色譜法對發酵液中多元醇產量測定,得到色譜圖(見圖2)。

表35 種標準品的回歸方程、線性范圍及檢出限Table 3 Regression equations,correlation coefficients and limit of detection of five standards
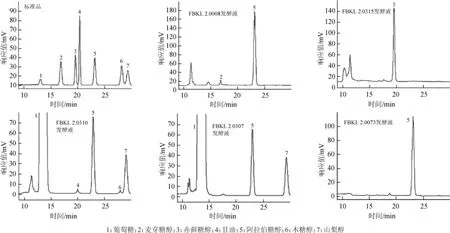
圖2 標準品和部分發酵液樣品的高效液相色譜圖Fig.2 HPLC chromatograms of standard substance and part fermention broth samples
由圖2可知,發酵液FBKL2.0008產麥芽糖醇和D-阿拉伯糖醇;發酵液FBKL2.0315產赤蘚糖醇;發酵液FBKL2.0310產甘油、D-阿拉伯糖醇、木糖醇和山梨醇,且由于殘糖量過高,葡萄糖已經超出檢測線,出現平頭峰;發酵液FBKL2.0073產D-阿拉伯糖醇;發酵液FBKL2.0307產D-阿拉伯糖醇和山梨醇,總之,酵母所產多元醇主要為D-阿拉伯糖醇。
利用高效液相色譜法對發酵液中多元醇含量進行測定,將峰面積帶入相應回歸方程可得到各多元醇的產量,結果見表4。
由表4可知,菌株FBKL2.0073產D-阿拉伯糖醇的含量相對最高,為(9.870±0.85)g/L。且其產多元醇的種類及總量最多,同時產三種糖醇。但總的來說,從醬香型白酒釀造過程中篩選出的酵母產多元醇的能力都是較低的[26-28]。這可能與菌株的來源有關,高產多元醇的酵母菌株多是從含糖量豐富的樣品(蜂蜜、花粉)中篩選[9],本次實驗菌株來源于大曲和酒醅,相比之下,可利用的糖類物質較少。
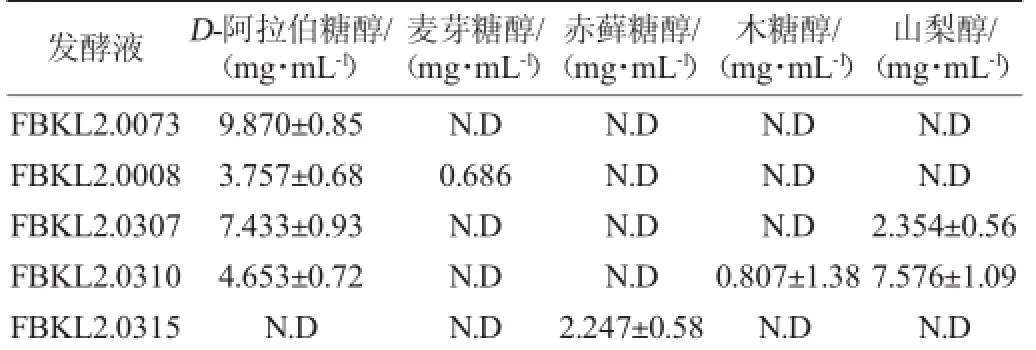
表4 不同酵母發酵液中多元醇含量Table 4 Polyhydric alcohol contents in different yeast fermentation broth
3 結論
本研究篩選出5株產多元醇酵母菌株婁德酵母(Lodderomyceselongisporus)FBKL2.0073、庫得畢赤酵母(Pichia kudriavzevii)FBKL2.0008、TrichosporoncoremiiformeFBKL 2.0310、Trichosporon coremiiformeFBKL2.0307和Trichosporonoidessp.FBKL2.0315,其中Lodderomyces elongisporus FBKL2.0073菌株產多元醇的總量最多,為(9.870±0.85)g/L。從醬香型白酒釀造過程中大曲和酒醅里分離的大部分酵母均有產生多元醇類物質的能力,分別為D-阿拉伯糖醇、麥芽糖醇、赤蘚糖醇、甘油、木糖醇、山梨醇,其中以產D-阿拉伯糖醇較為常見且產量也最高。
[1]崔利.形成醬香型酒風格質量的關鍵工藝是“四高兩長,一大一多”[J].釀酒,2007,34(3):24-35.
[2]王景.白酒中違禁添加劑及特征成分的多種質譜檢測技術研究[D].北京:北京化工大學,2015.
[3]牛之瑞,王秀君,于毅濤,等.液相色譜-質譜聯用同時測定白酒中8種甜味劑[J].食品科學,2016,37(2):178-181.
[4]衛生部食品衛生監督檢驗所.GB 2760—2011食品安全國家標準食品添加劑使用標準[S].北京:中國標準出版社,2011.
[5]陳良強,吳群,徐巖.醬香型白酒低產雜醇油粟酒裂殖酵母特性的研究[J].工業微生物,2013,43(3):1-6.
[6]李豆南,邱樹毅.醬香大曲微生物菌群結構及微生物功能研究概述[J].中國釀造,2017,36(1):5-11.
[7]李欣,王彥華,林靜怡,等.高通量測序技術分析醬香型白酒酒醅的微生物多樣性[J].福建師范大學學報:自然科學版,2017,33(1):51-59. [8]沈怡方.白酒生產技術全書[M].北京:中國輕工業出版社,2008:105-108.
[9]齊向輝,王旭,林靜,等.耐高糖酵母的篩選鑒定及其產多元醇分析[J].食品與發酵工業,2014,40(10):16-21.
[10]SPENCER J F,SALLANS H R.Prouduction of polyhydric alcohols by osmophilic yeasts[J].Can J Microbiol,1956,2(2):72-79.
[11]賀娟,盧大軍,江寧,等.細菌血紅蛋白基因在產D-阿拉伯糖醇酵母菌種的克隆與表達[J].微生物學報,2001,41(3):315-319.
[12]ONISHI H,SUZUKI T.Crobial production of xylitol from glucose[J]. Appl Microbiol,1969,18(6):1031-1035.
[13]范光先,諸葛健,徐成勇.高濃度鹽對耐高滲酵母產多元醇的影響[J].工業微生物,2001,31(1):1-3.
[14]TAT L,COMUZZO P,STOLFO I,et al.Optimization of wine headspace analysis by solid-phase microextraction capillary gas chromatography with mass spectrometric and flame ionization detection[J].Food Chem, 2005,93(2):361-369.
[15]陳美竹.醬香白酒大曲與釀造過程酵母動態變化研究[D].貴陽:貴州大學,2016.
[16]YUE J,NARINE S S.Separation and quantification of vegetable oil based polyols by high performance liquid chromatography with evaporative light scattering detection[J].J Am Oil Chem Soc,2007,84(9): 803-807.
[17]WAMELINK M M C,SMITH D E C,JAKOBS C,et al.Analysis of polyols in urine by liquid chromatography-tandem mass spectrometry: Ausefultoolforrecognitionofinbornerrorsaffectingpolyolmetabolism [J].J Inherit Metab Dis,2005,28(6):951-963.
[18]SHETTY H U,HOLLOWAY H W,RAPOPORT S I.Capillary gas chromatography combined with ion trap detection for quantitative profiling of polyols in cerebrospinal fluid and plasma[J].Anal Biochem, 1995,224(1):279-285.
[19]宋林林,李凈,譚光迅,等.枝江白酒含氮化合物和多元醇的定量分析[J].釀酒,2015,42(3):42-45.
[20]GE S L,WANG H,WANG Z F,et al.Sensitive measurement of polyols in urine by capillary zone electrophoresis coupled with amperometric detection using on-column complexation with borate[J].J Chromatogr B,2013,915-916:39-45.
[21]李澤.產D-阿拉伯醇酵母菌株的篩選及發酵條件研究[D].濟南:山東輕工業學院,2012.
[22]衛生部食品衛生監督檢驗所.GB/T 5009.7—2008食品中還原糖的測定[S].北京:中國標準出版社,2008.
[23]張麗麗.高產D-阿拉伯糖醇酵母菌株的篩選及其發酵條件的研究[D].無錫:江南大學,2009.
[24]張志剛,李長文.高溫大曲生產技術進展及發展趨勢[J].中國釀造,2013,32(6):9-11.
[25]朱群英,江勇,甘鈺.HPLC-ELSD法同時測定食品中5種糖[J].食品科學,2008,29(12):503-506.
[26]王鳳偉.耐高滲赤蘚糖醇生產菌的篩選與發酵條件優化[D].無錫:江南大學,2012.
[27]楊其義.木糖醇生產菌株的篩選及工藝優化[D].濟南:齊魯工業大學,2013.
[28]PORTER L,HRSTICH L,CHAN B.The conversion of procyanidins and prodelphinidins to cyaniding and delphinidin[J].Phytochemistry, 1985,25(1):223-230.
TS261.1
0254-5071(2017)05-0058-05
10.11882/j.issn.0254-5071.2017.05.012
2017-01-07
貴州省科技支撐計劃項目(黔科合支撐[2017]2319);貴州省工業攻關項目(黔科合GZ字[2014]3012);貴州省重大專項項目(黔科合重大專項字[2015]6012)
白小燕(1990-),碩士研究生,研究方向為應用微生物。
*通訊作者:王曉丹(1980-),高級實驗師,博士,研究方向為應用生物技術。

