酸濃度和pH值對濃香型大曲酯化酶催化活力的影響
張浩,胡智慧,刑爽,李鎮江,謝彪,肖冬光*
(1.天津科技大學生物工程學院,天津300457;2.成都金開生物工程有限公司,四川成都610000)
酸濃度和pH值對濃香型大曲酯化酶催化活力的影響
張浩1,胡智慧1,刑爽1,李鎮江2,謝彪2,肖冬光1*
(1.天津科技大學生物工程學院,天津300457;2.成都金開生物工程有限公司,四川成都610000)
研究了己酸、乳酸、丁酸、乙酸的濃度以及pH值對濃香型大曲酯化酶催化合成四種酯(己酸乙酯、乳酸乙酯、丁酸乙酯、乙酸乙酯)的影響。結果表明,大曲酯化酶催化合成四種酯的最適酸質量濃度分別為己酸8 g/L,乳酸1 g/L,丁酸9 g/L,乙酸12 g/L;在同一酸濃度條件下,大曲酯化酶催化合成己酸乙酯、丁酸乙酯、乙酸乙酯最適pH值均為4.5,乳酸乙酯最適pH值為6.0;大曲酯化酶催化相同物質的量濃度混合酸的試驗結果表明,己酸乙酯的合成以酯化酶催化反應為主,而乳酸乙酯和丁酸乙酯的合成以化學反應為主。
酸濃度;pH;濃香型大曲;酯化酶

ZHANG Hao1,HU Zhihui1,XING Shuang1,LI Zhenjiang2,XIE Biao2,XIAO Dongguang1*
(1.College of Bioegineering,Tianjin University of Science and Technology,Tianjin 300457,China; 2.Chengdu Biological Engineering Co.,Ltd.,Chengdu 610000,China)
酯類化合物是白酒中的主要風味物質,其含量在白酒風味物質中所占比例最大[1]。白酒中的酯類有100多種,其中乙酸乙酯、己酸乙酯和乳酸乙酯為白酒中的主要酯,含量之和占總酯的90%~95%[2]。酯的合成在化學和酶的作用下均可進行,因此白酒中的酯和相應前體酸的含量以及其量比關系,直接影響白酒的質量和風味[3]。
濃香型大曲是以生料小麥為主要原料經固態發酵而成的發酵劑[4]。大曲具備糖化發酵、投糧、酒化和生香的功能,為白酒發酵提供內在動力,有“大曲是酒之骨”之稱[5]。由于在制曲過程中網羅了自然環境中的大量有益微生物,再經發酵培菌管理,使成品大曲中含有豐富的釀酒微生物菌系和酶系[6-7]。大曲酶系中的酯化酶對催化合成濃香型白酒中己酸乙酯、乳酸乙酯、丁酸乙酯和乙酸乙酯等重要酯類具有重要的作用,在保證白酒品質方面也有極其重要的作用[8]。
從生物化學方面講,凡是酶,其本質都是蛋白質(除自催化的核糖核酸酶外),在催化反應時均存在反應底物及產物、反應溫度、反應時間、反應環境的酸堿度和反應介質(反應溶劑類型)等因素的影響而導致產物酯的生成量的不同[9-10]。同時,酶的催化過程是一個可逆反應,在一定條件下會將已生成的酯分解成相應的酸和醇,同樣會影響酯的生成量[11-12]。
本實驗研究了四種酸(己酸、乳酸、丁酸、乙酸)的濃度及pH值對濃香型大曲酯化酶催化合成四種酯(己酸乙酯、乳酸乙酯、丁酸乙酯、乙酸乙酯)的影響,通過比較不同酸濃度和不同pH值條件下濃香型大曲酯化酶催化合成酯的多少,確定濃香型大曲酯化酶催化合成酯的最適酸濃度和最適pH值,以期為白酒發酵過程中酯類物質的積累起到指導作用。
1 材料與方法
1.1 材料與試劑
濃香型大曲(酯化酶活力為18.16 U/g曲):某酒業有限公司。
己酸、乙酸、丁酸、乳酸、乙醇、氫氧化鈉、硫酸均為國產分析純。
1.2 儀器與設備
EL20實驗室pH計:梅特勒儀器(上海)有限公司;DHP恒溫培養箱:上海智誠分析儀器制造有限公司;BXW-360 SD-G立式壓力滅菌鍋:上海博訊實業有限公司;Agilent7890B氣相色譜儀(gas chromatograph,GC):美國安捷倫科技有限公司。
1.3 實驗方法
1.3.1 乙醇體積分數對大曲中微生物生長代謝的影響
(1)在乙醇體積分數分別為5%、10%、15%、20%和25%的乙醇溶液(100 mL)中,分別添加相同濃度的酸配制成反應液(用稀硫酸溶液調整酸度,稀硫酸濃度為1 mol/L),加入5 g濃香型大曲粉末,30℃靜置反應,第0天和第7天時分別測定不同乙醇體積分數的反應液中總糖含量變化。
(2)將不同乙醇體積分數(5%、10%、15%、20%、25%)的10mL反應液加入5支試管中,并加入0.5g濃香型大曲粉末,分別在試管中加入杜氏小管(避免加入時杜氏小管內部產生氣泡),30℃靜置反應,觀察杜氏小管中氣泡產生情況。
1.3.2 單一酸濃度對大曲酯化酶合成酯的影響
在乙醇體積分數20%的100 mL乙醇溶液中,分別添加不同濃度的己酸、乙酸、丁酸和乳酸配制成反應液,實驗組加入5g正常濃香型大曲粉末,對照組加入5 g滅活的濃香型大曲粉末,30℃靜置反應7 d[13],測定酯含量。
1.3.3 pH值對大曲酯化酶合成單一酯的影響
在乙醇體積分數20%的100 mL乙醇溶液中,保持單一酸濃度(模擬白酒發酵時的酸濃度范圍,取己酸質量濃度為11.60 g/L,乙酸質量濃度為12.00 g/L,丁酸質量濃度為2.46 g/L,乳酸質量濃度為13.50 g/L)不變,實驗組加入5 g正常濃香型大曲粉末,對照組加入5 g滅活的濃香型大曲粉末,并分別用1mol/L的NaOH溶液和1mol/L的H2SO4溶液調節反應液的pH值為6.0、5.0、4.5、4.0、3.5、3.0,30℃靜置反應7 d,測定酯含量。
1.3.4 pH值對大曲酯化酶合成混合酯的影響
將乙醇體積分數20%的100mL乙醇溶液配制成相同物質的量濃度(0.02mol/L)的己酸、乙酸、乳酸和丁酸反應液,實驗組加入5g正常濃香型大曲粉末,對照組加入5 g滅活的濃香型大曲粉末,分別用1 mol/L的NaOH溶液和1 mol/L的H2SO4溶液調節反應液的pH值為6.0、5.0、4.5、4.0、3.5、3.0,30℃靜置反應7 d,測定酯含量。
1.3.5 酯含量的測定
(1)蒸餾:將反應7 d的試樣倒入1 000 mL蒸餾燒瓶中,量取100 mL蒸餾水充分洗滌裝酯化液的三角瓶,將洗液一并倒入燒瓶中蒸餾,取蒸餾液100 mL[14]。
(2)氣相色譜檢測條件:色譜柱Agilent HP-INNOWAX(30 m×320 μm×0.25 μm);載氣為高純氮氣(>99.999%);柱流速為0.8mL/min;進樣口溫度200℃;檢測器溫度200℃;程序升溫:起始溫度50℃,保持8min,以5℃/min升至150℃,保持15 min;進樣體積為1 μL;分流進樣,分流比為10∶1[15]。
1.3.6 總糖含量的測定
將反應溶液搖晃均勻,取10.00 g于250 mL三角瓶,加入100 mL體積分數2%的鹽酸溶液,輕輕搖動三角瓶。瓶口安上長約1 m的長玻璃管,于沸水浴中回流水解2 h。取出,迅速冷卻用氫氧化鈉溶液調pH值至7.0左右。然后用脫脂棉過濾,濾液用500 mL容量瓶接收,用水充分洗滌三角瓶和殘渣,洗液全部濾入容量瓶中,最后用水定容至刻度,再用斐林試劑法滴定糖含量。
2 結果與分析
2.1 乙醇體積分數對大曲中微生物的生長代謝的影響
不同乙醇體積分數的反應液中總糖含量及產氣情況如表1及表2所示。

表1 不同乙醇體積分數反應液中的總糖含量變化Table 1 Changes of total sugar content in the reaction solution with different alcohol content%
由表1可知,當乙醇體積分數為5%~15%時,反應液中總糖含量均減少,并且隨乙醇體積分數的升高總糖消耗量逐漸減少;當乙醇體積分數≥20%時,總糖含量基本不變。

表2 不同乙醇體積分數反應液中的產氣情況Table 2 Gas production in the reaction solution with different alcohol content
由表2可知,當乙醇體積分數<20%時,隨反應時間延長產氣逐漸增多,并且隨乙醇體積分數的升高產氣逐漸較少;當乙醇體積分數≥20%時,無產氣現象。
根據不同乙醇體積分數的反應液中總糖含量變化和杜氏小管的充氣情況,推斷反應液乙醇體積分數為20%時,微生物基本無生長代謝情況,因此研究大曲酯化酶催化活性時可使用乙醇體積分數20%的反應液。
2.2 酸濃度對大曲酯化酶合成酯的影響
2.2.1 己酸質量濃度對大曲酯化酶催化合成己酸乙酯的影響

表3 己酸質量濃度對大曲酯化酶合成己酸乙酯的影響Table 3 Effect of hexanoic acid concentration on the synthesis of ethyl hexanoate by Daqu esterifying enzymemg/L
由表3可知,在不同的酸濃度條件下,大曲酯化酶合成和分解酯的情況不同。加滅活曲時,大曲中酯化酶已失活,反應系統因單純的化學合成作用而合成己酸乙酯,并且隨著己酸的濃度在一定范圍內逐漸增大,己酸乙酯的合成量不斷增加。加正常曲時,己酸乙酯的合成量呈先升高后降低的趨勢。當己酸質量濃度<8 g/L時,己酸乙酯的合成量隨己酸濃度的增大而增加;己酸質量濃度為8 g/L時,己酸乙酯的合成量最大;繼續增大己酸的濃度,己酸乙酯的合成量逐漸減少。至己酸質量濃度達17 g/L時,綜合作用(加正常大曲反應系統)的己酸乙酯合成量<化學作用(加滅活曲反應系統)的己酸乙酯合成量,酯化酶催化反應合成己酸乙酯的量為負值,此時酯化酶的作用表現為酯分解反應。這是因為酶的催化反應過程為可逆的,即酯合成作用和酯分解作用同時存在,當己酸質量濃度>17 g/L時,理論上,綜合作用的酯包括化學合成酯和酯化酶合成酯兩部分,即綜合作用酯合成量應>化學作用酯合成量,而實際,綜合作用酯的合成量<化學作用酯的合成量,由此可見,大曲酯化酶分解了部分酯,主要表現為酯的分解作用;而當反應系統的己酸質量濃度<17 g/L時,綜合作用合成酯>化學作用合成酯,大曲酯化酶主要表現為酯的合成作用。因此己酸質量濃度為8 g/L時,最適合合成己酸乙酯。2.2.2乳酸質量濃度對大曲酯化酶催化合成乳酸乙酯的影響
表4 乳酸質量濃度對大曲酯化酶合成乳酸乙酯的影響Table 4 Effect of lactic acid concentration on the synthesis of ethyl lactate by Daqu esterifying enzymemg/L
由表4看出,當乳酸質量濃度為1 g/L時,酯化酶催化合成乳酸乙酯的量最高,繼續加大乳酸濃度,乳酸乙酯合成量逐漸減小;當乳酸質量濃度為5 g/L時,酶催化反應合成乳酸乙酯的量為負值,綜合作用的乳酸乙酯合成量<化學作用的乳酸乙酯合成量;此后,隨著乳酸濃度的提高,化學反應起主導作用。在白酒生產中,酒醅中的乳酸質量濃度一般達10~30 g/L,可見,在白酒發酵過程中乳酸乙酯的合成方式以化學合成作用為主。因此乳酸質量濃度為1 g/L時,最適合合成乳酸乙酯。
2.2.3 丁酸質量濃度對大曲酯化酶催化合成丁酸乙酯的影響
表5 丁酸質量濃度對大曲酯化酶合成丁酸乙酯的影響Table 5 Effect of butyric acid concentration on the synthesis of ethyl butyrate by Daqu esterifying enzymemg/L
由表5可知,在丁酸質量濃度為1~21 g/L時,加正常曲和加滅活曲反應系統的丁酸乙酯含量都隨酸濃度的增加而增加;從酶合成作用看,當丁酸質量濃度為9 g/L時丁酸乙酯的合成量最大,此后隨著酸濃度的增加酶合成作用有所減弱;從化學合成作用與酶合成作用的比較看,除酶作用的最適酸質量濃度(9 g/L)外,丁酸乙酯的化學合成作用都>酯化酶合成作用。因此丁酸質量濃度為9 g/L時,最適合合成丁酸乙酯。
2.2.4 乙酸質量濃度對大曲酯化酶催化合成乙酸乙酯的影響
由表6可知,加正常曲時,乙酸質量濃度為15 g/L時,乙酸乙酯的合成量最大;繼續增加酸質量濃度,乙酸乙酯的合成量逐漸減少。從酶合成作用看,當乙酸質量濃度為12 g/L時,酶合成乙酸乙酯的量最大;至乙酸質量濃度達27 g/L時,酯化酶作用合成乙酸乙酯的量為負值,大曲酯化酶表現為分解作用。因此丁酸質量濃度為12 g/L時,最適合合成乙酸乙酯。

表6 乙酸質量濃度對大曲酯化酶合成乙酸乙酯的影響Table 6 Effect of acetic acid concentration on the synthesis of ethyl acetate by Daqu esterifying enzymemg/L
2.3 pH值對大曲酯化酶催化合成單一酯的影響
2.3.1 pH值對大曲酯化酶催化合成己酸乙酯的影響
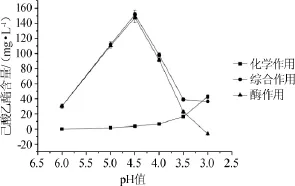
圖1pH值對大曲酯化酶合成己酸乙酯的影響Fig.1 Effect of pH value on the synthesis of ethyl hexanoate by Daqu esterifying enzyme
從圖1可知,pH值對大曲酯化酶合成己酸乙酯有很大影響。當反應液的pH值為4.5時,酶作用合成己酸乙酯的量最大;當pH值>4.5時,化學作用合成己酸乙酯的量的變化可忽略,酶作用合成己酸乙酯的量隨pH值的下降而上升;當pH值<4.5時,化學作用合成己酸乙酯的量隨pH值的下降逐漸上升,而酶作用合成己酸乙酯的量逐漸下降;至pH值為3.0時,酯化酶作用合成己酸乙酯的量為負值,此時大曲酯化酶表現為酶分解作用。因此合成己酸乙酯的最適pH值為4.5。
2.3.2 pH值對大曲酯化酶催化合成乳酸乙酯的影響
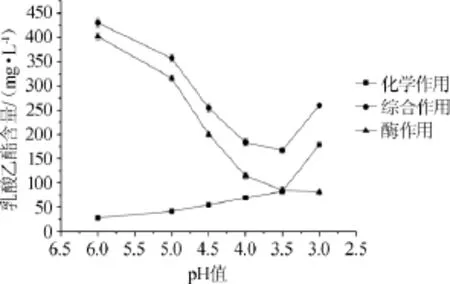
圖2pH值對大曲酯化酶合成乳酸乙酯的影響Fig.2 Effect of pH value on the synthesis of ethyl lactate by Daqu esterifying enzyme
由圖2可知,當反應液pH值為3.0時,化學作用合成酯的量大于酶作用合成酯的量,由于該pH值時化學作用合成的乳酸乙酯的量很大,并且綜合作用中的酯是由化學和酶的雙重作用合成的,所以此時綜合作用合成乳酸乙酯的量突然升高;當pH值>3.5時,化學作用合成乳酸乙酯的量逐漸降低,而酶作用合成乳酸乙酯的量逐漸上升;至pH值為6.0時,酶作用合成乳酸乙酯的量最大。pH值在3.0~6.0范圍內時,酶作用合成乳酸乙酯的合成量隨pH值升高有增強的趨勢。因此合成乳酸乙酯的最適pH值為6.0。
2.3.3 pH值對大曲酯化酶催化合成丁酸乙酯的影響
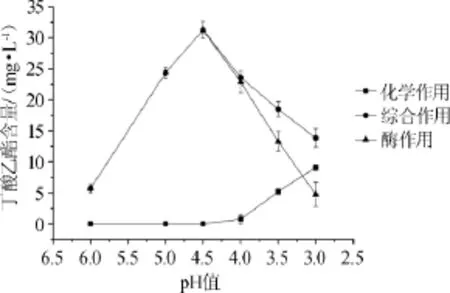
圖3pH值對大曲酯化酶合成丁酸乙酯的影響Fig.3 Effect of pH value on the synthesis of ethyl butyrate by Daqu esterifying enzyme
由圖3可知,當反應液的pH值為4.5時,酶作用合成丁酸乙酯的量最大;當pH值>4.5時,化學反應合成丁酸乙酯的量為零,而酶作用合成乙酸乙酯的量隨pH值的下降而上升;當pH值<4.5時,化學作用合成丁酸乙酯的量逐漸上升,而酶作用合成丁酸乙酯的量逐漸下降;至pH值為3.0時,化學合成作用>酶合成作用。因此合成丁酸乙酯的最適pH值為4.5。
2.3.4 pH值對大曲酯化酶催化合成乙酸乙酯的影響
由圖4可知,當反應液的pH值為4.5時,酶作用合成乙酸乙酯的量最大;當pH值>4.5時,化學作用合成乙酸乙酯的量可基本忽略,酶作用合成乙酸乙酯的量隨pH值的下降而上升;當pH值<4.5時,化學作用合成乙酸乙酯的的量逐漸上升,而酶作用合成乙酸乙酯的量逐漸下降;至pH值為3.0時,化學合成作用>酶合成作用。因此合成乙酸乙酯的最適pH值為4.5。

圖4pH值對大曲酯化酶合成乙酸乙酯的影響Fig.4 Effect of pH value on the synthesis of ethyl acetate by Daqu esterifying enzyme
2.4 pH值對大曲酯化酶催化合成混合酯的影響
為了更加直觀的比較不同pH值條件下大曲酯化酶催化合成四種酯的能力以及化學作用合成四種酯的強弱情況,特將混合酸溶液中己酸、乳酸、丁酸和乙酸的質量濃度換算為相同的摩爾濃度,并且將合成酯的結果單位同樣以摩爾濃度表示,其結果如表7所示。

表7pH值對大曲酯化酶合成混合酯的影響Table 7 Effect of pH on the synthesis of mixing ester by Daqu esterifying enzymemmol/L
從表7看出,大曲酯化酶催化合成不同酯的最適pH值有所不同,其中乳酸乙酯為6.0,己酸乙酯、丁酸乙酯和乙酸乙酯為4.0~4.5。從化學作用合成酯的效果看,乳酸乙酯的合成量最大,其次為乙酸乙酯和丁酸乙酯,己酸乙酯的化學合成量最少。從酯化酶作用合成酯的效果看,己酸乙酯的合成量最大,其次為乙酸乙酯和乳酸乙酯,丁酸乙酯的酶作用合成量最少。從酯化酶作用與化學作用合成酯的比例看,酶作用合成酯最大值與化學作用合成酯最大值的比值分別為己酸乙酯1.371,乳酸乙酯0.288,丁酸乙酯0.160,乙酸乙酯0.540,其中己酸乙酯的比值最大,乙酸乙酯次之,丁酸乙酯和乳酸乙酯的比值較小,由此可見,己酸乙酯的合成主要以酯化酶催化作用為主,而丁酸乙酯和乳酸乙酯的合成以化學作用為主。
3 結論
酸質量濃度對濃香型大曲酯化酶催化合成四種酯的含量有很大影響,其最適酸質量濃度分別為己酸8 g/L,乳酸1 g/L,丁酸9 g/L,乙酸12 g/L,高于最適酸質量濃度時其合成相應酯的能力明顯下降。
在同一酸濃度下,pH值對大曲酯化酶合成酯的含量有很大影響,其中合成己酸乙酯、丁酸乙酯和乙酸乙酯的最適pH值為4.5,合成乳酸乙酯最適pH值為6.0。當pH≤3.0時,大曲酯化酶催化合成四種酯的作用都<化學合成作用。
從大曲酯化酶作用合成酯與化學作用合成酯的比例看,己酸乙酯的比值最大,乙酸乙酯次之,丁酸乙酯和乳酸乙酯的比值最小,由此可見,己酸乙酯的合成主要以酯化酶催化作用為主,而丁酸乙酯和乳酸乙酯的合成以化學作用為主。
[1]唐取來,李晶晶,郭學武,等.清香型大曲酯化酶活力的研究[J].中國釀造,2017,36(1):35-38.
[2]滕巍,李國瑩,劉小波,等.大曲中產酯化酶菌株的分離鑒定及固體發酵工藝優化[J].食品與生物技術學報,2016,35(9):971-977.
[3]任佳明,李付麗,吳鑫穎,等.紫色紅曲霉FBKL3.0018液態發酵產酯化酶的研究[J].中國釀造,2016,35(7):69-73.
[4]陳洋.耐乙醇醋酸菌特性研究及應用[D].武漢:湖北工業大學,2016.
[5]喬曉梅.清香大曲糖化力酯化力功能及真菌群落結構分析[D].臨汾:山西師范大學,2015.
[6]張家慶.濃香型白酒窖泥養護與制曲關鍵技術研究[D].武漢:湖北工業大學,2015.
[7]沈怡方.白酒生產技術全書[M].北京:中國輕工業出版社,1998:34-41.
[8]張志剛,吳生文,陳飛.大曲酶系在白酒生產中的研究現狀及發展方向[J].中國釀造,2011,30(1):13-16.
[9]MARTINS A B,GRAEBIN N G,LORENZONI A S G,et al.Rapid and high yields of synthesis of butyl acetate catalyzed by Novozym 435:reaction optimization by response surface methodology[J].Process Biochem, 2011,46(12):2311-2316.
[10]PIYATHEERAWONG W,LWAASKI Y G,XU X B,et al.Dependency of water concentration on ethanolysis of trioleoylglycerol by lipases[J]. J Mol Catal B-Enzym,2004,28(1):19-24.
[11]李付麗.紫色紅曲霉產酯化酶的研究[D].貴陽:貴州大學,2015.
[12]張武斌.清香大曲糖化酶的提取及宏蛋白質組學分析[D].臨汾:山西師范大學,2014.
[13]中華人民共和國工業和信息化部.QB/T 4257—2011釀酒大曲通用分析方法[S].北京:中國標準出版社,2012.
[14]李海龍,黃衛星,沈才洪,等.濃香型白酒蒸餾過程實驗研究[J].高校化學工程學報,2011(5):745-750.
[15]張超,胡可萍,端裕樹,等.快速氣相色譜法分析白酒中的香味組分[J].色譜,2007(4):586-589.
TS261.1
0254-5071(2017)05-0041-05
10.11882/j.issn.0254-5071.2017.05.009
2017-01-10
國家高技術研究發展計劃‘863計劃’項目(2012AA022108);中國白酒3C計劃項目(1400040024)
張浩(1989-),男,碩士研究生,研究方向為現代釀造技術。
*通訊作者:肖冬光(1956-),男,教授,博士,研究方向為發酵工程。

