海洋細菌Planococcus rifietoensis發酵產色素培養基的優化
孔 菲, 蔡宇杰, 許 晨, 許建中, 夏金梅
(1.江南大學 生物工程學院,江蘇 無錫 214122;2.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫214122;3.國家海洋局第三海洋研究所海洋生物遺傳資源重點實驗室,福建 廈門361005)
海洋細菌Planococcus rifietoensis發酵產色素培養基的優化
孔 菲1,2,3, 蔡宇杰*2, 許 晨3, 許建中3, 夏金梅3
(1.江南大學 生物工程學院,江蘇 無錫 214122;2.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫214122;3.國家海洋局第三海洋研究所海洋生物遺傳資源重點實驗室,福建 廈門361005)
在單因素的基礎上,以Plackett-Burman(PB)設計結合響應面(RSM)分析法,對產色素海洋細菌Planococcus rifietoensis發酵培養基的8個營養成分配比進行優化。結果表明:培養基最佳碳氮源分別是葡萄糖和蛋白胨,葡萄糖、MgSO4·7H2O和酵母粉添加量顯著影響色素的產量。Box-Benhnken設計分析確定最優培養基配方為:葡萄糖9.78 g/L,蛋白胨 8.00 g/L,酵母粉2.05 g/L,MgSO4·7H2O 8.17 g/L,Na2HPO40.1 g/L,FeSO4·7H2O 0.005 g/L,NaCl 10 g/L,CaCl20.1 g/L,培養54 h,在此培養條件下,色素的OD值可達0.984,比優化前提高了245%。
海洋細菌;響應面優化;色素
色素是食品添加劑的重要組成成分,不僅廣泛應用于食品工業以全面改善食品的外觀和色澤[1],還廣泛應用于生物制藥、化妝品和紡織等領域[2]。天然色素由于產量低,著色力低,對光、熱、氧、酸堿穩定性差,成本高等因素,在19世紀中葉逐步被合成色素取代[3-4]。隨著現代生物學和醫學的發展,發現大多數合成色素具有不同程度的毒性,危害人體健康。而天然色素源于自然,在自然界中易被分解,不在生物體內累積,無毒、安全性高,有很高的營養價值和藥理功能,因而越來越受到人們的青睞[5-6]。但是,動植物來源的天然色素提取困難,難以大規模生產,與動、植物色素相比,微生物色素不易受氣候、地域等因素影響,是一類優良的天然色素來源[7-8]。微生物生產的色素種類繁多,有類胡蘿卜素、黑色素、醌類等[9]。國內外學者對各種微生物色素進行了研究,Vimal S等用響應面設計優化了紅曲霉MTCC410液態發酵產紅曲色素的培養條件[10],Wang等采用Plackett-Burman和Box-Behnken設計研究培養條件對Duganella SP發酵生產紫色桿菌素的影響[11],Claira等分離Serratia marcescens并以紅糖作為其營養物質生產靈菌紅素[12]。海洋微生物產色素也得到了關注,何磊研究了培養基組分和發酵工藝條件對一株海洋酵母菌產蝦青素的影響并探索了胞內色素的保藏穩定性[13],王曉磊對1株由威海近海分離得到的海洋細菌SS04進行了鑒定并探究了其發酵條件的優化[14]。
海洋微生物主要包括生活在海水、海洋沉積物中的微生物(海泥)及與海洋動植物共附生的微生物[15]。由于其所處的高壓、高鹽、低溫、缺氧、低營養等獨特的環境,海洋微生物能夠產生大量結構新穎并具有良好生物活性的天然產物。目前海洋微生物資源的研究和開發越來越受到世界各國的重視[16]。海洋色素正處在一個快速發展的階段,很多的色素分子已經被證明具有生物活性,從抗微生物到抗腫
瘤等[17-18]。
本文作者以一株能產黃色素的海洋細菌為研究對象,首先在單因素的基礎上用PB試驗篩選出對色素產量有顯著影響的因素,再進行響應面的Box-Benhnken試驗設計,對發酵培養基進行了優化。
1 材料與方法
1.1 材料
1.1.1 菌種 萊比托泉動性球菌 Planococcus rifietoensis(菌株編號1A05980),國家海洋局第三海洋研究所菌種保藏中心提供。
1.1.2 培養基
1)平板培養基:2216E海洋細菌培養基。
2)種子培養基:蛋白胨5 g,酵母粉1 g,MgSO4· 7H2O 2 g,陳海水1 000 mL;pH為6。
3)基礎發酵培養基:同種子培養基。
4)培養基滅菌條件為:121℃下滅菌20 min。
1.1.3 主要儀器 紫外可見分光光度計,北京普希通用儀器有限公司制造;DYML-S50A-3型壓力蒸汽滅菌鍋,北京勤誠盛達科學儀器有限公司制造;SW-CJ-1FD型超凈工作臺,蘇州凈化設備有限公司制造;LRH-70F型生化培養箱,上海一恒科技有限公司制造;GZX-9420 MBE型電熱恒溫鼓風干燥箱,上海博訊實業有限公司醫療設備廠制造;J-25型低溫高速離心機,貝克曼有限公司制造;KQ-700DA型數控超聲波清洗器,昆山超聲儀器有限公司制造。
1.2 方法
1.2.1 菌株培養 挑取一環活化于2216E平板固體培養基上的1A05980單菌落,接種至裝有50 mL液體培養基的250 mL的三角瓶,在180 r/min、25℃條件下培養12 h。以體積分數6%的接種量移取種子液至裝有50 mL發酵培養基的250 mL的三角瓶中,在180 r/min、25℃條件下振蕩培養54 h,獲得已產色素的發酵液。
1.2.2 色素的提取 將發酵液在118.54 g的條件下離心15 min,棄上清液,得金黃色菌體,烘干至質量恒定,研碎,添加一定體積的溶劑,作超聲波提取15 min,浸泡2 h后,離心得黃色素浸提液,濃縮得黃色素粗提物[19]。菌體干重法測定生物量。
1.2.3 最大吸收波長的測定 取色素的甲醇浸提液,利用紫外可見分光光度計進行光譜掃描,空白對照為甲醇,選取掃描波長為200~800 nm,確定其最大吸收波長。
1.2.4 發酵條件的優化 通過單因素試驗篩選出發酵培養基適宜的氮源、碳源。再進行Plackett-Burman實驗設計[20]。本實驗中采用N=12的PB試驗設計,對發酵培養基中的8個成分質量濃度(A為葡萄糖;B為蛋白胨;C為酵母粉;D為 MgSO4· 7H2O;E為FeSO4·7H2O;F為 Na2HPO4;G為CaCl2;H為NaCl)進行考察,響應值為色素OD值(Y)。每個因素取高水平“1”和低水平“-1”,并設3個虛擬變量作誤差分析,用Design expert 8.0軟件進行實驗設計,見表1。
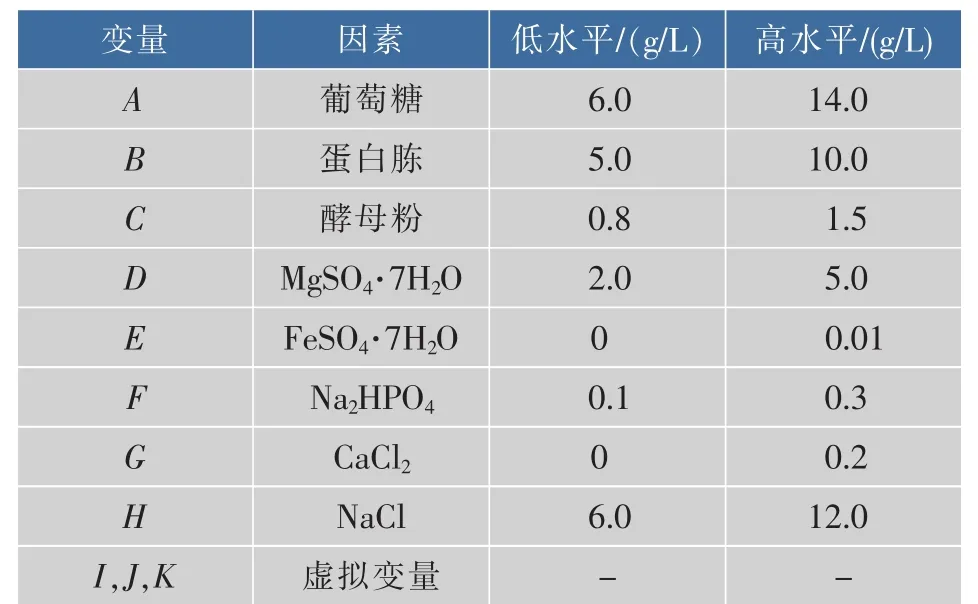
表1 PB設計因素水平Table 1 Factors and levels of the Plackett-Burman design
在Plackett-Burmen實驗結果的基礎上,對確定影響黃色素產量的3個主要因素進行Box-Benhnken設計[20]。每個因素取3個水平(見表2),對實驗數據結果進行回歸分析得到一個二次多項式方程,此方程反映了響應量與自變量的關系,進而分析確定細菌1A05980發酵產色素的最佳培養基。
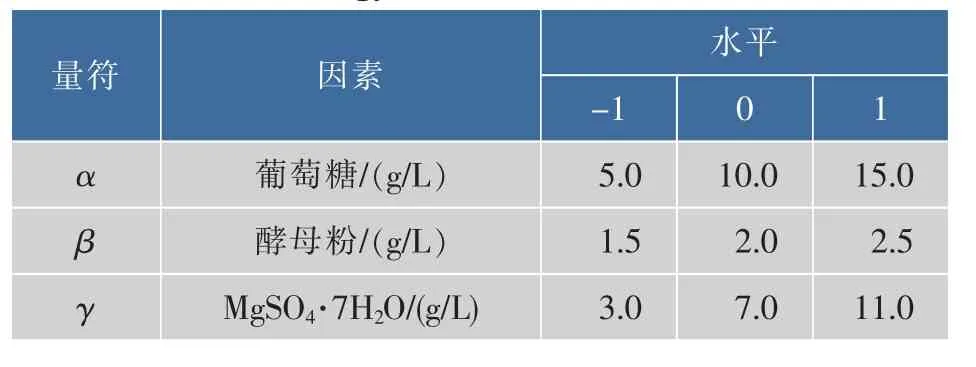
表2 響應面設計因素水平Table 2 Factors and levels of the response surface methodology
2 結果與分析
2.1 提取溶劑的選擇
將等量的菌體分別浸泡于多種試劑2 h后,觀察發現,該黃色素在極性不同的溶劑中的溶解度存在明顯的差異,如表3所示。石油醚、乙酸乙酯、三氯甲烷等極性較小的溶劑浸泡菌體后,所得溶液幾乎不呈現黃色,即該黃色素在其中的溶解度極小;而甲醇浸泡菌體所得溶液黃色明顯較深,乙醇和乙酸次之。因此選擇甲醇作為色素的提取溶劑。
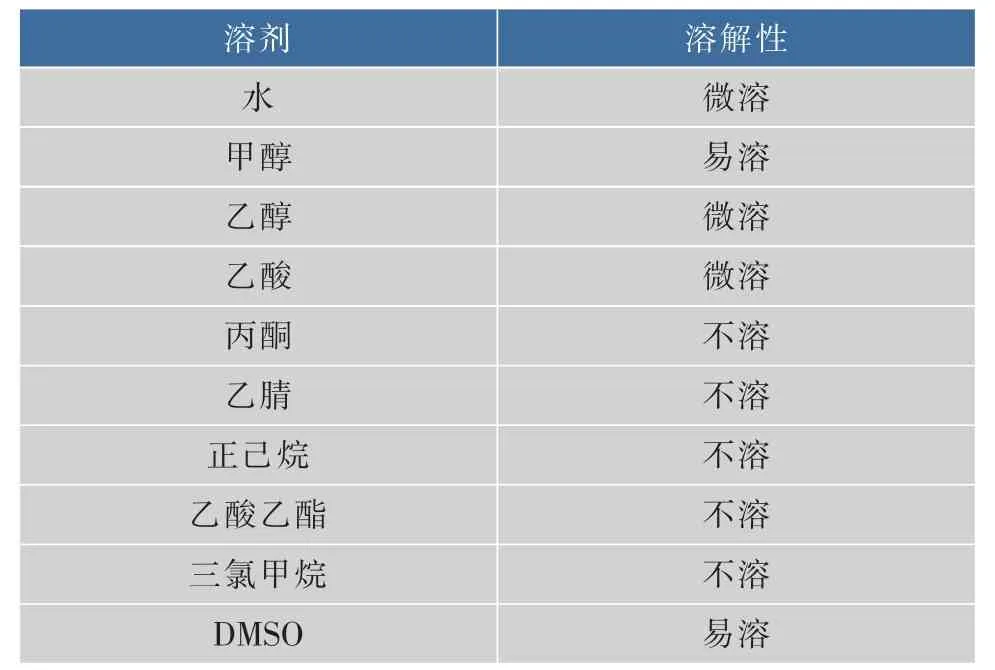
表3 色素提取溶劑的選擇Table 3 Choice of extraction solvents
2.2 最大吸收波長的確定
全波長掃描后分析圖譜(圖1)可知其最大吸收波長為480 nm。
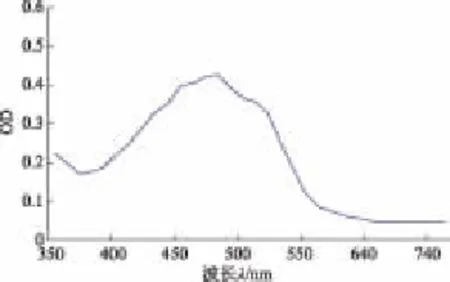
圖1 色素溶液的吸收光譜Fig.1 Absorption spectrum of the pigment solution
2.3 最佳發酵時間的確定
按1.2.1培養細菌1A05980,分別取培養時間為6、12、18、24、30、36、48、54 h和72 h的發酵液20 mL提取色素,測定色素OD值,其結果如圖2所示,在發酵過程中,1A05980菌株在6~72 h范圍內均有黃色素產生,且培養至54 h時,黃色素產量最高,由此得出該菌株最適發酵時間為54 h。
2.4 單因素實驗
2.4.1 不同碳源對色素產量的影響 按照基礎發酵培養基,分別添加質量濃度0.5 g/dL的葡糖糖、蔗糖、乳糖、甘油、麥芽糖、麥芽糊精、可溶性淀粉作為碳源,接種量體積分數6%、25℃、180 r/min培養54 h,測色素OD值和生物量。如圖3所示,以葡萄糖作為碳源時,海洋細菌1A05980產色素OD值最高,以麥芽糖作為碳源時,生物量雖然較高,但是色素產量較少,加之工業葡萄糖價格便宜,使用起來成本較低,因此選擇葡萄糖作為發酵生產的碳源。
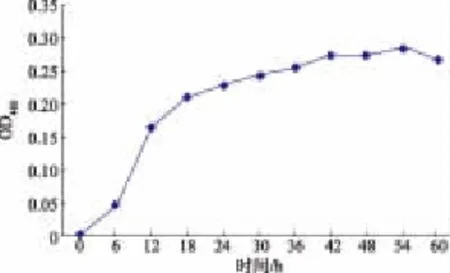
圖2 菌株1A05980的產色素曲線Fig.2 Time dependence of pigment production by strain 1A05980
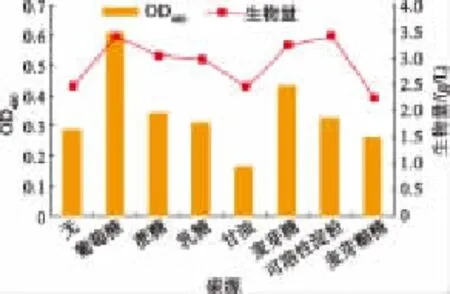
圖3 碳源種類對海洋細菌1A05980產色素的影響Fig.3 Effect of different carbon sources on pigment production of marine bacterium 1A05980
2.4.2 不同氮源對色素產量的影響 以質量濃度為1 g/dL的葡萄糖作為碳源,分別添加質量濃度0.5 g/dL的酵母粉和蛋白胨,接種體積分數6%、180 r/min、25℃培養54 h,測定色素OD值和生物量。如圖4所示,單獨以酵母粉或蛋白胨為氮源時,色素的產量都不高,再考察添加質量濃度0.1 g/dL的酵母粉分別與質量濃度0.5 g/dL的蛋白胨、酵母膏、干酪素、硝酸鉀、脲和硫酸銨混合作為氮源。研究發現,以酵母粉和蛋白胨混合作為氮源時,色素的OD值較高。因此選擇酵母粉和蛋白胨混合作為細菌發酵產色素的氮源。結果總體顯示,添加有機氮源比無機氮源對產色素更有利,這可能是有機氮源除了為菌體的生長提供氮源外,還能提供必要的生長因子,有利于色素的產生。
2.4.3 NaCl添加量對產色素的影響 由于菌株1A05980為海洋細菌,仍具備海洋微生物一些不同于陸地微生物的生活習性和遺傳特征。NaCl通常在培養基中起著維持菌體內外滲透壓、維持細胞內外電勢差、參與物質運輸的作用[21]。在液體發酵培養基中分別加入0~40 g/L的NaCl,考察菌株產色素和生長的變化,結果顯示(圖5),當NaCl質量濃度處于10~20 g/L范圍內,均有利于菌體的生長。考慮到過高的鹽度造成反應設備的腐蝕并在下游工程中造成不便 ,選擇10 g/L的NaCl添加量。
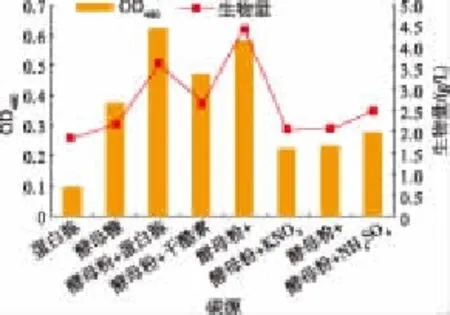
圖4 氮源種類對海洋細菌1A05980產色素的影響Fig.4 Effect of different nitrogen sources on pigment production of marine bacterium 1A05980
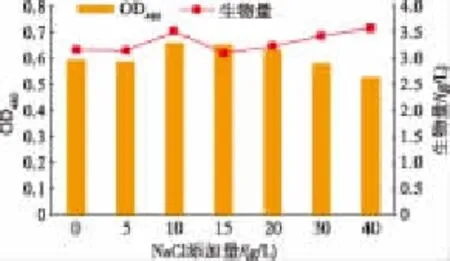
圖5 不同鹽度對海洋細菌1A05980產色素的影響Fig.5 Effect of salinity on pigment production of marine bacterium 1A05980
2.5 Plackett-Burman設計篩選顯著因素
通過Plackett-Burman試驗,篩選出對海洋細菌1A05980液態發酵產色素有顯著影響的營養成分。實驗結果見表4,PB設計方差分析見表5。從各變量的回歸系數可看出葡萄糖、蛋白胨、酵母粉、CaCl2、MgSO4·7H2O、FeSO4·7H2O、NaCl顯 示 正 效 應 ,Na2HPO4顯示負效應。PB設計結果的方差分析表明,葡萄糖、酵母粉和MgSO4·7H2O的效應最大,且在置信區間 95%之中,是影響色素產量的顯著因素。所以將葡萄糖、酵母粉和MgSO4·7H2O的質量濃度進一步采用響應面法進行優化,以確定最佳發酵培養基成分。
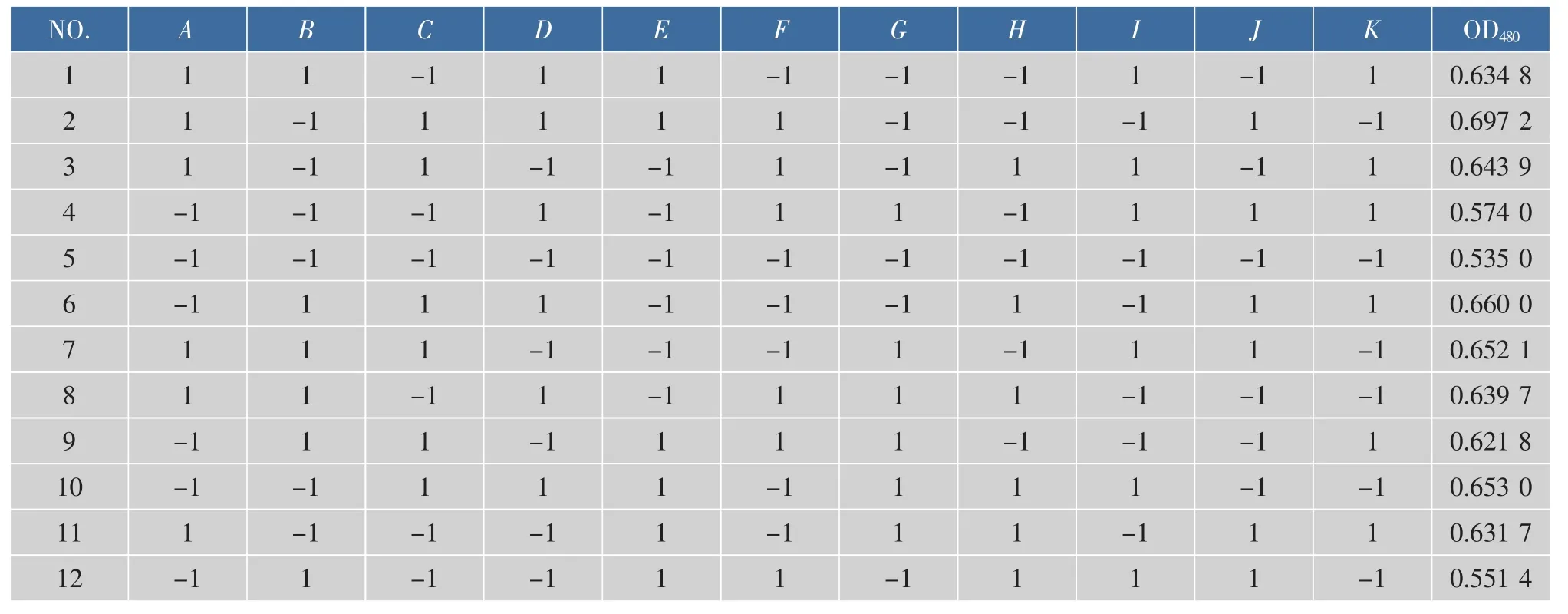
表4 Plackett-Burman設計及結果分析Table 4 Experimental design and results of the PBD
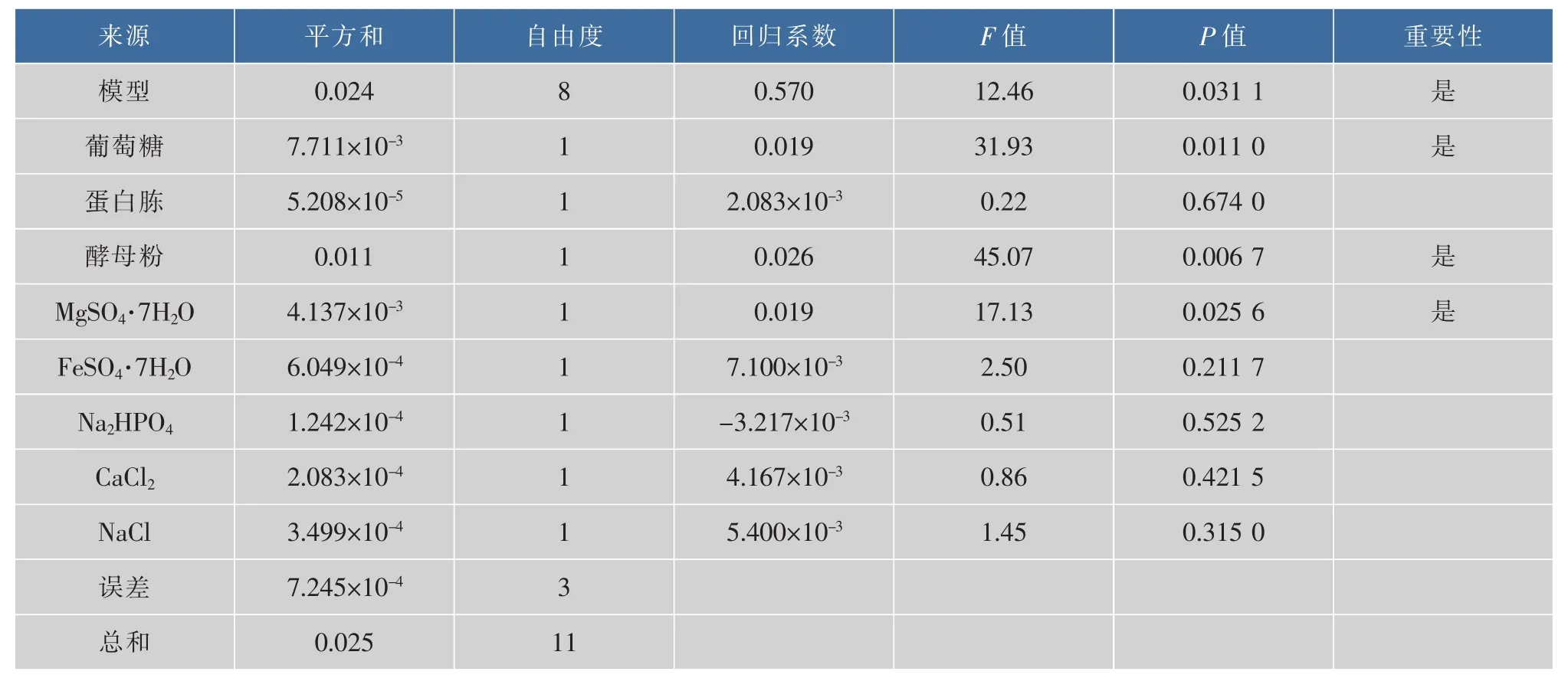
表5 Plackett-Burman設計方差分析Table 5 Results of the PBD ANOVA analysis
2.6 響應面優化結果分析
以葡萄糖(α)、酵母粉(β)、MgSO4·7H2O(γ)3個因素為自變量,色素的OD值(Y)為響應值,以Box-Benhnken模型進行試驗設計,采用 Design Expert 8.0對試驗數據進行分析。試驗設計及結果見表6。擬合得到二次回歸模型如下:
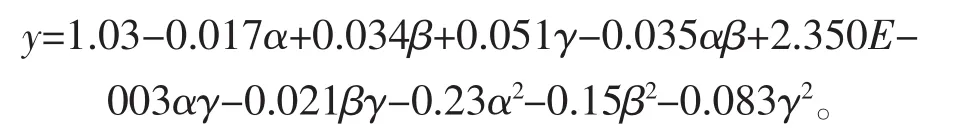
此數學模型的方差分析結果見表7,模型的P< 0.000 1,表明該模型顯著,可用來進行響應值預測;失擬項的P=0.941 2,表明模型擬合程度理想;復相關系數R2=0.987 9(R2Adj=0.972 2),表明方程的擬合度較好。由回歸模型繪出葡萄糖、酵母粉和MgSO4· 7H2O對色素吸光度值影響的曲面圖和等高線圖(圖6)。回歸方程求導得到此模型的最大值,當葡萄糖、酵母粉和MgSO4·7H2O的添加量分別為9.78、2.05 g/L和8.17 g/L,最大響應值為1.039 35。因此確定海洋細菌1A05980發酵產色素的最優培養基組分:葡萄糖9.78 g/L,蛋白胨 8.00 g/L,酵母粉2.05 g/L,MgSO4·7H2O 8.17 g/L,Na2HPO40.1 g/L,FeSO4·7H2O 0.005 g/L,NaCl 10 g/L,CaCl20.1 g/L。為了檢驗模型
預測的準確性,使用此培養基,控制培養溫度25℃,培養時間54 h,進行3次驗證實驗,所得實際的色素吸光度平均值為0.984。實際值達到理論預測值的94.67%,十分接近,說明該模型可以較好地預測實際發酵情況。
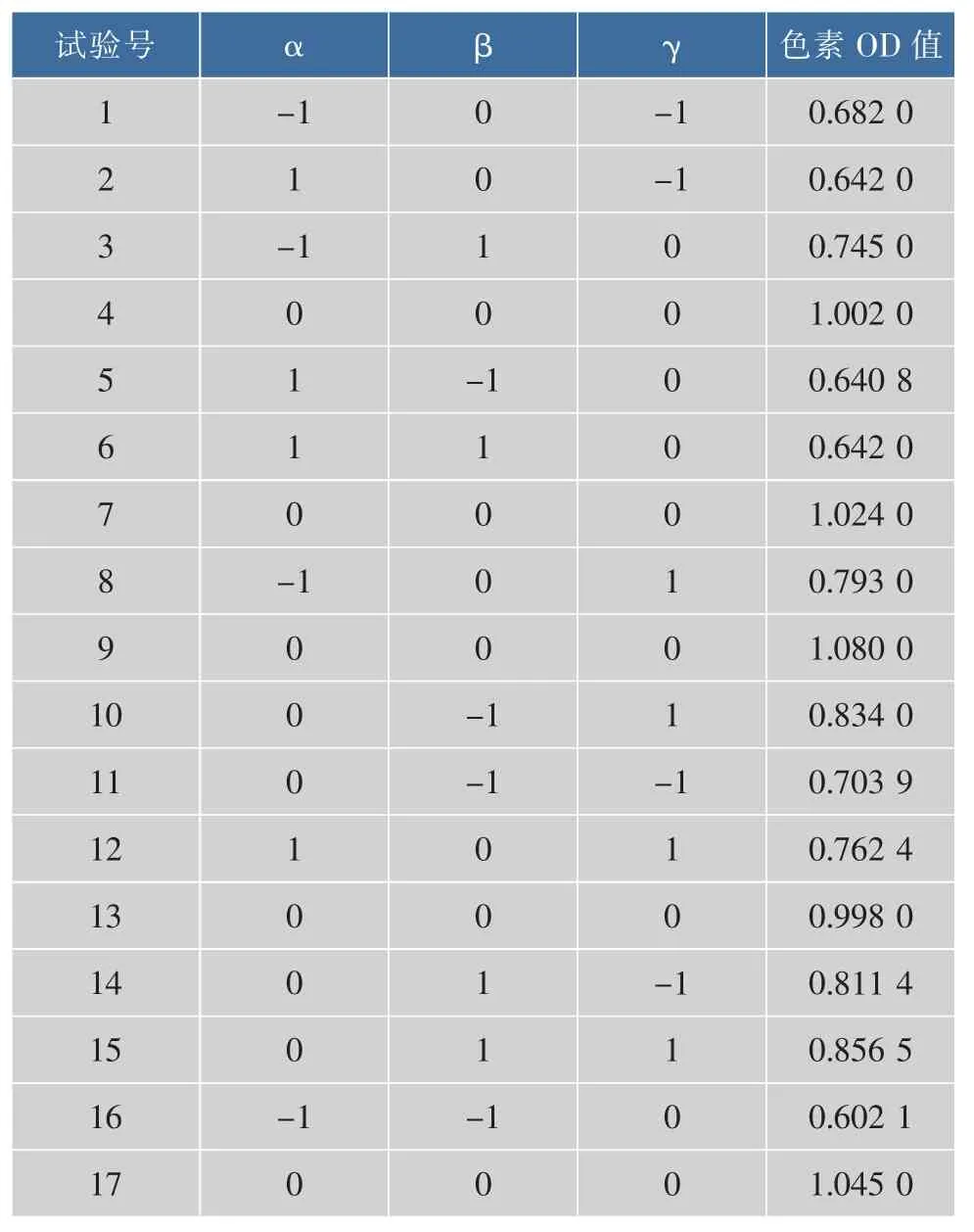
表6 Box-Benhnken試驗設計及結果Table6 Experimentaldesign and resultsofBox-Benhnken design(BBD)
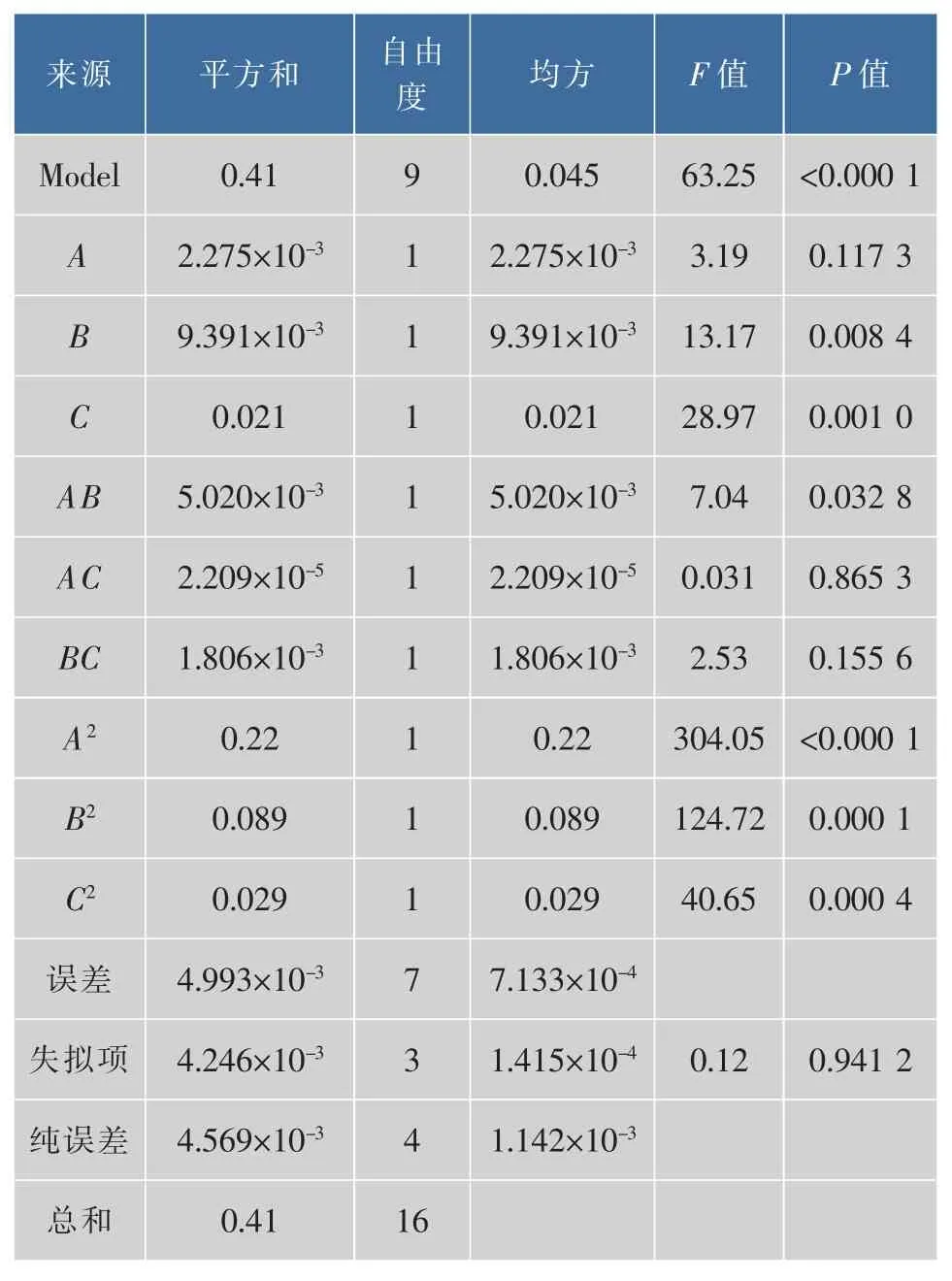
表7 RSM設計的多元二次模型方差分析Table 7 ANONA for the response surface quadratic model

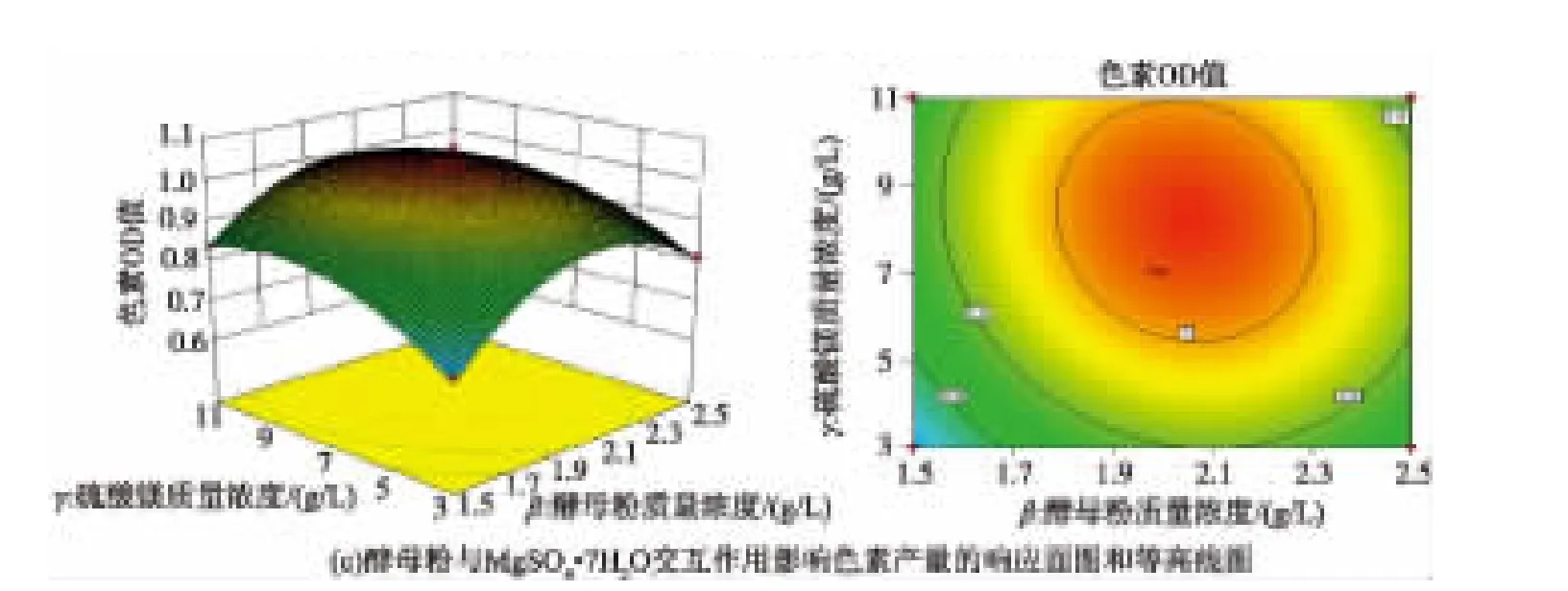
圖6 葡萄糖、酵母粉和MgSO4·7H2O對色素吸光度影響的曲面圖和等高線圖Fig.6 Response surface and contour plots showing the effect of cross-interaction among glucose,yeast extract and MgSO4·7H2O on the production of pigment
3 結語
運用Plackett-Burman法確定了葡萄糖、酵母粉和MgSO4·7H2O是影響海洋細菌1A05980液態發酵產色素的主要因素,然后采用響應面法中的Box-Benhnken設計建立了顯著因子與色素產量的二次多項數學模型,確定液態發酵培養基的成分為:葡萄糖9.78 g/L,蛋白胨8.00 g/L,酵母粉2.05 g/L,MgSO4·7H2O 8.17 g/L,Na2HPO40.1 g/L,FeSO4·7H2O 0.005 g/L,NaCl 10 g/L,CaCl20.1 g/L。使用此培養基,控制培養溫度25℃,培養時間54 h,得到發酵液色素的OD值為0.984,較初始量0.285提高了3.45倍。同時,模型所得到的最大預測值與驗證值非常接近,說明回歸方程能較真實地反映各篩選因素的影響。在產量優化的基礎上,對色素的色譜分析,純化鑒定及色素的性質將在進一步的研究和后續文章中討論。
實驗證明,Plackett Burman設計與 Box-Benhnken Design設計相結合的試驗統計方法能快速、有效地從眾多影響色素液體發酵的因素中篩選出比較重要的影響因素并實現優化,得到最佳培養基成分,優化結果與實際發酵情況吻合較好。
[1]SWAMY G J,SANGAMITHRA A,CHANDRASEKAR V.Response surface modeling and process optimization of aqueous extraction of natural pigments from Beta vulgaris using Box-Behnken design of experiments[J].Dyes and Pigments,2014,111:64-74.
[2]MARAN J P,PRITA B,NIVETHA C V.Optimization of ultrasound-assisted extraction of natural pigments from Bougainvillea glabra flowers[J].Industrial Crops and Products,2015,63:182-189.
[3]CHIDAMBARAM K V,ZAINUL A Z,WAN A A.Bacterial pigments and their applications[J].Process Biochemistry,2013,48:1065-1079.
[4]NADIM C S,ZUMBUEHL S,DELAVY F,et al.Synthetic organic pigments of the 20th and 21st century relevant to artist's paints:Raman spectra reference collection[J].Spectrochimica Acta Part A,2009,73:505-524.
[5]SHEN Guoqiang,YANG Chunxia,ZHANG Dong.Research and development of nature colorant(Dyestuff)[J].Dyestuffs and Coloration,2009,46(1):7-10.(in Chinese)
[6]SAMEER AS-Mapari,ULF T,MEYER A S.Fungal polyketide azaphilone pigments as future natural food colorants?[J].Trends in Biotechnology,2010,28:300-307.
[7]PALANIVEL V,SERALATHAN K K,VELLINGIRI B,et al.Natural pigment extraction from five filamentous fungi for industrial applications and dyeing of leather[J].Carbohydrate Polymers,2010,79:262-268.
[8]NUTHATHAI S,MIREILLE F,ALAIN V,et al.Bacteria belonging to the extremely versatile genus Arthrobacter as novel source of natural pigments with extended hue range[J].Food Research International,2014,65:156-162.
[9]SELVAKUMAR D,ASHOKKUMAR B,DHEVENDARAN K.Food-grade pigments from Streptomyces sp isolated from the marine sponge Callyspongia diffusa[J].Food Research International,2009,42:487-492.
[10]VIMAL S P,NIDHI S,UJJVAL B T,et al.An enhancement of red pigment production by submerged culture of Monascus purpureus MTCC 410 employing statistical methodology[J].Biocatalysis and Agricultural Biotechnology,2014,3:140-145.
[11]WANG H S,JIANG P X,LU Y,et al.Optimization of culture conditions for violacein production by a new strain of Duganella sp. B2[J].Biochemical Engineering Journal,2009,44:119-124.
[12]CLAIRA A A,CHIDAMBARAN K V,ZAINUL A Z,et al.Brown sugar as a low-cost medium for the production of prodigiosin by locally isolated Serratia marcescens UTM1[J].International Biodeterioration&Biodegradation,2014,95:19-24.
[13]何磊.產蝦青素海洋酵母菌YS-185的鑒定,發酵優化及保藏穩定性的研究[D].上海:上海海洋大學食品科學與工程學院,2011.
[14]WANG Xiaolei,XIE Yifang,TANG Wei,et al.Separation and identification of marine bacterium SS04 and optimization of fermentation condition for intracellular red pigment produced by SS04[J].China Brewing,2013,32(4):95-99.(in Chinese)
[15]CHEN Feifei,WANG Yong,WANG Yiguang,et al.Advance in research and development of natural products from marine microorganisms[J].Chinese Journal of Applied and Environmental Biology,2011,17(2):287-294.(in Chinese)
[16]MOSTAFA E R,RAINER E.Secondary metabolites of fungi from marine habitats[J].Nat Prod Rep,2011,28:290-344.
[17]DAVID M P,PATRICIA V,PAULA B,et al.Marine natural pigments:Chemistry,distribution and analysis[J].Dyes and Pigments,2014,111:124-134.
[18]RATIH P,Se-Kwon K.Biological activities and health benefit effects of natural pigments derived from marine algae[J].Journal of Functional Foods,2011,3:255-266.
[19]XIE Fengxia,QIU Zumin,TU Shenghui,et al.Comparison between ethanol and ultrasonic extraction method used in extraction of gardenia yellow[J].Journal of Nanchang University(Natural Science),2005,29(3):278-281.(in Chinese)
[20]劉振學.實驗設計與數據處理[M].北京:化學工業出版社,2005.
[21]湯海青.用海洋細菌Pseudoalteromonas tetrodonis QZ-4發酵生產褐藻膠裂解酶的研究[D].浙江:浙江大學生物系統工程與食品科學學院,2010.
Optimization of Fermentation Medium for the Production of Pigments by Marine Bacteria Planococcus rifietoensis
KONG Fei1,2,3, CAI Yujie*2, XU Chen3, XU Jianzhong3, XIA Jinmei3
(1.SchoolofBiotechnology,Jiangnan University,Wuxi214122,China;2.Key Laboratory ofIndustrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;3.Key Laboratory of Marine Biogenetic Resources,Third Institute of Oceanography,State Oceanic Administration,Xiamen 361005,China)
Based on monofactorial experiments,Plackett-Burman(PB)design and response surface methodology(RSM)were applied to optimize 8 medium components for the production of pigments by marine bacteria strain Planococcus rifietoensis.Results showed that optimal carbon and nitrogen sources of the medium were glucose and peptone,respectively,and glucose,yeast extract and MgSO4·7H2O had major effects on the production of pigments.The optimal culture medium was comprised of glucose 9.78 g/L,peptone 8.00 g/L,yeast extract 2.05 g/L,MgSO4·7H2O 8.17 g/L,Na2HPO40.1 g/L,FeSO4·7H2O 0.005 g/L,NaCl 10 g/L and CaCl20.1 g/L.The incubation time was 54 hours.Under these conditions,the optical density(OD)of pigments reached to 0.984,which was245%higher than that before optimization.
marine bacteria,response surface optimization,pigment
Q 815
A
1673—1689(2017)02—0179—08
2015-04-08
中央級公益性科研院所基本科研業務費專項資金資助項目(海三科2015027)。
*通信作者:蔡宇杰(1973—),男,江蘇無錫人,工學博士,教授,碩士研究生導師,主要從事生物工程方面的研究。
E-mail:yjcai@jiangnan.edu.cn
孔菲,蔡宇杰,許晨,等.海洋細菌Planococcus rifietoensis發酵產色素培養基的優化[J].食品與生物技術學報,2017,36(02):179-186.

