兩種不同豬瘟疫苗的免疫效果比較分析
梁亮
摘要:試驗隨機選取24頭30日齡(體重范圍為7.5~9.0 kg)健康仔豬,16頭健康后備母豬。24頭小豬隨機分成兩組,每組12頭;16頭母豬隨機分成兩組,每組8頭;各分為試驗1組和試驗2組。其中仔豬和母豬的試驗1組接種豬瘟疫苗A,試驗2組接種豬瘟疫苗B。疫苗在0 d進行首免,30 d進行二免。每頭接種2 mL。仔豬試驗1組和試驗2組在首免后第15、30、60天各采血,分離血清,檢測豬瘟抗體阻斷率。母豬試驗1組和試驗2組在首免后第30、60天分別采血,分離血清,檢測豬瘟抗體阻斷率。結果表明,不管仔豬還是母豬,接種的兩種豬瘟疫苗A和B的免疫效果差異不顯著(P>0.05),且從總體上來看,兩種豬瘟疫苗免疫60 d后都能使仔豬和后備母豬獲得良好的保護力。
關鍵詞:豬瘟疫苗;抗體阻斷率;免疫效果
中圖分類號:S858.28 文獻標識碼:A 文章編號:1007-273X(2017)01-0011-02
豬瘟(HC)俗稱“爛腸瘟”,是由豬瘟病毒(HCV)引起的一種急性、熱性、高度接觸性的病毒性傳染病,是威脅養豬業的主要傳染病。其特征是發病急,高熱稽留,小血管壁變性,全身泛發性小點狀出血及脾梗死。該病在自然條件下只感染豬,不同年齡、性別、品種的豬和野豬都易感,一年四季均可發生。
由于豬瘟病毒的高致病力和高致死率,給養殖業造成了巨大的損失。豬感染高致病力毒株后在潛伏期就可以造成傳染,經歷急性豬瘟或亞急性豬瘟的豬在出現癥狀前大量排毒,但耐過后的豬只體內有明顯的豬瘟抗體,且不再排毒。感染溫和性毒株的豬呈慢性感染,在病死前會長期或間歇性地排毒。懷孕母豬可以通過胎盤感染胎兒導致流產、木乃伊胎或產出弱胎、畸形胎等。先天性感染低毒力病毒的結果是產出持續性感染的仔豬,仔豬出現免疫耐受,不表現任何癥狀而向外排毒。
在預防過程中,疫苗的效價高低是免疫成敗的關鍵。低效價的疫苗免疫后豬體產生的抗體不足以抵抗野毒的侵襲,接種豬雖不發病,但終生帶毒、排毒,這給凈化豬群造成極大障礙。因此許多豬場在實際防疫工作中都采用加大免疫劑量來解決這一不足,但疫苗種類的選擇也與豬瘟免疫效果密切相關[1-6]。本試驗采用兩種豬瘟疫苗分別對仔豬和母豬進行免疫,并使用豬瘟病毒抗體檢測試劑盒來檢測豬血清或血漿中豬瘟病毒抗體對病毒的阻斷率,通過試驗結果分析哪種疫苗免疫效果更佳,以便為今后豬瘟疫苗的選擇提供參考。
豬瘟病毒抗體ELISA檢測試劑盒是用來檢測豬血清或血漿中豬瘟病毒抗體的檢測試劑盒。該試劑盒是用豬瘟病毒抗原包被的微量反應板,利用阻斷ELISA原理來檢測豬血清或血漿中豬瘟病毒抗體。如果被檢樣品中存在豬瘟病毒抗體,它們就會阻斷辣根過氧化物標記的抗豬瘟病毒的單克隆抗體。單克隆抗體與豬瘟病毒抗原的結合可以通過辣根過氧化物酶與底物的顯色程度進行判定,即用酶標儀在單波長450 nm或雙波長650 nm測定該反應體系的吸光度。當被檢樣品中含有豬瘟病毒抗體(陽性結果)時,顯色就會變淺,當被檢樣品中不含有抗豬瘟病毒抗體(陰性結果)時,顯色就會變深。樣本的阻斷率可以通過450 nm波長樣本吸光度與陰性對照吸光度的比值來確定。
1 材料與方法
1.1 試驗動物
福州長樂羅豐豬場隨機選取24頭30日齡(體重范圍為7.5~9.0 kg)的健康仔豬及16頭健康后備母豬。
1.2 血清采集
仔豬用前腔靜脈采血法、母豬用耳靜脈采血方法,析出血清,在4 ℃下保存。
1.3 主要試劑
豬瘟病毒抗原包被的ELISA反應板、陽性對照血清、陰性對照血清、辣根過氧化物標記的抗豬瘟病毒的酶標抗體、樣品稀釋液(洗滌液10X、TMB底物、終止液)。
1.4 器材
微量移液器,10~1 000 μL的精密或多道微量移液器,一次性移液器吸頭,量筒(500 mL,配制洗滌液用),96孔酶標儀,純化水(去離子水或雙蒸水),滴加和吸去洗滌液的設備,可以盛裝液體和消毒液的容器,濕盒或密封反應板用的封條,渦旋混合裝置,離心管或微量試管。
1.5 試驗方法
仔豬和后備母豬的試驗1組均接種豬瘟疫苗A,試驗2組均接種豬瘟疫苗B。疫苗在0 d進行首免,30 d進行二免。每頭接種2 mL。仔豬試驗1組和試驗2組在首免后第15、30、60天分別采血,分離血清,檢測豬瘟抗體阻斷率。母豬試驗1組和試驗2組在首免后第30、60天采血,分離血清,檢測豬瘟抗體阻斷率。檢測用的豬瘟病毒抗體ELISA檢測試劑盒的使用和操作均嚴格按照說明書進行。
1.6 統計方法
試驗數據采用SPSS統計分析軟件作統計分析,結果以“平均數±標準差”表示。
2 結果與分析
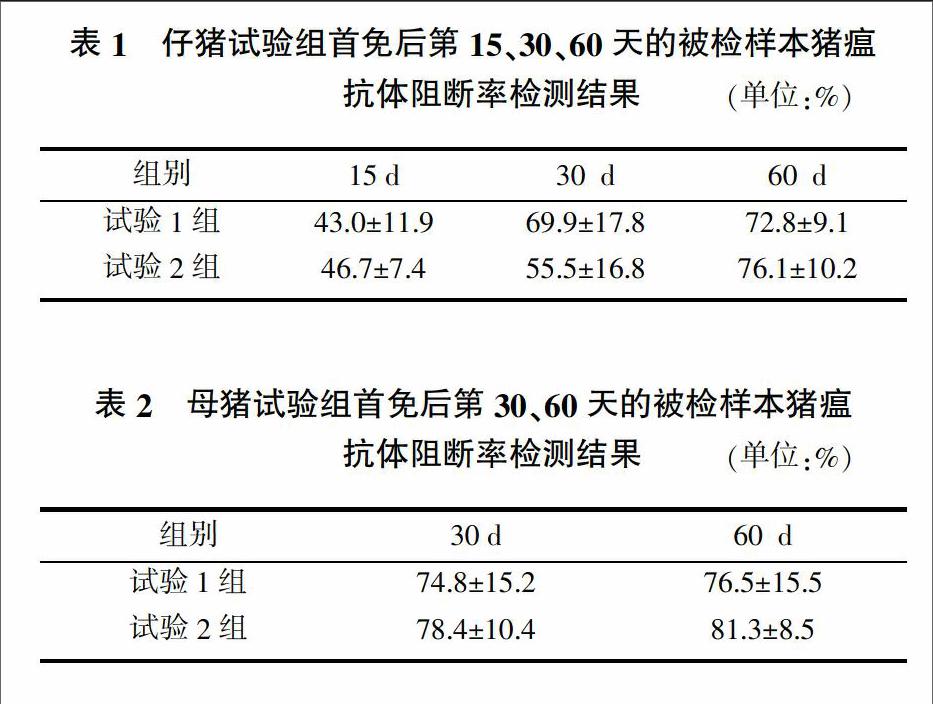
由表1和表2可知,無論是仔豬還是后備母豬,試驗1組(豬瘟疫苗A)的免疫效果均略高于試驗2組(豬瘟疫苗B)。注射豬瘟疫苗A的仔豬的被檢樣本豬瘟抗體阻斷率從43.0%上升至72.8%,而后備母豬被檢樣本豬瘟抗體阻斷率從74.8%上升至76.5%;注射豬瘟疫苗B的仔豬的被檢樣本豬瘟抗體阻斷率從46.7%上升至76.1%,而后備母豬被檢樣本豬瘟抗體阻斷率從78.4%上升至81.3%。統計分析表明,不管仔豬還是母豬,接種的兩種豬瘟疫苗A和B的免疫效果差異不顯著(P>0.05),且從總體上來看兩種豬瘟疫苗免疫60 d后都能使仔豬和母豬獲得良好的保護力。
3 小結與討論
在本試驗中,注射豬瘟疫苗A的仔豬的被檢樣本豬瘟抗體阻斷率從43.0%上升至72.8%,而后備母豬被檢樣本豬瘟抗體阻斷率從74.8%上升至76.5%;注射豬瘟疫苗B的仔豬的被檢樣本豬瘟抗體阻斷率從46.7%上升至76.1%,而后備母豬被檢樣本豬瘟抗體阻斷率從78.4%上升至81.3%,表明疫苗A或B對母豬的免疫效果的提高并不顯著,分析其原因可能有以下幾點。
(1)疫苗的質量方面。在實際應用中,疫苗從藥廠冷庫發出直至注射到豬體內,要經過一個運輸轉運過程。由于中間環節多、情況復雜、溫度變化無常、疫苗時融時凍,其質量無法保障。
要提高實際應用中疫苗的質量,必須加強運輸系統的冷藏設施建設,從藥廠到縣級站用冷藏車運輸;從縣級到基層保證配備冷藏保溫箱,加強對生物藥品的管理,沒有冷藏設施的一律不準經營疫苗,避免疫苗出廠后時凍時融的狀況出現。同時在縣級動物防檢機構內要設立疫(菌)苗檢測室,定期檢測或對每批疫苗進行效價測定,以確定免疫注射的劑量。
(2)母豬的體質方面。后備母豬的免疫機制較仔豬更加完善和健全,對抗不同程度的豬瘟病毒的抵抗力更強。試驗所用的豬瘟疫苗A和B有可能對弱體質的仔豬有較強的免疫效果。
(3)操作規程的規范問題。在實際注射操作中,要特別注意部位、針頭、劑量和消毒等四個問題。①注射部位。在防疫注射中,防疫人員一般僅注意豬體部位,但更重要的是解剖部位,要把疫苗注射到肌間。因此要把握好注射角度和深度,針頭應與豬體成60°為宜,深度應根據豬體大小和肥瘦程度而定,要以達到肌肉深部為佳。②針頭的問題。不僅要重視一豬一針,也要重視針頭長度和粗細,要因豬而異。③注射劑量。一般在注射器上固定,注射時劑量一定要足。④消毒。注射部位消毒宜用2.0%~3.0%的碘酊,4.0%以上碘酊容易使疫苗失去活性。針頭要做到一豬一針一消毒[7-9]。
參考文獻:
[1] 蔣冬福,施萬球,韋家槐,等.兔脾淋組織液對豬瘟疫苗的免疫增強試驗[J]中國獸醫雜志,2001,37(7):10-11.
[2] 呂仁洪,滕 遠.豬瘟免疫效果不佳的原因探討[J]養豬業,2005(3):37-38.
[3] 王 琴,寧宜寶.豬瘟免疫失敗主要原因的解析[J]中國獸醫雜志,2005(6):61-62.
[4] 王紅寧,劉世貴,吳 琦.規模化豬場豬瘟仿制中應注意的問題[J]中國獸醫雜志,1999,25(12):20-21.
[5] 韓雪清,劉湘濤,趙啟祖.豬瘟病毒及其豬瘟疫苗研究進展[J].動物醫學進展,2000,21(2):1-7.
[6] 李連任.當前我國豬瘟免疫失敗的原因及對策[J].當代畜牧,2005(2):14-16.
[7] 汪令波.提高豬瘟疫苗免疫效果的措施[J].現代農業科技,2006(8):14.
[8] 范玉芳.甘肅省酒泉市規模豬場豬瘟疫苗免疫抗體檢測及效果分析[J].中國動物檢疫,2007,24(8):38.
[9] 韓紅秀,寧 國,張志宏.淺談豬瘟免疫失敗的原因與對策[J].豬與禽,2007,27(4):68.

