SD大鼠骨髓間充質干細胞原代培養條件的選擇
李倩曉 那榮妹 劉百亭 于 勤
(杭州市紅十字會醫院,浙江 杭州 310000)
SD大鼠骨髓間充質干細胞原代培養條件的選擇
李倩曉 那榮妹1劉百亭1于 勤1
(杭州市紅十字會醫院,浙江 杭州 310000)
目的 探討分離及培養SD大鼠骨髓間充質干細胞(BMSCs)的最佳條件。方法 選取不同周齡(2、3、4、8 w)的SD大鼠;采用全骨髓貼壁篩選法對不同的培養基(L-DMEM、DMEM/F12),血清體積分數(7.5%、10%、12.5%、15%、17.5%),首次換液時間(48、72、96 h),換液方法(全換液、半換液)分組進行培養,每日于倒置顯微鏡下觀察細胞形態、數目的變化,細胞融合80%~90%時進行消化計數,記錄達到傳代要求的時間,取第三代細胞繪制BMSCs生長曲線,各組間免疫熒光檢測CD34、CD44的表達率。結果 ①第2~3周SD大鼠達到傳代要求時BMSCs數目最多、所需時間最短,第8周BMSCs含量明顯減少,難以形成集落生長,細胞融合不到50%;DMEM/F12培養基中的細胞貼壁早、活性強,L-DMEM培養基中的細胞生長緩慢,兩組相比差異顯著(P<0.05);72 h全換液和48 h半換液組細胞數目多,二者相比無統計學意義(P>0.05),24 h全換液細胞數目少,72 h半換液雜細胞多,細胞呈全分布,二者增值速度慢,與前者相比差異顯著(P<0.05);體積分數越高細胞生長分化越快,時間越短,但各組間比較無統計學意義(P>0.05),傳代培養中高體積分數的細胞易老化。②接種圓形BMSC培養6 h后貼壁,分化成圓形、類圓形或多角形;72 h后有少量短梭形、星形細胞分散、貼壁生長,部分細胞伸出一支或多支偽足,類似于成纖維細胞;約6 d后BMSCs細胞集落呈放射狀排列,伸出長短及粗細均不規則,伴形態各異的偽足、細胞胞核大、核仁清晰;約10 d細胞能融合80%~90%培養面;傳代后24 h內可見細胞已完全貼壁,3 d可見以梭形為主的細胞鋪滿80%~90%培養面;經過1~2次傳代后,細胞呈放射狀或平行排列,形態趨于一致。③傳代2 d后,細胞緩慢生長,處于生長停滯期;3 d起細胞轉入對數生長期,4~5 d至高峰后轉入平臺期,細胞倍增時間約39.5 h。④傳代BMSc存在CD44抗原表達,陽性率98.3%,而CD34呈陰性表達。結論 全骨髓貼壁篩選法是一種獲得高純度BMSCs簡單、有效的方法;在適宜的培養條件下(SD大鼠育齡為2~3 w,接種密度80%~90%培養面,培養基為DMEM/F12,合適血清體積分數為10%,72 h首次全換液)BMSCs在體外生長狀態良好,增殖速度快,DAPI可作為標記BMSCs的一種有效手段,也可作為細胞免疫組化的基礎染色。
骨髓間充質干細胞;原代培養
骨髓間充質干細胞(BMSCs)是一種骨髓基質內分布的經中胚層細胞分化而來的細胞亞群,其來源廣泛,有多種分化潛能和低免疫原性,可分離及體外擴增為各類骨骼、組織、器官細胞及造血干細胞等的基質細胞〔1〕,是組織工程首選種子細胞〔2〕。現今,BMSCs體外擴增和純化趨于成熟,培養條件參差不齊,缺乏統一的標準,本實驗旨在比較各種培養條件,初步確定BMSCs體外培養的標準,對其體外培養過程中注意事項加以說明。
1 材料和方法
1.1 材料 2、3、4、8周齡清潔級SD大鼠。主要試劑:L-DMEM 、DMEM /F12、胰蛋白酶、雙抗(美國 Thermo 公司),DAPI(美國Sigma 公司),胎牛血清(天津TBD公司),兔抗大鼠CD44、CD34抗體,FITC標記的山羊抗兔抗體(北京博奧森生物技術有限公司)、四甲基偶氮唑鹽。主要儀器:CO2培養箱(北京安捷來科學儀器設備有限公司),超凈工作臺(蘇州蘇潔凈化設備有限公司),醫用離心機(長沙湘銳離心機有限公司TDZ5-BP),激光共聚焦顯微鏡(COIC XDS-1B) ,移液槍(Dragon DX20284、DP31238),試管、吸管、培養瓶25 cm3(美國Corning),儲物柜(洛陽市宇龍辦公機具有限公司),冰箱(Hisense)。
1.2 實驗方法
1.2.1 大鼠BMSCs分離和培養 大鼠斷頸處死后置于碘伏內泡3~5 min,取出75%乙醇脫碘。無菌條件下用生理鹽水沖洗干凈,剝離、脫下雙下肢皮膚,取下雙下肢后用生理鹽水沖洗,將股骨、脛骨剝離和干骺端剪除,用5 ml注射器吸、注磷酸鹽緩沖液(PBS)沖洗骨髓腔5~10次,收集沖洗液于培養皿內后吹打混勻,1 200 r/min離心 5 min,棄上清液。根據各組要求制備細胞懸液,置于高倍鏡下調整細胞濃度,至細胞鋪滿目鏡視野80%~90%止,液體裝瓶(4 ml/瓶)后接種于25 cm3培養瓶內,置于37℃、5%CO2下培養。根據不同培養基、血清體積分數、首次換液時間、換液方法分組接種培養。半換液后24 h全換液,首次換液后每隔3 d換液一次,細胞鋪滿80%~90%培養面時消化傳代,記錄原代培養時間及細胞數目。
1.2.2 細胞分組 按照培養基、血清體積分數、首次換液時間、首次換液方法分為4組,每組兩瓶細胞。(1)不同培養基:采取全骨髓貼壁法,以細胞鋪滿培養面80%~90%密度進行接種,分別使用10% FBS-DMEM/F12培養基、10%FBS-L-DMEM培養基進行貼壁培養,首次換液時間為72 h并采取全換液,以后每隔3 d換液一次。(2)不同血清體積分數:采取全骨髓貼壁法,以細胞鋪滿培養面80%~90%密度進行接種,分別在血清體積分數為7.5%、10%、12.5%、15%的DMEM/F12培養基中貼壁培養,首次換液時間為72 h并采取全換液,以后每隔3 d換液一次。(3)不同換液方法:采取全骨髓貼壁法,以細胞鋪滿培養面80%~90%密度進行接種,10%FBS-DMEM/F12培養基中貼壁培養,首次換液時間為72 h,分別行全換液、半換液,以后每隔3 d換液一次。(4)不同換液時間:采取全骨髓貼壁法,以細胞鋪滿培養面80%~90%密度進行接種,10%FBS-DMEM/F12培養基中貼壁培養,分別于48、60、72 h進行全換液,以后每隔3 d換液一次。
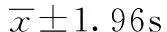
1.2.4 細胞原代培養時間計算及傳代方法 記錄各組達到80%~90%融合時的原代培養時間并進行消化,懸浮細胞后按1∶2比例傳代。
1.2.5 大鼠BMSCs形態學觀察 原代及傳代BMSCs置于倒置顯微鏡下,400倍觀察細胞形態結構。
1.2.6 傳代BMSCs生長曲線繪制并計算細胞倍增時間 取培養至3代、生長良好的細胞消化,調整細胞濃度至5×103個/ml接種于96孔板(200 μl/孔),5%CO2、100%濕度和37℃培養24 h。每天固定時間取3孔滴入5 μg/μl MTT 液20 μl,37℃孵育4 h后去孔內培養液,每孔滴入150 μl二甲基亞砜(DMSO)振蕩均勻至結晶物完全顯色,用京德鐵HBS-1096A 酶標儀(南京德鐵實驗設備有限公司)測定細胞570 nm處測吸光度(A570)值,取3次平均值代表細胞相對數量,并以橫坐標=時間(d),縱坐標=OD值(細胞相對數量)繪制生長曲線。細胞倍增時間(TD)=t×log 2/(log Nt-log N0)。t:培養時間,N0:接種后細胞數,Nt:培養t h后細胞數。
1.2.7 傳代BMSCs的DIPA標記及免疫組化鑒定 取培養至3代、生長良好的細胞消化,調整細胞濃度至1×105/ml,接種至預先放置無菌蓋玻片6孔板內,培養4~5 d,待蓋玻片80%~90%表面被細胞鋪滿后,PBS沖洗3次,10 min/次,室溫下滴入4%多聚甲醛40 g/L固定30 min,PBS沖洗,滴入0.2%TritonX-100 2 ml/L通透細胞,37℃下封閉30 min,滴加一抗(兔抗大鼠CD44及CD34單克隆抗體,稀釋濃度1∶100),37℃下孵育2 h,PBS沖洗3次,10 min/次,滴加二抗(RBITC標記山羊抗兔IgG,稀釋濃度1∶100),37℃孵育1 h,PBS沖洗3次,10 min/次,將無菌DAPI儲存液滴入MSCs上清液中調整終濃度至50 mg/L,37℃、5%CO2孵育2 h后封片,置于熒光顯微鏡下觀察、拍照。陽性細胞:胞體呈紅色熒光、細胞核呈藍色熒光;陰性細胞:胞體和胞核呈藍色熒光。隨機選取10組視野計算陽性率,每組取3次計數平均值,10組平均值為MSCs純度。
1.2.8 觀察不同培養條件對BMSCs生長的影響 倒置顯微鏡下觀察和記錄各組原代及傳代BMSCs形態變化、細胞達到傳代時間,計算細胞總數。四甲基偶氮唑鹽比色法(MTT法)繪制細胞生長曲線,計算細胞倍增時間;免疫組織化學法測定BMSCs CD44、CD34表達。
1.3 統計學方法 組間比較采用t檢驗。
2 結 果
2.1 大鼠BMSCs原代培養形態學觀察 剛接種細胞形態學主要表現為大小不等的圓形及橢圓形,密集懸浮于培養液內,折光性較強;培養6~8 h后貼壁,呈紡錘狀或類圓形,24 h后少量細胞貼壁生長,細胞呈紡錘形、三角形、多邊形或不規則形等多種形態,72 h內細胞基本完成貼壁,長梭形或紡錘形細胞明顯增多,但是仍以三角形、多角形為主,未貼壁細胞仍懸浮于培養液內;3 d后全換液,棄去懸浮的未貼壁細胞。隨后貼壁細胞開始分裂增殖,6~8 d后可見貼壁細胞數量明顯增加,細胞形態主要為長梭形或紡錘形,部分為短梭形或三角形,呈集落樣增殖。其后集落逐漸增大鋪開,9~11 d后貼壁細胞可基本鋪滿培養瓶底,見圖1~3。傳代后接種12 h后,絕大部分細胞貼壁、生長迅速,形態學表現為梭形,24 h后100%貼壁,4~5 d即可鋪滿瓶底,細胞為細長梭形呈漩渦狀或魚群樣排列。傳代1~2次后,細胞表現為單一梭形成纖維樣,放射狀或平行排列。傳至P3代后,顯微鏡下可見極少量雜質細胞,連續傳數代細胞形態類似傳代細胞。見圖1。
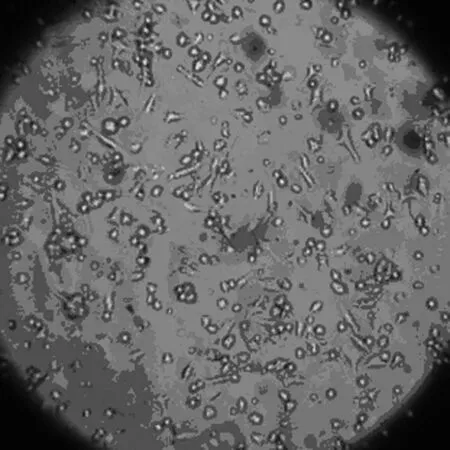
原代培養第3天
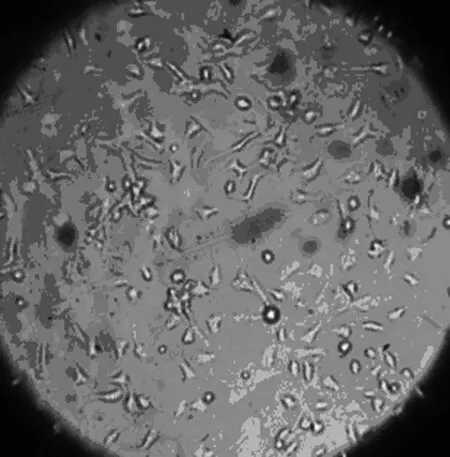
原代培養第6天
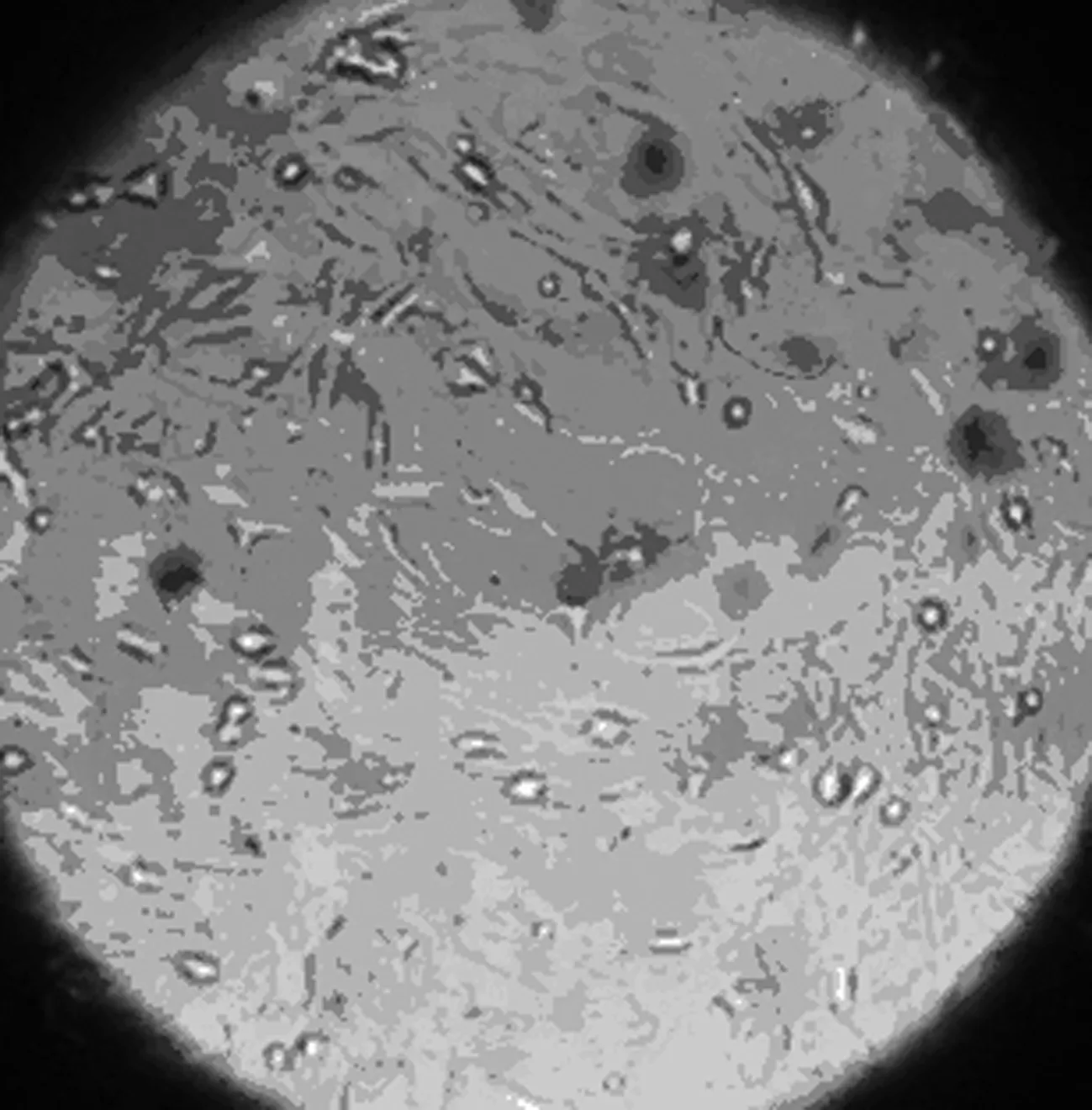
原代培養第9天
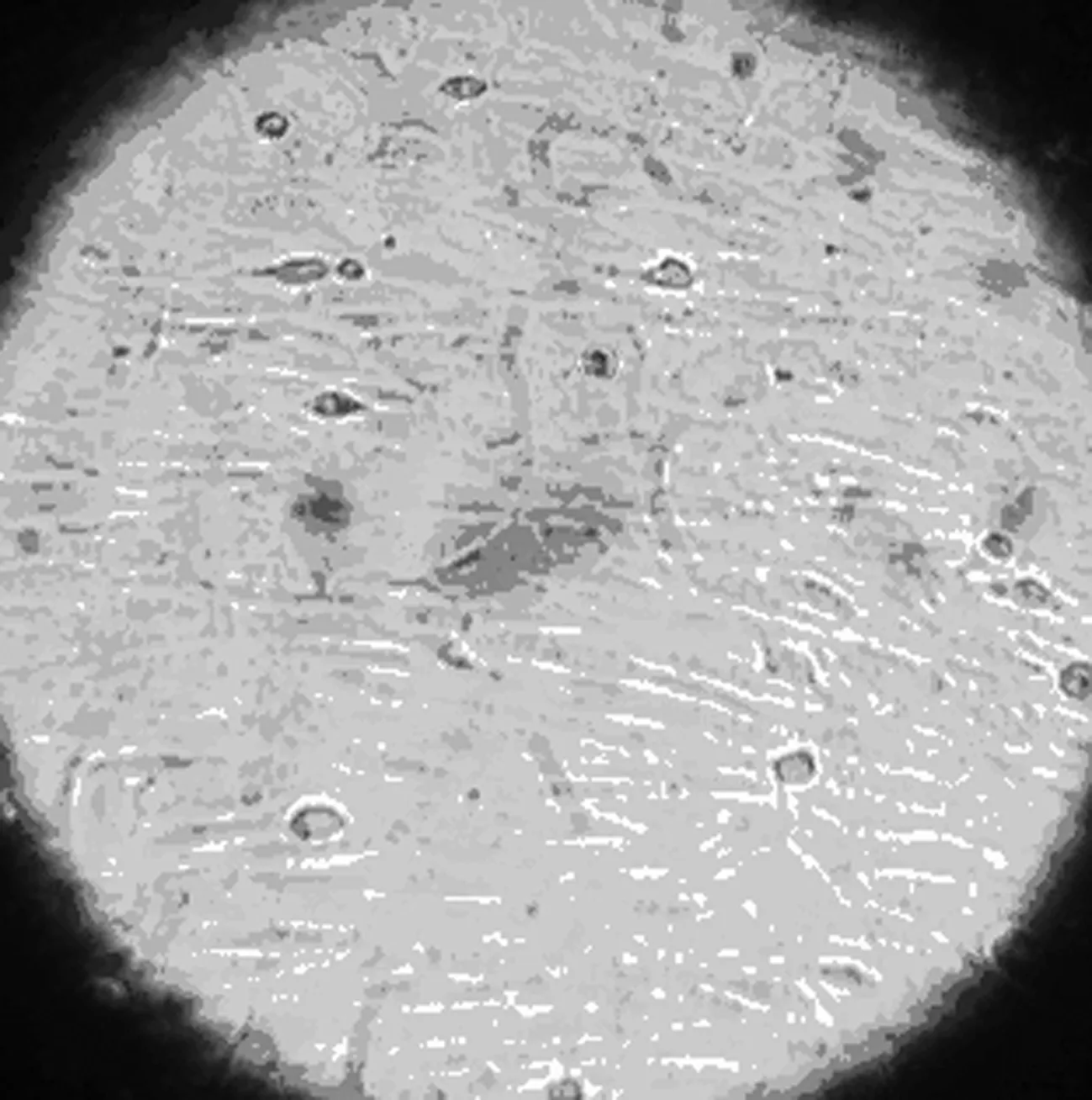
傳代后第5天 圖1 大鼠BMSCs原代培養形態學觀察(×200)
2.2 不同培養條件對BMSCs生長的影響 (1)不同培養基:細胞在DMEM/F12中培養增殖速度快,細胞分化快,達到傳代培養時間短,高倍視野下細胞數(412.54±12.72),細胞80%~90%融合時間為11 d;在L-DDMEM中培養細胞數為(340.27±14.31),融合時間13,組間相比差異有統計學意義(P<0.05)。(2)不同血清體積分數:10%~15%血清濃度各組間相比細胞數目相似(10%:412.54±12.72,12.5%:420.54±13.34,15%:462.00±7.82),細胞增殖快(融合時間分別為11 d、11 d、10 d),組間比較無統計學意義(P>0.05),但與7.5%血清濃度比較(287.78±10.22;15 d)差異顯著(P<0.05)。(3)不同換液時間及方法:48 h全換液難以達到細胞80%~90%融合的要求,細胞總數為124.62±4.23;48 h半換液及72 h全換液細胞達到傳代時間最短(均11 d),細胞總數多(390.85±12.67,412.54±12.72),組間相比無統計學意義(P>0.05);72 h半換液與其相比細胞數目少(324.52±6.45),融合時間長(13 d)(P<0.05)。
2.3 傳代BMSCs生長曲線測定 傳代細胞開始1~2 d細胞生長緩慢,處于生長潛伏期;3~5 d為細胞生長快速至對數增長期;6 d后增殖平緩期;8 d達平臺期,計算細胞倍增時間為39.5 h。
2.4 傳代BMSCs的免疫鑒定 染色后全部BMSCs細胞核呈藍色熒光,>90%胞體呈紅色熒光。經CD34抗體和DAPI染色后熒光顯微鏡下見所有BMSCs細胞核均被標記藍色熒光,細胞膜無熒光顯示。表明傳代的細胞CD44抗原呈陽性表達CD34抗原呈陰性表達。
3 討 論
在骨髓中BMSCs的含量較低,與骨髓單核細胞比大約為1∶100 000,數量隨年齡增長不斷減少〔3〕,其體外易培養、大量增殖并可誘導分化為成骨細胞、成軟骨細胞、脂肪細胞和成肌細胞等,具有多分化的潛能,而且避免了胚胎干細胞應用的倫理學爭議。目前BMSCs體外培養條件各異,缺乏統一的標準,不同的培養方法、培養基種類、種植密度、血清體積分數等均能影響到BMSCs的體外生長,因此只有尋找到最適培養條件,才有利于獲取更高質量的BMSCs。
分離純化BMSCs的方法主要包括全骨髓貼壁培養法、密度梯度離心法、流式細胞儀分離法和免疫磁珠法。流式細胞技術和免疫磁珠法可致較高的細胞丟失量,操作復雜、費用較高〔4〕,因此全骨髓貼壁培養法和密度梯度離心法應用范圍較廣。全骨髓貼壁法分離培養法具有操作快速、效果可靠、簡便穩定等優點,相比之下更優于密度梯度離心法〔5〕。骨髓內BMSCs較其他細胞更易貼壁,這是因為造血干細胞可釋放生長因子及相關促貼壁介質,引導BMSCs貼壁生長〔6〕,因此利用骨髓貼壁培養法培養的細胞貼壁快,72 h內基本上完全貼壁,獲得的細胞活性好、增殖力較強。雖然初始獲取的BMSCs純度較低,雜質細胞含量多,但是通過反復的換液和傳代的方法可以除去雜質細胞并逐步純化BMSCs,第三代BMSCs純度可以接近100%。
L-DMEM和DMEM/F12是BMSCs培養的常用培養基,二者均能促進BMSCs的生長和增殖,原代培養過程中DMEM/F12培養基中細胞增殖速度快,細胞總數明顯大于L-DMEM培養基(P<0.05);L-DMEM培養基中細胞貼壁亦較好,但是細胞活性差,顆粒含量重,諸如換液、胰酶消化等外界環境的輕微變化即可引起細胞的死亡。原因可能與DMEM/F12中營養成分相關,DMEM/F12是DMEM和F12的1∶1混合制劑,具有F12含有較豐富的成分和DMEM含有較高濃度的營養成分的雙重優勢,同時含有鐵、銅、鈣等金屬離子及HEPES緩沖成分,更適宜BMSCs的體外培養。采用全骨髓貼壁培養法培養細胞,細胞懸浮液中含紅血細胞、白細胞、脂肪細胞、造血干細胞等多種細胞成分,細胞形態、大小各異,顯微鏡下難以計數,選取2~3 w SD大鼠雙側股骨及脛骨骨髓制成細胞懸液后接種3瓶25 cm3,以高倍鏡細胞體滿80%~90%培養面為宜,如接種2瓶則可見細胞全部鋪滿培養面,部分細胞相互重疊,接種密度過大;如接種4瓶,細胞總數少。換液后二者貼壁細胞數目明顯少于前者,其原因可能是細胞接種密度過大,大量細胞貼壁,包括非BMSCs,營養大量消耗的同時細胞之間存在相互競爭,抑制周圍細胞的增殖;但是如果接種密度過低,細胞本身數目少,造血干細胞分泌的生長因子和促貼壁物質不足,BMSCs之間缺乏相互刺激,難以形成集落生長。不同體積分數培養結果的原因可能是高濃度的血清營養含量大,更能促進細胞增殖和貼壁生長,但是過高的胎牛血清濃度也能促進細胞過早分化〔7〕,因此10%血清濃度的培養基在節約成本本的同時既能滿足細胞正常的生長繁殖又能連續傳代。原代培養首次換液時間對BMSCs生長增殖一定影響〔8〕,而首次換液時采用半量換液的方法,有助于保留部分貼壁不緊密的細胞〔9〕,本研究說明BMSCs在24 h時仍有部分未貼壁,在72 h時已貼壁完全。
現今,研究尚未確定統一的BMSCs特異性抗原表型〔10〕,但是其表面分子內存在間質、內皮、上皮和肌肉細胞特征〔11〕,而且體外擴增的BMSCs不表達造血細胞的CD34、CD45 或CD14 等分子〔12〕,常規間接鑒定BMSCs以排除法為準。同時本實驗培養得到的BMSCs對塑料器皿具有貼附特性;免疫組化結果表明本研究分離培養大鼠骨髓細胞分化為骨髓BMSCs。
綜合上述,BMSCs傳至P3代時雜質細胞基本消失,細胞形態呈均勻分布、單一、梭形成纖維樣細胞。
1 Pavon LF,Sibov TT,de Oliveira DM,etal.Mesenchymal stem cell-like properties of CD133+ glioblastomainitiating cells〔J〕.Oncotarget,2016;7(26):40546-57.
2 Gu W,Hong X,Potter C,etal.Mesenchymal stem cells and vascular regeneration〔J〕.Microcirculation,2017;24(1):1-15.
3 Zhang K,Ikeda Y,Kasugai S,etal.Extended culture conditions for multipotent bone marrow-derived mesenchymal stem cells〔J〕.Kokubyo Gakkai Zasshi,2016;83(1):13-24.
4 陳祁青,金紅婷,應 俊,等.右歸飲含藥血清對骨髓間充質干細胞成軟骨分化的促進作用及其microRNA表達譜分析〔J〕.中華中醫藥雜志,2015;30(5):1380-6.
5 傅淑平,楊 麗,洪 浩,等.梓醇促進大鼠骨髓間充質干細胞增殖過程中Wnt信號通路的變化〔J〕.中國病理生理雜志,2014;30(9):1656-60.
6 Pashoutan Sarvar D,Shamsasenjan K,Akbarzadehlaleh P.Mesenchymal stem cell-derived exosomes:new opportunity in cell-free therapy〔J〕.Adv Pharm Bull,2016;6(3):293-9.
7 Mizuno M,Katano H,Otabe K,etal.Platelet-derived growth factor(PDGF)-AA/AB in human serum are potential indicators of the proliferative capacity of human synovial mesenchymal stem cells〔J〕.Stem Cell Res Ther,2015;6:243.
8 孫江森,李 彪,龔躍昆,等.骨髓間充質干細胞標記及示蹤技術的研究與進展〔J〕.中國組織工程研究,2012;16(6):1107-10.
9 劉萍萍,軒小燕,朱敬松,等.異基因骨髓間充質干細胞移植對EAE小鼠的治療作用〔J〕.細胞與分子免疫學雜志,2013;29(8):798-801.
10 Opiela J,Samiec M,Bochenek M,etal.DNA aneuploidy in porcine bone marrow-derived mesenchymal stem cells undergoing osteogenic and adipogenic in vitro differentiation〔J〕.Cell Reprogram,2013;15(5):425-34.
11 Thompson B,Varticovski L,Baek S,etal.Genome-wide chromatin landscape transitions identify novel pathways in early commitment to osteoblast differentiation〔J〕.PLoS One,2016;11(2):e0148619.
12 Mishra DK,Veena U,Kaliki S,etal.Differential expression of stem cell markers in ocular surface squamous neoplasia〔J〕.PLoS One,2016;11(9):e0161800.
〔2016-10-31修回〕
(編輯 郭 菁)
杭州市醫療衛生及重點專科專病科科研攻關專項(20140733Q26)
于 勤(1966-),女,博士,主任醫師,主要從事心血管內科的臨床科研和教學工作。
李倩曉(1986-),女,碩士,醫師,主要從事心血管內科的臨床研究。
R3
A
1005-9202(2017)05-1084-04;
10.3969/j.issn.1005-9202.2017.05.020
1 大連大學附屬中山醫院

