蒲公英綠原酸固體分散體性能分析與比較
李 妍 王 杰 曹珂珂 - 汪張貴 - 王 娣
(蚌埠學院食品與生物工程學院,安徽 蚌埠 233030)
蒲公英(Herba Taraxaci)又叫婆婆丁,為菊科多年生草本植物。其含有綠原酸、蒲公英醇、有機酸、菊糖等多種健康營養成分。綠原酸是由咖啡酸與奎尼酸生成的縮酚酸,是植物有氧呼吸過程中經過莽草酸途徑所產生的一種苯丙素類物質。綠原酸在熱水中的溶解度較大,易溶于乙醇及丙酮,微溶于乙酸乙酯,難溶于三氯甲烷、苯等親脂性有機溶劑。綠原酸具有廣泛的生物活性,具有抗菌、抗病毒、降血壓、保肝利膽和興奮中樞神經系統等作用[1-5]。蒲公英及其綠原酸不僅在醫藥衛生領域引起關注,在食品特別是功能性食品的研究開發上也成為熱點,在開發保健飲料、果汁的護色和增香及果品的保鮮和防腐等方面[5],也展現出較好的應用前景。
綠原酸存在著諸如水溶性差、吸收較差[十二指腸中,綠原酸組的表觀吸收系數Papp為(1.700±0.53)×10-6cm/s]等問題[6]。有研究將綠原酸制成凍干粉針劑、滴丸、脂肪乳注射劑等以期改善其生物利用度,但采用上述各類方法雖然可以提高生物利用度但是工藝復雜,成本較高。相比之下,將難溶性藥物制成固體分散體是一種提高生物利用度較為簡便有效的手段[7]。固體分散體具有顯著增加難溶性藥物的溶出度,提高其生物利用度并延遲吸收,減小服藥劑量等諸多特點[8-9]。制備固體分散體所用載體的性質以及制備工藝[10-12]都將影響固體分散體的體外溶解度、溶出速度和穩定性。
為了進一步提高制劑中綠原酸的溶解度和溶出度,增加其口服給藥的吸收程度,采用2種載體材料制備成綠原酸固體分散體,并與物理混合物相比較以探討不同高分子載體制備出的固體分散體提高藥物溶解度和溶出度的潛力。
鑒于此,本試驗擬以綠原酸固體分散體的體外溶解度、累積溶出度和穩定性為綜合指標,考察綠原酸固體分散體的制備對綠原酸的體外溶解度和溶出速度的影響,以期對綠原酸新制劑的開發與利用提供幫助。
1 材料和方法
1.1 材料與儀器
1.1.1 材料與試劑
蒲公英:產地蚌埠;
綠原酸對照品:純度≥98%,上海源葉生物科技有限公司;
無水乙醇、鹽酸:分析純,國藥集團化學試劑有限公司;
水:標準去離子水,實驗室自制;
聚乙二醇:PEG4000,上海山浦化工有限公司;
聚乙烯吡咯烷酮:PVPK30,上海化學試劑有限公司;
胃蛋白酶:120 U/g,上海展云化工有限公司。
1.1.2 主要儀器設備
旋轉蒸發儀:RE-2000B型,鞏義市予華儀器有限責任公司;
循環水式真空泵:SHZ-D(III)型,鞏義市予華儀器有限責任公司;
電子天平:FA214型,上海海康電子儀器廠;
紫外可見分光光度計:TU-1901型雙光束,北京普析通用儀器有限責任公司;
溶出度測試儀:RC-6型,天津市新天光分析儀器技術有限公司;
掃描電鏡:ZEISS Merlin Compact型場發射,Carl Zeiss MERLIN Compact Germany;
冷凍干燥機:FD5-2.5型,Gold SIM International Group Co.,Ltd.;
數控超聲清洗器:JK-500DB型,合肥金尼克機械制造有限公司;
藥物穩定性檢查儀:WD-A型,天津市新天光分析儀器技術有限公司。
1.2 方法
1.2.1 標準曲線的制作 準確稱取干燥的綠原酸標準品1.0 mg,用62%乙醇將其溶解,定容至100 mL,搖勻,配置成10 μg/mL的綠原酸對照品儲備液[13]。在波長200~800 nm掃描,確定綠原酸對照品最大吸收波長為334 nm。精確吸取0.00,2.00,4.00,6.00,8.00,10.00,12.00 mL上述儲備液分別置于10 mL容量瓶中,用62%乙醇定容,搖勻。配制成質量濃度為0.0,2.0,4.0,6.0,8.0,10.0,12.0 μg/mL的溶液,在最大吸收波長處測定其吸光度(A),同時用62%乙醇試劑作為空白對照品,以吸光度A為縱坐標、綠原酸質量濃度C(μg/mL)為橫坐標,繪制標準曲線,得出標準曲線的線性回歸方程:y=0.030 5x+0.000 2,R2=0.999 1,見圖1。
1.2.2 蒲公英綠原酸提取工藝流程
蒲公英→烘干(低溫30 ℃干燥至含水量將至1%以下)→粉碎(過80目篩)→乙醇溶液浸泡[液料比1∶19 (mL/g)、乙醇濃度62%]→超聲波處理(超聲功率480 W、58 ℃、40 min)→抽濾→減壓濃縮(至無醇味)→冷凍干燥24 h (冷凍溫度-50 ℃,真空度達到9 Pa)→綠原酸粗品[13]
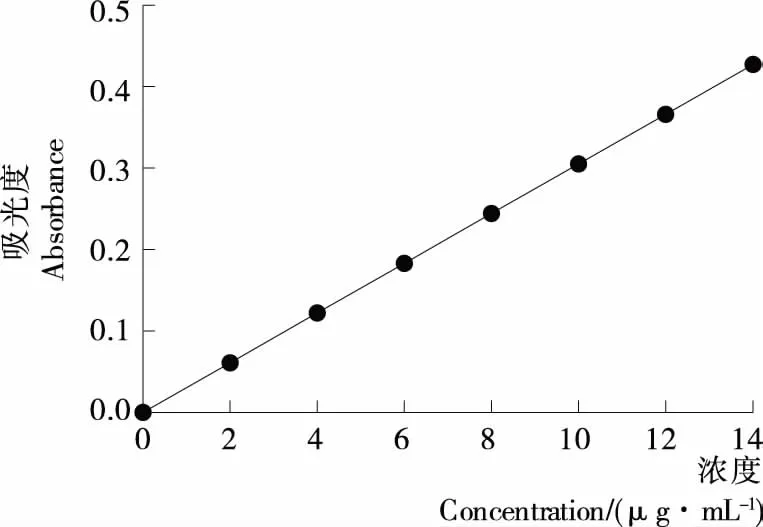
圖1 綠原酸標準曲線Figure 1 The Chlorogenic acid standard curve
1.2.3 綠原酸固體分散體的制備
(1) 綠原酸-PVP固體分散體的制備:綠原酸原料藥和載體PVPK30分別按1∶2,1∶4,1∶6,1∶8(質量比)的料輔比混合,加入無水乙醇10 mL,攪拌至綠原酸與載體完全溶解,轉入旋轉蒸發儀中60 ℃除去溶劑,將其置于干燥箱中60 ℃充分干燥,粉碎過80目篩,即得綠原酸-PVPK30固體分散體,備用[14]。
(2) 綠原酸-PEG固體分散體的制備:綠原酸原料藥與載體PEG4000分別按1∶2,1∶4,1∶6,1∶8的質量比混合,重復上述1.2.3(1)中的步驟制備綠原酸-PVPK30固體分散體,備用。
1.2.4 綠原酸與載體混合物的制備 將綠原酸與載體PVPK30、PEG4000分別按1∶2、1∶4、1∶6、1∶8的質量比混合研細,過80目篩,即得不同載體、不同配比的綠原酸混合物,備用。
1.2.5 固體分散體的性質檢測
(1) 溶解度的測定:以10 mL人工胃液(pH 1.3)為溶解介質,依次加入過量的綠原酸、綠原酸固體分散體和綠原酸與載體混合物,置于37 ℃恒溫水浴中,0.45 μm微孔濾膜濾過,測吸光度并計算溶解度[15]。按式(1)計算溶解度。
(1)
式中:
C——溶解度,μg/mL;
A——吸光度。
(2) 溶出度的測定:以600 mL人工胃液(pH 1.3)為溶出介質,溫度設定為(37±0.5) ℃,轉速100 r/min[16]。取綠原酸50 mg,綠原酸固體分散體適量(含綠原酸50 mg),綠原酸與載體混合物適量(含綠原酸50 mg),分別于5,10,20,30,40,50,70,90 min取樣,每次取2 mL,同時補充同一溫度與同一體積的新鮮溶出介質。樣品經0.45 μm微孔濾膜濾過,測量其吸光度計算綠原酸質量濃度,并換算成累積溶出率。累積溶出率按式(2)計算:
(2)
式中:
C——累積溶出度,%;
An——各時間點測得溶出度;
V1——各時間點固定取樣體積,mL;
V2——溶出介質體積,mL。
1.2.6 穩定性試驗 將4種不同料輔比制成的樣品分別分為兩組,一組放入藥物穩定性檢查儀中,設定溫度50 ℃、光照強度(5 000±500)Lx條件下[17]檢測樣品的穩定性;將另一組放在外界環境中檢測樣品的穩定性,作為對照組。每天取樣,觀察各樣品的外觀性狀,并對綠原酸的濃度和溶出度進行檢測。
1.2.7 掃描電鏡觀察綠原酸固體分散體結構 將綠原酸固體分散體研磨,徹底干燥后真空鍍金70 s,用掃描電鏡通過不同的分辨率觀察綠原酸-PVPK30固體分散體(1∶4的質量比)表面和晶體結構[18]。
2 結果與分析
2.1 樣品溶解度
由圖2可知,隨著輔料比(質量比)從1∶2增加到1∶4時,各處理組溶解度變化不大,略有下降;在同一輔料比下,各處理組溶解度大小變化順序為:綠原酸-PVPK30固體分散體>綠原酸-PEG4000固體分散體>綠原酸-PVPK30混合物>綠原酸-PEG4000混合物,可能是由于制備成固體分散體,提高了其溶解度。
2.2 樣品溶出度
2.2.1 樣品溶出度 由圖3可知,綠原酸原料藥固體在溶出度測試儀中的溶出度和累積溶出度很小,表明綠原酸在沒有載體的情況下,其在體外溶解速度較慢,且溶解需要有一定條件。這是由于PVPK30、PEG4000是水溶性高分子,與水完全互溶,綠原酸溶解度隨 PVPK30、 PEG4000 比例的增大而增大。相同處方配比下,綠原酸-PEG4000固體分散體溶解度小于綠原酸-PVPK30的,可能是在固體分散體中綠原酸存在形式發生了變化,大部分以分子形式分散在 PVPK30中,其它則以更微小的結晶和無定型形式存在。當制備成固體分散體加入到人工胃液時,PVPK30很快溶解,其中的綠原酸分子隨之轉移并溶解,加上以微晶、無定型等形式存在,使綠原酸的溶解度大大提高[19]。

圖2 不同方法制備成的樣品溶解度曲線Figure 2 Solubility curves of solid dispersions with different material
2.2.2 載體材料的選擇 由圖4可知,在最佳料輔質量比為1∶4時綠原酸與載體材料制備的各類樣品的溶出速率較綠原酸原料藥均有顯著提高,其中以綠原酸-PVPK30固體分散體的體外累積溶出率最大,50 min內累積溶出率達60%,明顯高于綠原酸-PEG4000固體分散體和綠原酸與載體混合物,可能是PVPK30高分子材料作為載體可以有效地提高藥物的溶出速度。因此,選用聚乙烯吡咯烷酮(PVPK30)為制備綠原酸固體分散體的最佳載體[20-22]。

圖3 比較不同載體與不同料輔比制備成的樣品隨時間變化的溶出度曲線Figure 3 Dissolution curves of solid dispersions with different carriers and material ratio

圖4 相同料輔比樣品的溶出度曲線Figure 4 Dissolution curves of solid dispersions with the same material ratio
2.3 穩定性試驗
綠原酸-PVPK30固體分散體與綠原酸-PEG4000固體分散體穩定性試驗結果見圖5、6。結果表明,綠原酸-PVPK30固體分散體在藥物穩定儀中外觀性狀未變化,仍為淡綠色晶體,外界環境中的固體分散體有輕微潮解現象。
由圖5、6顯示,綠原酸固體分散體在強光照射下隨著時間的延長,放在藥物穩定性檢查儀內的固體分散體中綠原酸的溶解度與外界環境條件下基本保持不變,可能是制備成固體分散體能夠有效地提高藥物的物理穩定性。

圖5 綠原酸-PVPK30固體分散體穩定性試驗結果Figure 5 Chlorogenic acid-PVPK30 solid dispersion stability tests
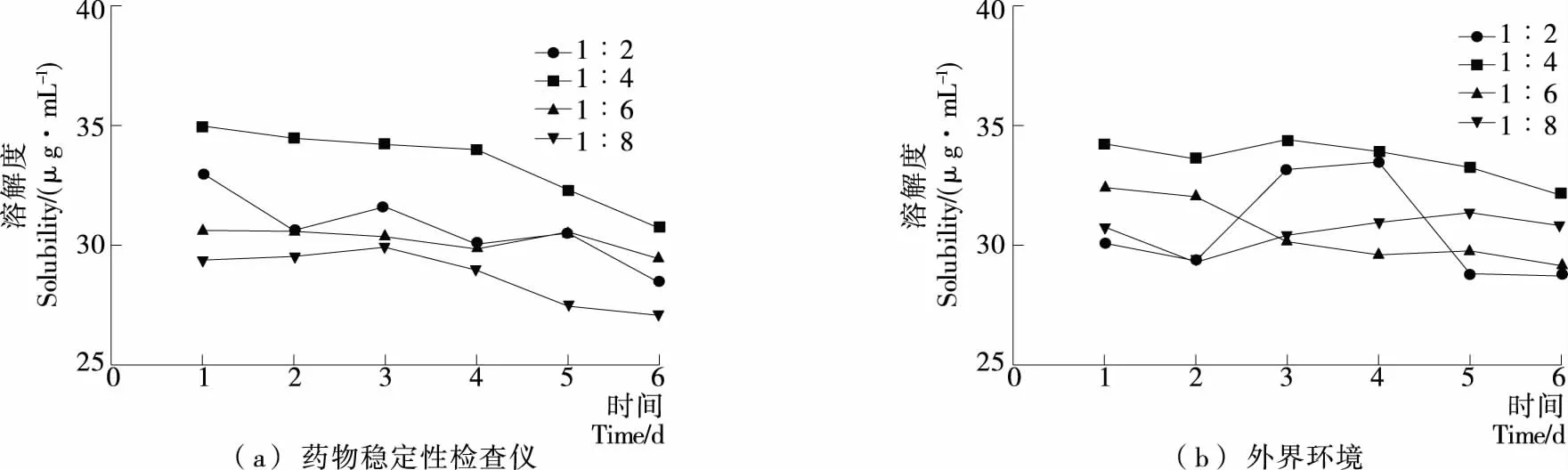
圖6 綠原酸-PEG4000固體分散體穩定性試驗結果Figure 6 Chlorogenic acid-PEG4000solid dispersion stability tests
2.4 掃描電鏡觀察結果
圖7給出了綠原酸-PVPK30固體分散體表面和晶體結構的電鏡照片,固體分散體中沒有明顯的晶體存在,表明制備的固體分散體中藥物以無定形形式均勻地分散在PVPK30載體中,這是由于PVPK30在旋轉蒸發的過程中黏度逐漸增大,抑制了綠原酸晶體的生長,所以晶體以無定形的形態存在于載體材料中。圖7顯示,固體分散體的表面有很多小孔,可能是由溶劑法制備固體分散體時乙醇蒸發造成的。正是這些小孔的存在,增加了綠原酸固體分散體的表面積,有利于藥物的溶出[23]。蒲公英綠原酸固體分散體中溶解度和累計溶出度的增加,可能是PVPK30屬于無定形高分子聚合物在溶液中呈現網狀的結構與藥物共蒸發溶劑,由于氫鍵或絡合作用形成固體橋,阻滯了蒲公英綠原酸聚集結晶,使藥物形成非結晶型無定形物,從而提高其溶解度和溶出度[24-26]。

A、B:綠原酸-PVPK30固體分散體1∶4(質量比)掃描尺寸1 μm×1 μm C、D:綠原酸-PVPK30固體分散體1∶4(質量比)掃描尺寸2 μm×2 μm圖7 電鏡掃描圖Figure 7 SEM photos of Chlorogenic acid-PVPK30 solid dispersion
3 結論
研究表明,綠原酸固體分散體及物理混合物的溶解度、累計溶出度與原料藥相比均有較顯著差異。PEG4000、PVPK30為高分子藥用載體均可以有效增加綠原酸體外溶出度,提高溶解度并且有效提高制劑的穩定性,尤以質量比1∶4 的綠原酸-PVPK30固體分散體更佳。
綠原酸-PVPK30的固體分散體顯著改善綠原酸溶出和提高綠原酸穩定性的機制:① 綠原酸在固體分散體中以無定型形式存在,從而顯著增加其與溶液接觸的比表面積,提高其溶解度;② 綠原酸部分可與PVPK30分子形成氫鍵以無定型狀態進入 PVP中,同時氫鍵也可增加PVP的溶水性,達到難溶的綠原酸分子通過氫鍵分散于 PVP中使其變得易解[19];③ PVP能置換綠原酸表面的H2O和OH-,通過共價鍵和氫鍵吸附在綠原酸分子表面,產生的吸附降低了表面自由能,防止綠原酸分子積聚,從而穩定分散在PVP中。
綜上所述,通過綠原酸-PVPK30固體分散體解決了綠原酸穩定性差、溶出度差等難題, 同時不影響綠原酸結構中的功能基團酚羥基,對于其在食品殺菌、保鮮和抗氧化中的應用具有顯著性意義。
[1] WEI Yun, GAO Ya-li, XIE Qian-qian, et al. Isolation of chlorogenic acid fromFlaveriabidentis(L.) Kuntze by CCC and synthesis of chlorogenic acid-intercalated layered double hydroxide[J]. Chro-matographia, 2011, 73(1): 97-102.
[2] WANG Zhi-hua, LI Xiao-liang, ZHEN Sai-jing, et al. The important role of quinic acid in the formation of phenolic compounds from pyrolysis of chlorogenic acid[J]. J Therm Anal Calorim, 2013, 114: 1 231-1 238.
[3] 向福, 劉亮, 秦婷, 等. 羅田金銀花葉中綠原酸的提取工藝改進[J]. 食品與機械, 2013, 29(6): 150-152, 196.
[4] 山永凱. 枸杞中綠原酸的提取工藝研究[J]. 食品與機械, 2012, 28(5): 127-130.
[5] 國家醫藥管理局中草藥情報中心站. 植物藥有效成分手冊[M]. 北京: 人民衛生出版社, 1986: 209-210.
[6] 時軍, 翟李翔, 許維桐. 白芷提取物對綠原酸腸吸收的影響[J]. 中成藥, 2016, 38(11): 2 355-2 359.
[7] 祁雯, 施斌, 黃雄偉, 等. 熊果酸共晶固體分散體的體外特性研究[J]. 中草藥, 2013, 44(20): 2 845-2 851.
[8] PARK Y J, LEE H K, IM Y B, et al. Improved pH-independent dissolution and oral absorption of valsartan via the preparation of solid dispersion[J]. Archives of Pharmacal Research, 2010, 33 (8): 1 235-1 240.
[9] QIU Ming-feng, WEI Jia, LI Shao-shun, et al. A new silymarin preparation based on solid dispersion technique[J]. Adv Ther, 2005, 22(6): 595-600.
[10] URBANETZ N A, LIPPOLD B C. Solid dispersions of nimodipine and polyethylene glycol2000: Dissolution properties and physico-chemical characterization[J]. Eur J Pharm Biopharm, 2005, 59(1): 107-118.
[11] WASFY M, OBEIDA T, AL-SAYED A, et al. Erratum to: Evaluation of tadalafil nanosuspensions and their PEG solid dispersion matrices for enhancing its dissolution properties[J]. Pharm Tech, 2014, 15(3): 802-807.
[12] TARO Kojima, KENJIROU Higashi, TOYOFUMI Suzuki, et al. Erratum to: Stabilization of a super saturated solution of mefenamic acid from a solid dispersion with EUDRAGIT?EPO[J]. Pharm Res, 2012, 29: 1 419.
[13] HAO Hai-jun, JIA You-zhi, ZHANG Hong-qin, et al. Preparation of monolithic osmotic tablet of quercetin loaded by solid dispersion[J]. Chin Pharm, 2015, 24(6): 383-392.
[14] 趙安權, 王倩倩, 李佳, 等. 綠原酸磷脂復合物固體分散體的體外溶出和藥動學研究[J]. 中國測試, 2015, 41(1): 54-57.
[15] 王雪梅, 蔣麗, 袁紅江, 等. 金銀花中綠原酸提取濃縮工藝[J]. 重慶理工大學學報, 2011, 25(3): 47-50.
[16] 韓剛, 閻林奇, 索煒, 等. 大黃素固體分散體的制備及其溶出度測定[J]. 中草藥, 2011, 42(3): 487-490.
[17] 高振珅, 張曉麗, 王建奪. 姜黃素固體分散體與包合物的制備及其性能研究[J]. 中藥材, 2011, 34(11): 1 784-1 788.
[18] 焦艷, 任紅暖, 袁堂娟, 等. 白藜蘆醇固體分散體的制備及其性質研究[J]. 中藥材, 2014, 37(3): 517-520.
[19] 陳雅芬, 劉永紅, 劉永瓊, 等. 癸氧喹酯固體分散體的穩定性分析[J]. 武漢工程大學學報, 2010, 32(12): 19-22.
[20] 許東暉, 王勝, 梅雪婷, 等. 聚乙烯吡咯烷酮K30對姜黃素的增溶作用研究[J]. 中藥材, 2008(3): 438-442.
[21] 王康, 趙彤, 何志敏. 穿心蓮內酯固體分散體的制備及體外溶出實驗[J]. 中國現代應用藥學雜志, 2009, 26(8): 638-641.
[22] 陳國廣, 張柯萍, 李學明, 等. 燈盞花素緩釋固體分散體的制備及溶出度的研究[J]. 華西藥學雜志, 2007, 22(2): 169-171.
[23] 王敏, 王淑君, 侯巍. 楊梅素固體分散體的制備以及體外溶出試驗[J]. 實用藥物與臨床, 2012, 15(5): 281-283.
[24] 孫彩霞, 尹蓉莉, 趙俊霞, 等. 水蜈蚣總黃酮固體分散體的制備及其性質研究[J]. 中草藥, 2014, 45(14): 2 018-2 021.
[25] 潘菲, 王昆, 李琳玉, 等. 大黃酚固體分散體在大鼠體內藥動學研究[J]. 中國實驗方劑學雜志, 2015, 21(10): 91-93.
[26] 陳小云, 張振海, 郁丹紅, 等. 丹參酮組分緩釋固體分散體的研究[J]. 中草藥, 2013, 44(17): 2 391-2 396.

