具有神經生長因子緩釋功能的聚羥基脂肪酸酯膜片的制備及其對PC12細胞神經分化的研究
陳曦,高力,雷靜
(自貢市第四人民醫院神經外科1、檢驗科2,四川 自貢 643000)
具有神經生長因子緩釋功能的聚羥基脂肪酸酯膜片的制備及其對PC12細胞神經分化的研究
陳曦1,高力1,雷靜2
(自貢市第四人民醫院神經外科1、檢驗科2,四川 自貢 643000)
目的 制備一種可緩慢釋放神經生長因子(NGF)的的高分子復合材料,用于神經組織工程的研究。方法采用溶劑揮發的方式,將NGF與聚羥基脂肪酸酯(PHA)在有機溶劑中充分混合,再將其倒入圓形玻璃器皿中,形成一個表面和內部都含有NGF的PHA膜,并將純的PHA膜和浸泡干燥的PHA膜(粘附NGF的PHA膜)作為對照。將上述三種膜分別進行微觀形貌(掃描電子顯微鏡)、水接觸角和NGF體外釋放的檢測。最后,在連續培養6 d后,觀察三種膜對PC12細胞的神經分化影響。結果相對于兩個對照組,負載NGF的PHA膜表面形貌更起伏粗糙,有明顯的蛋白粘附,也具有最佳的親水性。同時,負載NGF的PHA膜能連續6天釋放出穩定的且有活性的NGF,濃度大于100 ng/mL。負載NGF的PHA膜上的PC12細胞分化明顯,在培養第3天時出現神經樣細胞的分化表型,長出了軸突,而第6天鄰近的幾個PC12細胞的軸突相互接觸并形成類似神經網結構;其他對照組沒有明顯現象。結論成功利用生物材料PHA制備出一種具有NGF緩釋功能的生物高分子膜片,并可誘導PC12細胞向神經細胞表型分化。
神經生長因子;聚羥基脂肪酸酯;神經組織工程;緩釋
神經生長因子(NGF)是一種昂貴的神經分化生長因子,且使用半衰期較短,通常只有幾個小時[1-2]。一次性局部給藥后NGF能發揮生物活性功能的時間十分有限,這在一定程度上限制了其在臨床上的應用[3-4]。因此,需要尋求一種可長期釋放具有功能活性NGF的緩釋方法,以避免上述困難。近年來,越來越多的嘗試利用組織工程和緩釋載體的思維解決生長因子的緩釋問題。聚羥基脂肪酸酯(PHA)是一種從微生物中提取的生物聚酯材料,由300多種單體組合而成,是一種全新的生物材料[5]。由于具有良好的生物相容性和生物可降解性,PHA逐漸被大家用于組織工程和藥物載體領域的研究,并取得了較好的成果[6]。但目前還無人做將NGF包裹在PHA中的嘗試,特別是最新的PHA材料P(3HB-co-4HB),形成可緩釋NGF的PHA膜,并用于PC12神經分化的研究。
1 材料與方法
1.1 試劑與儀器 聚羥基脂肪酸酯[P(3HB-co-4HB),相對分子質量為20×104]購于意中國可曼生物材料有限公司。日本電子日本電子株式會社(JEOL)生產的掃描電子顯微鏡;日本奧林巴斯倒置熒光顯微鏡;承德金和儀器制造有限公司生產的接觸角水滴角測量儀;所有細胞培養試劑、耗材和NGF均購于美國賽默飛公司(Thermo,Gibco)。
1.2 方法 (1)制備PHA膜:將1 g的PHA溶解于10 mL的體積比為1:1的二氯甲烷/丙酮混合有機溶液中,使用20℃、200 r/min的磁力攪拌器攪拌使其充分溶解;將溶液倒入直徑為7 cm的圓形玻璃器皿中,待二氯甲烷完全揮發,得到聚羥基脂肪酸酯膜片。(2)制備表面粘附NGF的PHA膜:將上述所制備的PHA膜浸泡在4℃的100 mg/mL NGF溶液中,取出冷凍干燥。(3)制備負載NGF的PHA膜:與PHA膜的制備相似,將1 g的PHA溶解于10 mL的體積比為1:1的二氯甲烷/丙酮混合有機溶液中,在20℃、200 r/min的磁力攪拌器使其充分溶解;再加入20 mg的NGF粉末,繼續溶解5 min;將溶液倒入直徑為7 cm的圓形玻璃器皿中,待二氯甲烷完全揮發得到負載NGF的聚羥基脂肪酸酯膜片。(4)觀察和分析三種PHA膜的理化性質:分別將上述制備的PHA膜切下相等大小的一小片(約1 cm×0.5 cm),用導電膠粘在金屬臺上,噴Pt金60 s,抽真空處理后,采用掃描電鏡(SEM)觀察膜的表面結構;另取同樣大小的膜片粘附在載物臺上,滴加10 μL的超純水在膜表面,用于接觸角檢測。(5)NGF的緩釋能力:將粘附NGF的PHA膜和負載NGF的PHA膜裁剪成48孔板大小的圓形,分別浸泡在2 mL的37℃的磷酸鹽緩沖液(PBS)(pH= 7.4)中靜態處理,每天換液并收集PBS;并采用ELISA試劑盒,對每個時間點的樣品中的NGF含量進行檢測。(6)膜片上的PC12的培養:先將膜片切割成48孔板大小,并進行紫外殺菌處理;將購買的PC12細胞復蘇并培養在F12培養液(含5%胎牛血清、15%馬血清、100 U/mL青霉素及100 mg/mL鏈霉素),置于37℃、5%CO2細胞培養箱中培養;傳代2次后以2×104個細胞接種于孔培養板上,接種在48孔板的膜片上,隔日換液,連續培養10 d。(7)膜片上的PC12神經分化效果測試:連續培養10 d后,分解在培養的第3天和第6天進行染色及熒光顯微鏡觀察,分別將三種膜片依次進行PBS清洗、含1%DIO的培養基染色培養10 min、PBS再次清洗除去殘余的DIO、加入新鮮的培養基、熒光顯微鏡觀察。
2 結 果
2.1 三種PHA膜的表面形貌 通過SEM觀察發現,單純的PHA膜表面較光滑;浸泡后表面粘附NGF的PHA膜表面有明顯的蛋白附作物;負載NGF的PHA膜表面形貌更起伏粗糙,且也發現明顯的蛋白附作物(圖1)。
2.2 三種PHA膜的親水性對比 采用純水的接觸角檢測法,發現三種膜片的親水性分別是負載NGF的PHA膜>粘附NGF的PHA>PHA膜(圖2A)。且負載NGF的PHA膜與PHA膜差異具有統計學意義(P<0.05)。這說明親水性與NGF的混合比例和方式有關。
2.3 NGF的釋放能力檢測 通過ELISA試劑盒,檢測出負載NGF的PHA膜和粘附NGF的PHA所釋放出的NGF含量(圖2B)。結果表明,兩種PHA膜片都能釋放出不同濃度的NGF,第1天,粘附NGF的PHA膜釋放的NGF濃度為460.72 ng/mL,大于負載NGF的PHA膜的357.39 ng/mL,差異具有統計學意義(P<0.05)。第2天,粘附NGF的PHA膜釋放的NGF濃度只檢測出18.94 ng/mL,而負載NGF的PHA膜依然保持著257.54 ng/mL的強勁NGF釋放能力,兩者差異有統計學意義(P<0.005)。粘附NGF的PHA膜在第3天就無法檢測到NGF,而負載NGF的PHA膜從第3天到第6天均能檢測出,且濃度維持在100~130 ng/mL之間,說明負載NGF的PHA膜具有良好的NGF緩釋功能,且釋放的NGF濃度基本滿足PC12神經分化的需求。
2.4 膜片上的PC12神經分化 通過熒光顯微鏡觀察發現,不論是培養第3天還是第6天,PHA膜上的PC12沒有任何神經分化的跡象;負載NGF的PHA膜上的PC12細胞分化明顯,在第3天時出現神經樣細胞的分化表型,長出了軸突,而第6天鄰近的幾個PC12細胞的軸突相互接觸并形成類似神經網結構;而只是表面粘附少量NGF的PHA膜也表現出微弱的現神經樣細胞分化現象,但遠低于負載NGF的PHA膜,見圖3。這驗證了負載NGF的PHA膜釋放的NGF具有生物活性,可以誘導PC12細胞向神經細胞表型分化。

圖1 三種PHA膜的微觀結構對比

圖2 釋放濃度對比
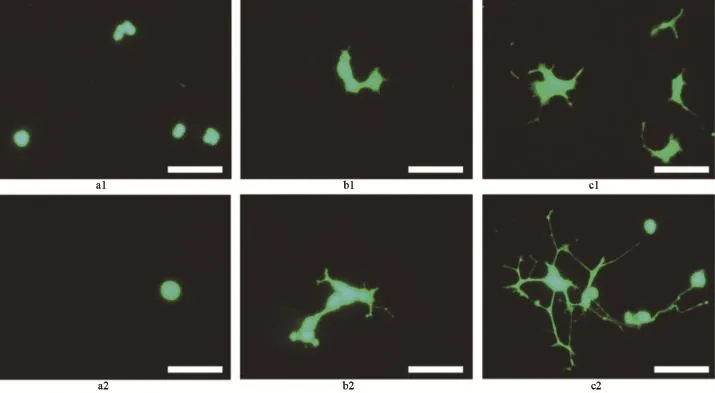
圖3 三種PHA膜上培養PC12細胞的熒光顯微鏡圖
3 討 論
目前已知,NGF對神經元或類神經元細胞的生長發育及特殊的功能維持都有著重要作用。通常情況下NGF大于50 ng/mL時,即可誘導PC12細胞模型進行神經分化[1],具體表現為:(1)數量上,細胞的增埴能力逐步停止,細胞數量不再增加;(2)形態上,出現細胞平展、細胞質附屬物的形成及細胞膜變皺褶等現象,并胞體逐步長出突起;(3)分子生化功能上,出現氨基酸的轉運加強、離子泵的改變及相關蛋白質的磷酸化等現象,且細胞表面逐步出現神經細胞所特有的細胞膜電位。由于這種特異地分化使其在形態外觀及生理功能方面都更接近于神經元,PC12是最佳的神經元分化的體外模型。PHA是一種從微生物中提取的生物材料,具有良好的生物相容性和生物可降解性,已在組織工程和藥物載體領域的進行大量的研究[6],也是一種潛在的神經組織工程材料。但目前為止,沒有關于NGF包裹在PHA中可緩釋NGF的任何報道。
本課題嘗試將NGF包裹在最新的一種PHA材料,即P(3HB-co-4HB),構建一種可緩釋NGF的PHA膜,并能刺激PC12進行神經分化。與NGF只是簡單地粘附在PHA膜表面相比,將PHA與NGF充分混合后,采用溶劑揮發的方式將NGF均勻的分散在PHA膜的表面和內部,更有利于實現NGF的緩慢釋放。結果表明,負載NGF的PHA微觀形貌和單純的浸泡粘附NGF的PHA膜更粗糙。通過體外緩釋檢測發現,在6 d(每天換液)的測試中,負載NGF的PHA膜均能持續釋放出濃度大于100 ng/mL的NGF,而粘附NGF的PHA膜只有在第一天能達到上述濃度。通過PC12細胞的種植和分化效果也進一步驗證了上述觀點。通過6天的連續培養,只有負載NGF的PHA膜能成功實現多個PC12細胞的軸突相互接觸及類似神經網結構的形成,對照組無法實現。
綜上所述,通過NGF與PHA混合制備的膜可有效地進行NGF的緩釋,且能促進PC12神經分化,是一種全新的具有生長因子緩釋功能的復合材料,具有較好的神經組織工程科研及臨床意義,前景廣闊。
[1]Zhang K,Zheng H,Liang S,et al.Aligned PLLA nanofibrous scaffolds coated with graphene oxide for promoting neural cell growth [J].Acta Biomaterialia,2016,37:131-142.
[2]Zuidema JM,Provenza C,Caliendo T,D et al.Magnetic NGF-releasing PLLA/iron oxide nanoparticles direct extending neurites and preferentially guide neurites along aligned electrospun microfibers[J]. ACS Chemical Neuroscience,2015,6(11):1781-1788.
[3]Martinotti G,Di Iorio G,Marini S,et al.Nerve growth factor and brain-derived neurotrophic factor concentrations in schizophrenia:a review[J].Journal of Biological Regulators and Homeostatic Agents, 2012,26(3):347-356.
[4]Chen YW,Lin PY,Tu KY,et al.Significantly lower nerve growth factor levels in patients with major depressive disorder than in healthy subjects:a meta-analysis and systematic review[J].Neuropsychiatric Disease and Treatment.2015,11:925-933.
[5]Chen GQ.A microbial polyhydroxyalkanoates(PHA)based bio-and materials industry[J].Chemical Society Reviews,2009,38(8): 2434-2446.
[6]Misra SK,Valappil SP,Roy I,et al.Polyhydroxyalkanoate(PHA)/inorganic phase composites for tissue engineering applications[J].Biomacromolecules,2006,7(8):2249-2258.
Preparation of polyhydroxyalkanoate film with NGF-slow release and its effect on neural differentiation of PC12 cells.
CHEN Xi1,GAO Li1,LEI Jing2.Department of Neurosurgery1,Department of Clinical Laboratory2,Zigong Fourth People's Hospital,Zigong 643000,Sichuan,CHINA
ObjectiveTo study the preparation of polyhydroxyalkanoate(PHA)film with nerve growth factor (NGF)slow release and its effect on neural differentiation of PC12 cells.MethodsNGF and PHA were mixed thoroughly in the organic solvent through solvent evaporation method.Then the solvent was poured into a round glass container to form a PHA film containing NGF inside and outside.The pure PHA film and the soaked dry PHA film(PHA film attached NGF)were regarded as the control groups.The three kinds of films were characterized by microstructure (SEM),water contact angle measurement and NGF release assay respectively.After 6 consecutive days of culturing,the effects of three kinds of films on neuronal differentiation of PC12 cells were observed.ResultsCompared by the twocontrol groups,the surface of PHA films loaded with NGF appeared rougher,and had obvious protein adhesives and the best hydrophilia.Meanwhile,the PHA films loaded with NGF could release the active NGF whose concentrations exceeded 100 ng/ml for 6 consecutive days steadily.The PHA films loaded with NGF had the obvious differentiation.On the third day of culturing,the differentiation phenotype of neuron-like cells appeared and the axons grew;on the sixth day of culturing,the axons of neighboring PC12 cells contacted with each other and formed a structure of resembling neural network.While,the control groups had no obvious differentiation phenomena.ConclusionIn this study,a biopolymer biomembrane with a slow-release function of NGF was successfully prepared and the PC12 cells were induced to differentiate into neuronal cells.
Nerve growth factor(NGF);Polyhydroxyalkanoate(PHA);Nerve tissue engineering;Slow release
R741
A
1003-6350(2017)04-0530-04
10.3969/j.issn.1003-6350.2017.04.004
2016-08-15)
雷靜。E-mail:601769459@qq.com

