半抗原-瓊脂擴散試驗鑒別布魯氏菌感染抗體和S2、Rev.1免疫抗體的研究與應用
楊 珍,尼 博,田莉莉,范偉興
半抗原-瓊脂擴散試驗鑒別布魯氏菌感染抗體和S2、Rev.1免疫抗體的研究與應用
楊 珍,尼 博,田莉莉,范偉興
目的 布魯氏菌病嚴重威脅著我國畜牧業生產和公共衛生安全,現有的常規血清學檢測方法雖具有較高的敏感性與特異性,但無法區分布魯氏菌感染抗體和S2、Rev.1疫苗免疫抗體(以下簡稱“鑒別診斷”),給我國執行撲殺布病感染動物的政策帶來阻力。 因此在S2和Rev.1疫苗免疫背景下研究天然半抗原-瓊脂擴散試驗(NH-GD)的鑒別診斷能力。方法
布魯氏菌病;半抗原-瓊脂擴散試驗;鑒別診斷
Supported by the Construction Program of Modern Agricultural (cows) Industrial Technology System(CARS-37)
Correspondence authors:FAN wei-xing,Email:fwx521@126.com
近年來,我國人畜間布魯氏菌病(以下簡稱“布病”)病例呈現上升趨勢,嚴重威脅畜牧生產、食品安全和衛生安全。布病作為一種人獸共患病,人的感染風險極高,僅在2015年一年全國報告的人間布病病例就接近60 000例。常規的血清學診斷方法以光滑型脂多糖(S-LPS)抗原為基礎,包括虎紅平板凝集試驗(RBT)、試管凝集試驗(SAT)、酶聯免疫吸附試驗(ELISA)、補體結合試驗(CFT)等,能夠檢測到S-LPS抗體,但動物接種疫苗后同樣產生針對S-LPS的抗體,不能達到區分布魯氏菌感染抗體和疫苗免疫抗體的目的。在我國執行布病防控 “檢測-撲殺” 政策背景下,急需一種能夠鑒別布魯氏菌感染抗體和疫苗免疫抗體的診斷技術,以促進“檢測-撲殺”政策的貫徹執行。因此,尋找區分布魯氏菌感染抗體和疫苗免疫抗體的鑒別診斷技術不僅僅是一項科研任務,對我國布病防控政策的實施亦具重要意義。
除了S-LPS分子外,光滑型布魯氏菌表面還有一種天然半抗原(Native Hapten,NH)。有研究表明,接種S19疫苗的動物血清中檢測不到NH抗體的存在[1],而野毒感染血清中能夠檢測到NH抗體的存在。所以,基于NH建立的檢測方法可以為鑒別診斷提供新的思路。之前有報道稱,在歐洲利用NH抗原的瓊脂擴散試驗(Gel Diffusion, GD)可以很好地區別Rev.1疫苗免疫與野毒感染。西班牙布病專家BLASCO對布魯氏菌NH抗原進行很多研究,肯定其在布病感染和疫苗免疫中的鑒別診斷作用[2]。在BLASCO的幫助下,研究NH-GD試驗在S2、Rev.1免疫背景下對布病感染抗體和S2、Rev.1免疫抗體的鑒別診斷能力,為我國布病防控政策的執行提供一種鑒別診斷技術。
1 材料與方法
1.1 血清與菌株 61份布病陽性血清 采自無布病疫苗接種史的綿羊群,且經RBT、SAT和CFT檢測為陽性的血清;300份布病陰性血清:采自無布病發病史的綿羊群,經RBT、SAT和CFT檢測為陰性的血清。S2、Rev.1疫苗免疫血清:S2口服免疫、Rev-1點眼免疫各接種20只健康綿羊,分別在免疫后第7 d、14 d、21 d、28 d、58 d、90 d、122 d采集血清。B.mehitensis16M菌株由本實驗室保存。布魯氏菌病陽性血清國家標準品(Z112)、布魯氏菌病陰性血清(Z3):購自中國獸醫微生物菌種保藏管理中心(CVCC)。
1.2 試劑 瓊脂(DifcoTMAgar Noble)購自BD公司;硼酸、氯化鉀、氯化鈉購自國藥集團化學試劑有限公司;標準NH抗原由西班牙阿拉貢食品研究與技術中心(CITA)饋贈;布魯氏菌熒光偏振測定法(FPA)試管型抗體檢測試劑盒購自哈爾濱平河生物技術有限公司。
1.3 實驗方法
1.3.1 布魯氏菌擴增與滅活B.mehitensis16M接種于BS斜面培養基,5%~10% CO2培養箱37 ℃培養3-4 d,待布魯氏菌生長至對數生長期時,用PBS(pH7.2)洗滌菌苔,收集菌液,加入苯酚至終濃度0.5%,37℃培養24 h滅活,將滅活后的菌液接種BS平皿,觀察細菌滅活效果。
1.3. 2 抗原制備 根據之前已報道的方法[3],我們對抗原進行了制備,步驟簡寫如下:將滅活后的菌液,12 000 r/min 4 ℃離心10 min,棄去上清;沉淀物加滅菌生理鹽水重懸,12 000 r/min 4 ℃離心10 min,洗滌兩次;按體積比1∶4加雙蒸水重懸沉淀物,121 ℃高壓30 min;12 000 r/min 4 ℃離心20 min,取上清,加入3倍體積無水乙醇,4℃攪拌過夜;15 000 r/min 4 ℃離心20 min,取沉淀物,用適量雙蒸水重懸,透析、凍干、稱重,所得產物為NH-LPS抗原混合物,-20℃保存備用。
1.3.3 優化試驗
1.3.3.1 硼酸緩沖液的配制 稱取硼酸6.2 g、氯化鉀7.25 g,向其中加入800 mL ddH2O,攪拌至溶化,用濃度為1 mol/L的NaOH將溶液pH調節值至8.3后將溶液定容至1 000 mL。
1.3.3.2 瓊脂平皿的制備 每100 mL硼酸緩沖液加入不同濃度瓊脂,10 g氯化鈉,水浴加熱至完全溶解,在直徑為90 mm的一次性塑料平皿中加入14 mL瓊脂溶液,待瓊脂凝固后備用。
1.3.3.3 抗原工作濃度與感作溫度的優化 將制備好的抗原稀釋為0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL、3.0 mg/mL 6個不同濃度,每個濃度分別用6份羊布病陽性血清(強陽性、中等強度陽性、弱陽性血清各2份)進行測定。用孔徑3 mm、孔距3 mm的梅花型打孔器進行打孔,加熱封底,中央孔加入20 μL半抗原,周邊6個孔中各加入20 μL血清。將平皿放置于濕盒中,分別在22 ℃、25 ℃、30 ℃、37 ℃ 4個條件下進行孵育,連續觀察,記錄結果。選擇所有血清均出現清晰沉淀帶的最低半抗原濃度和感作溫度為最佳反應條件。
1.3.3.4 瓊脂平皿濃度的優化 依次制備0.6%、1.0%、1.2%、1.5%、1.7%、2% 6種濃度的瓊脂平皿,如1.3.3.3打孔、封底,孔中央孔加入最佳濃度半抗原,周邊孔加入羊布病陽性血清,放置濕盒中在最佳溫度下感作,連續觀察,記錄結果。以出現最清晰沉淀帶的瓊脂濃度為最佳瓊脂濃度。
1.3.4 敏感性與特異性試驗 對61份羊布病陽性血清和300份羊布病陰性血清按優化后的實驗條件進行NH-GD試驗,設NH-GD陰性、陽性血清為對照,連續觀察,記錄感作時間和實驗結果。
1.3.5 羊免疫血清NH-GD試驗 對實驗室收集的S2、Rev.1疫苗接種后第7 d、14 d、21 d、28 d、58 d、90 d、122 d的羊免疫血清(每個時間節點各20份)進行NH-GD試驗,設NH-GD陰性、陽性血清為對照,連續觀察,記錄實驗結果。
1.3.6 結果判讀 由于NH分子量小,在瓊脂凝膠中擴散速度比S-LPS快,因此靠近血清一側的白色沉淀帶為NH沉淀帶,靠近半抗原一側的白色沉淀帶為S-LPS沉淀帶。出現NH、S-LPS兩條帶(如圖1)或出現NH一條帶為布病陽性動物或免疫動物;出現S-LPS一條帶,為免疫動物。當梅花孔中均為陽性血清時NH沉淀帶與S-LPS沉淀帶分別相互融合形成環狀,此時S-LPS沉淀帶在抗原孔周邊成環,不易拍攝出。

圖1 標準陽性血清(周邊孔)與半抗原(中心孔)的沉淀反應Fig.1 Precipitation reaction between standard positive sera (in border wells) and NH (in center well)
1.3.7 熒光偏振試驗(FPA) 按布魯氏菌熒光偏振測定法(FPA)試管型抗體檢測試劑盒說明書進行操作,對61份羊布病陽性血清、300份羊布病陰性血清及S2、Rev.1疫苗免疫血清進行檢測,比較兩種方法的檢測結果。
2 結 果
2.1 抗原工作濃度、感作溫度的優化試驗 選取6份布病陽性羊血清,分別編號為1-6,其中1號、2號為強陽性血清,3號、4號為中等強度陽性血清,5號、6號為弱陽性血清。結果表明,陽性血清能夠在抗原濃度為0.5 mg/mL、1.0 mg/mL、1.5 mg/mL時均能與NH形成沉淀帶,并聯結成沉淀環(如圖2)。因此,選擇1.0 mg/mL為最佳抗原工作濃度。在22 ℃、25 ℃、30 ℃、37 ℃ 4個感作溫度中,25 ℃條件下弱陽性血清(5、6號)出現的NH沉淀帶最為完整、清晰見圖2B,因此選擇25 ℃為最佳感作溫度。

A: 22 ℃ B: 25 ℃ C: 30 ℃ D:37 ℃圖2 半抗原工作濃度、感作溫度的優化試驗Fig.2 Optimization of antigen concentration and temperature
2.2 瓊脂濃度優化試驗 瓊脂濃度優化試驗結果表明,1.2%瓊脂平皿中的NH沉淀帶最為清晰且5號、6號弱陽性血清均出現的沉淀帶最為清晰(如圖3),因此最佳瓊脂平皿濃度為1.2%。

A:0.6% B:1.0% C:1.2% D:1.5% E:1.7% F:2.0%圖3 瓊脂濃度優化試驗Fig.3 Optimization of agar concentration
2.3 敏感性和特異性 用NH-GD試驗對61份羊布病陽性血清和300份羊布病陰性血清進行檢測,至第4 d NH沉淀帶的數量不再增加,檢測結果見表1。
2.4 重復性 利用同一批次的抗原對羊布病陽性血清、羊布病陰性血清進行3次獨立重復檢測,所得結果一致。
用2個批次的抗原對上述血清進行重復檢測,所得結果一致。因此NH-GD試驗有較好的重復性。
表1 NH-GD試驗的敏感性與特異性
Tab.1 Sensitivity and specificity of NH-GD Assay
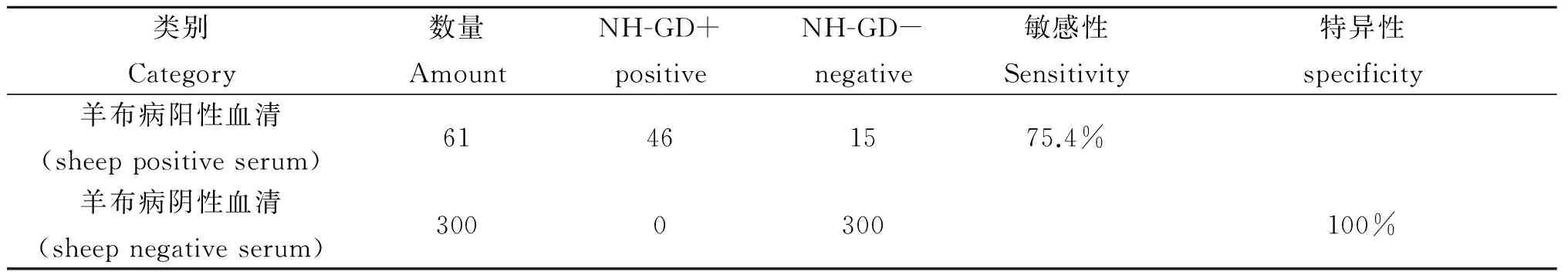
類別Category數量AmountNH-GD+positiveNH-GD-negative敏感性Sensitivity特異性specificity羊布病陽性血清(sheeppositiveserum)61461575.4%羊布病陰性血清(sheepnegativeserum)3000300100%
2.5 比對試驗結果 NH-GD和FPA對61份羊布病陽性血清和300份羊布病陰性血清檢測結果比較分析發現:NH-GD雖敏感性低于FPA的敏感性,但兩種方法的特異性均達到100%,見表2,并且兩種方法比較Kappa≥0.75(P<0.01),一致性較好,見表3。
表2 NH-GD與FPA的敏感性與特異性
Tab.2 Sensitivity and specificity of NH-GD and FPA
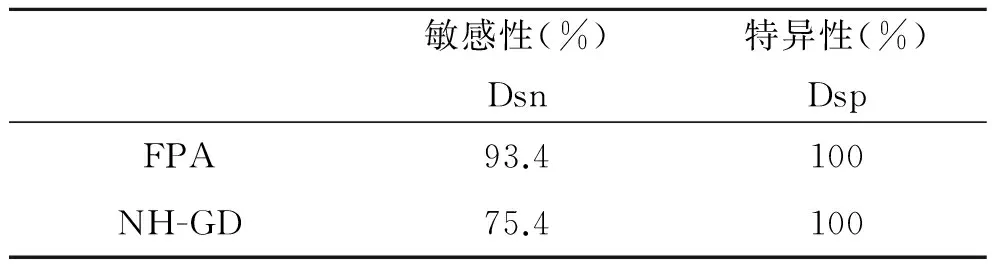
敏感性(%)Dsn特異性(%)DspFPA93.4100NH-GD75.4100
表3 NH-GD與FPA結果比較
Tab.3 Comparing results of NH-GD and FPA

NH-GDTotalKappavalue+-FPA+4611570.876-0304304Total46315361
2.5 NH-GD的鑒別診斷試驗 利用NH-GD、RBT、SAT、FPA 4種方法,對接種疫苗后不同時間點采集的羊血清進行檢測,結果表明接種S2疫苗的羊血清中檢測不出NH抗體存在(如圖4A),而接種Rev.1疫苗122 d后NH-GD試驗陽性率為0(如圖4B)。除FPA在接種S2疫苗58 d后的羊血清中檢測不到S2免疫抗體外,這3種方法在不同的時間點都能檢測到疫苗免疫抗體。

A: S2口服免疫 B:Rev.1點眼免疫A: oral immunized by S2 B: conjunctival immunized by Rev.1圖4 鑒別診斷試驗Fig.4 Differentiation test of natural infection and vaccination
3 討 論
通過優化試驗,我們確定NH-GD試驗最佳反應條件為:抗原濃度1 mg/mL、25 ℃感作、瓊脂平皿濃度1.2%、感作時間3 d。利用優化后的實驗條件,我們測定NH-GD試驗的敏感性為75.4%,特異性為100%且具有較好的重復性。與FPA試驗比對發現,兩種檢測方法一致性較好。分析不同時間點的S2、Rev.1免疫血清的檢測結果發現:口服S2免疫血清呈NH-GD檢測陰性,點眼接種Rev.1疫苗122 d以后NH-GD檢測陽性率為0;而RBT、SAT在相同的時間點都能檢測出較高的免疫抗體陽性率;FPA除在S2免疫58 d后的羊血清檢測不到免疫抗體外,也能檢測到免疫抗體。因此,NH-GD試驗比RBT、SAT和FPA具有更強的鑒別診斷能力。
半抗原多糖(Native Hapten, NH),分子量小,無內毒素活性,位于布魯氏菌表面,與O鏈相互纏繞[4]。由于半抗原缺乏核心糖(N-formyperosamine)位點,且分子量小所以其免疫原性較低。有報道稱在S19疫苗免疫的動物血清中檢測不到半抗原多糖抗體的存在,所以NH抗原應該能夠鑒別野毒感染與疫苗免疫。由于NH抗原是布魯氏菌所特有的,因此利用NH半抗原構建的檢測方法,在鑒別假陽性方面有不錯的表現[5-6]。
NH-GD試驗與常規布病的血清學檢測方法相比,具有以下的優勢:首先操作技術和儀器設備簡單,結果可肉眼直觀,成本低;其次,NH-GD試驗具有鑒別布病感染抗體與S2、Rev.1疫苗免疫抗體的診斷能力,可以從免疫動物中篩選出布病感染動物。當然,NH-GD試驗也有不足,主要表現在以下兩方面:一是NH-GD敏感性低(75.4%),這與布魯氏菌產生的抗原刺激強弱有關[7],因此沒有出現NH沉淀帶不一定是布病陰性動物;二是布魯氏菌培養需要在符合生物安全三級(BSL-3)要求的實驗室中進行,多數地方不具備這個條件。
雖然NH-GD試驗的敏感性不具有太大的優勢,但其特異性非常高,且在S2和Rev.1免疫背景下,能夠鑒別布病感染抗體和疫苗免疫抗體。沒有一種實驗方法能夠達到100%的敏感性和特異性,因此可用敏感性高的RBT進行初篩實驗,再用特異性高的NH-GD試驗進行確診。兩種實驗方法的組合能夠更有效地從接種S2和Rev.1疫苗的羊群中鑒別出自然感染布魯氏菌的羊,便于布病防控措施的實施、及時切斷布病傳染源頭以控制或減少布病疫情的發生。綜上所述,NH-GD試驗是一個不錯的鑒別診斷方法,可以為布病防控政策“檢測-撲殺”的實施提供技術支持。
[1] Diaz R,Levieux D.Respective role in the serology of bovine Brucellosis antigens and of immuneglobulins G1and G2in the tests of agglutination of Coombs and of Rose Bengal and in the zone phenomenon[J].C R Acad Sci Hebd Seances Acad Sci D,1972,274(10):1593-1596.
[2] Marín CM,Moreno E,Moriyón I,et al.Performance of competitive and indirect enzyme-linked immunosorbent assays,gel immunoprecipitation with native hapten polysaccharide,and standard serological tests in diagnosis of sheep brucellosis[J].Clin Diagn Lab Immunol,1999,6(2):269-272.
[3] Diaz R,Toyos J,Salvó MD,et al.A simple method of the extraction ofBrucellacells for use in the radial immunodiffusion test diagnosis of bovine brucellosis[J].Ann Rech Vet,1981,12(1):35-39.
[4] Aragón V,Díaz R,Moreno E,et al.Characterization ofBrucellaabortus andBrucellamelitensisnative hapten as outer memberane O-type polysaccharides independent from the smooth lipopolysaccharide[J].J Bacteriol,1996,178(4):1070-1079.
[5] Ramírez-Pfeiffer C,Díaz-Aparicio E,Rodríguez-Padilla C,et al.Improved performance ofBrucellamelitensisnative hapten overBrucellaabortusOPS tracer on goat antibody detection by the fluorescence polarization assay[J].Vet Immunol Immunopathol,2008,123(3-4):223-229.
[6] Ramírez-Pfeiffer C,Díaz-Aparicio E,Gomez-Flores R,et al.Use of theBrucellamelitensisnative hapten to diagnose brucellosis in goats by a rapid, simple, and specific fluorescence polarization Assay[J].Clin Vaccine Immunol,2008,15(6):911-915.
[7] Diaz R,Toyos J,Salvo MD,et al.Studies on the polysaccharide B and native hapten ofBrucellaandYersiniaenterocoliticaserotype 9[J].Dev Biol Stand,1984,56:213-220.
Application of native hapten-gel diffusion test in differential diagnosis ofBrucella-infected antibody and S2 or Rev.1-vaccinated antibody
YANG Zhen,NI Bo,TIAN Li-li,FAN Wei-xing
(ChinaAnimalHealthAndEpidemiologyCenter,Qingdao266000,China)
The aim of the present study was to work on the efficiency of differential diagnosis of native hapten-gel diffusion assay (NH-GD) on the background of vaccination with S2 or Rev.1. The conditions of NH-GD assay was firstly optimized, its sensitivity, specificity, repeatability and ability of differential diagnosis were determined respectively, and its test result was compared with that of fluorescence polarization assay (FPA).The results showed NH-GD assay with good specificity and repeatability could differentiateBrucella-infected antibody from vaccinated antibody after vaccination with S2 or 122 days after vaccination with Rev.1.And the result of NH-GD assay was highly consistent with that of FPA ,which was simple to operate and needed a few simple equipment. Therefore, NH-GD assay was a good method for sheep brucellosis surveillance in China and especially suitable for application in grass-roots areas.
brucellosis;NH-GD;differential diagnosis
10.3969/j.issn.1002-2694.2017.02.007
范偉興,Email: fwxsjl@126.com
中國動物衛生與流行病學中心,青島 266000
R378
A
1002-2694(2017)02-0126-05
2016-11-12 編輯:李友松
現代農業(奶牛)產業技術體系建設項目專項經費(CARS-37)資助
優化NH-GD試驗條件,測定其敏感性、特異性、重復性及鑒別診斷能力,并與熒光偏振測定法(FPA)作比較。結果 NH-GD試驗具有很好的特異性和重復性,對S2免疫羊群從疫苗接種開始就具有鑒別診斷能力,而對Rev.1免疫羊群從疫苗接種122 d開始具有鑒別診斷能力;與FPA作比較,一致性較好,且操作技術和所需儀器都非常簡單,特別適合在基層推廣使用,為我國羊布病監測提供了一個很好的檢測方法。

