超聲波處理對牛血清白蛋白結(jié)構(gòu)和乳化性的影響
章 開,劉麗娟
(江西省腫瘤醫(yī)院,江西南昌 330029)
超聲波處理對牛血清白蛋白結(jié)構(gòu)和乳化性的影響
章 開,劉麗娟*
(江西省腫瘤醫(yī)院,江西南昌 330029)
采用圓二色譜(CD)、聚丙烯酰胺凝膠電泳(SDS-PAGE)、8-苯胺-1-萘磺酸(ANS)熒光探針及紫外(UV)光譜研究了不同超聲強度和處理時間對牛血清白蛋白(BSA)結(jié)構(gòu)和乳化性的影響。結(jié)果表明:超聲波處理對BSA的一級結(jié)構(gòu)無明顯影響,但對其二級結(jié)構(gòu)、三級結(jié)構(gòu)有顯著影響(p<0.05)。經(jīng)過超聲處理后,BSA中的α-螺旋明顯降低、β-折疊含量明顯增加、無規(guī)則卷曲總體上無顯著變化(p>0.05),β-轉(zhuǎn)角含量隨功率的增加而增大、隨超聲時間的延長先增加后減小,內(nèi)源性熒光強度、表面疏水性及乳化性均隨超聲處理強度和時間的延長呈先增加后降低的趨勢,當(dāng)超聲功率為240 W/cm2、超聲時間為10 min時,乳化活性(EAI)和乳化穩(wěn)定性(ESI)達到最大。這表明,超聲波處理是一種潛在改變BSA結(jié)構(gòu)與乳化性的方法,同時也為超聲處理在乳化蛋白時對蛋白的改性機理提供理論依據(jù)。
牛血清白蛋白,超聲波,結(jié)構(gòu)特性,乳化性
牛血清白蛋白(Bovine Serum Albumin,BSA)是牛血清中的一種球狀心形蛋白,包含583個氨基酸殘基,分子量為66.430 ku,等電點為4.7。BSA已經(jīng)成為研究蛋白質(zhì)理化性質(zhì)、生物學(xué)功能、蛋白質(zhì)與小分子相互作用以及相關(guān)小分子體內(nèi)代謝等方面的理想蛋白模型[1-3]。
超聲波是頻率范圍在104~1012Hz之間的彈性機械波,已被廣泛應(yīng)用于食品、化學(xué)、生物、醫(yī)學(xué)等方面,如食品殺菌、食品干燥、食品保藏、天然產(chǎn)物的提取以及食品生物分子的改性等[4]。超聲波具有集熱效應(yīng)、機械作用、剪切作用和空化作用為一體的特點,可以被食品吸收從而改變蛋白質(zhì)的結(jié)構(gòu)和功能性質(zhì)[5],如超聲波處理可以提高大豆蛋白的溶解性[6,7],改善花生分離蛋白的乳化性及改變其二級和三級結(jié)構(gòu)[8]等。
近年來,超聲波被廣泛運用于研究蛋白質(zhì)的理化性質(zhì)。超聲波處理增加BSA的粒徑,起泡性,減少自由巰基的含量[9-11]。超聲處理也會改變蛋白質(zhì)中色氨酸(Trp)殘基環(huán)境、蛋白質(zhì)分子的構(gòu)象[12],金屬離子的干擾,也會導(dǎo)致其熒光強度的降低[13]。Stathopulos等指出超聲波處理能夠?qū)е碌鞍踪|(zhì)中α-螺旋向β-折疊轉(zhuǎn)化,特別是本身具有大量α-螺旋結(jié)構(gòu)的蛋白質(zhì)[14]。早期的研究報道指出,在2 ℃超聲處理BSA中的α-螺旋含量將會增加;而將超聲過程的溫度控制在85 ℃時,α-螺旋含量則顯著降低[15]。超聲波也應(yīng)用于其他蛋白性質(zhì)的研究,如 Chen等采用超聲結(jié)合酶解的方法對大豆蛋白進行處理提高了其乳化性[16],Li等研究了多頻能量的超聲波促進大米蛋白的水解作用[17],超聲波還可促進蛋白質(zhì)的糖基化反應(yīng)從而改善蛋白質(zhì)的功能性質(zhì)[18-19]。本課題組前期采用氫氘交換質(zhì)譜法研究了高強度控溫超聲處理BSA結(jié)構(gòu)的變化,得到了超聲處理后BSA內(nèi)部結(jié)構(gòu)的變化[20],也采用超聲波預(yù)處理BSA,隨后使其與己糖(果糖、葡萄糖、甘露糖)進行糖基化反應(yīng),實驗結(jié)果表明糖基化程度有明顯的提高[21]。
本文研究了BSA經(jīng)過超聲處理前后的結(jié)構(gòu)及乳化性的變化,為進一步探討超聲處理在乳化蛋白時對蛋白的改性機理提供一定的實驗基礎(chǔ),為充分利用BSA這一潛在資源提供一定參考。
1 材料與方法
1.1 材料與儀器
BSA(含量≥98%) 購于美國Sigma公司;8-苯胺-1-萘磺酸(ANS)、電泳Marker(14.4~97.4 ku)、三(羥甲基)氨基甲烷(Tris)、十二烷基磺酸鈉(SDS)、β-巰基乙醇、甘油、溴酚藍等 購于索萊寶試劑有限公司;所有分離用有機溶劑 均為國產(chǎn)分析純。
Q700智能型超聲波破碎儀 美國Misonix公司;電泳儀、凝膠成像儀 美國BIO-RAD公司;F-7000熒光光譜儀、U-3200紫外光譜儀 日本日立公司;Bio-Logic MOS 450 CD圓二色譜儀 法國Bio-Logic公司。
1.2 實驗方法
1.2.1 BSA處理 用50 mmol/L,pH7.4的磷酸鹽緩沖液(phosphate buffer saline,PBS)配制BSA溶液10 mg/mL,使BSA完全溶解。采用超聲波破碎儀(探頭尺寸1/8”=3 mm)、工作頻率為20 kHz,超聲脈沖工作時間5 s,間歇時間5 s。按以下方法進行超聲強度和時間設(shè)計:取15 mL BSA溶液裝入25 mL燒杯中,超聲強度分別為0、60、90、120、180、240、300 W/cm2、在冰浴中處理5 min;取15 mL BSA溶液裝入25 mL燒杯中,超聲強度為90 W/cm2,超聲時間分別為0、1、3、5、10、20 min對BSA樣品進行處理。超聲處理結(jié)束后迅速冰浴冷卻,然后將超聲后的樣品冷凍干燥,儲藏在-20 ℃待用。
1.2.2 分子量分析 參照Zhang等[8]的方法,采用12%的分離膠,5%的濃縮膠,4×上樣緩沖液(含β-巰基乙醇),上樣量為10 μL,低分子質(zhì)量Marker(14.4~97.4 ku)。實驗初始電流為8 mA/板,進入分離膠后,調(diào)整為16 mA/板,分離后取出,用考馬斯亮藍G250染色30 min,然后于7%的冰乙酸中進行脫色,直至背景清晰。
1.2.3 圓二色譜分析 BSA的二級結(jié)構(gòu)采用Bio-Logic MOS 450圓二色譜儀進行測定。用PBS(50 mmol/L、pH7.4)稀釋不同超聲條件處理的BSA至0.2 mg/mL。參照Lucia等[22]的方法,測定條件:光徑0.1 cm樣品池,掃描速度100 nm/min,掃描范圍190~250 nm,帶寬1.0 nm。每個樣品測量三次,圓二色譜的測量值用橢圓率表示(θ;degree.cm2/dmol),最終結(jié)果通過圓二在線分析軟件dichroweb進行分析(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)。
1.2.4 內(nèi)源性熒光測定 用F-7000熒光光譜儀測定不同處理條件對BSA熒光強度的影響。參照Lucia等[22]的方法,測定條件:激發(fā)波長為280 nm,掃描發(fā)射波長范圍為30~500 nm,激發(fā)和發(fā)射的狹縫寬度均為1 nm,掃描速度為1200 nm/min,電壓為400 V。
1.2.5 表面疏水性測定 采用ANS熒光探針法測定不同超聲處理條件下BSA表面疏水性的變化。將蛋白樣品用PBS(50 mmol/L pH7.4)倍比稀釋成1、0.5、0.1、0.05、0.02 mg/mL。取2 mL稀釋后的蛋白樣品與20 μL 8 mmol/L ANS溶液(50 mmol/L,pH7.4)混合后,測定其熒光強度。測定條件:激發(fā)波長為380 nm,發(fā)射波長為400~500 nm,掃描速度為1200 nm/min,激發(fā)和發(fā)射的狹縫寬度均為2.5 nm,電壓為400 V。以蛋白濃度(mg/mL)為橫坐標(biāo),熒光強度為縱坐標(biāo)作圖,采用線性回歸分析進行曲線擬合,曲線的斜率即為蛋白樣品的表面疏水性(H0)[20]。
1.2.6 乳化性測定 乳化性測定依據(jù)Jamdar等人的方法[23],并稍作改動。取大豆油10 mL與30 mL濃度為1 mg/mL 的BSA溶液混合,然后用分散機以轉(zhuǎn)速10000 r/min分散2 min。分散結(jié)束后,立刻(0 min)從得到的溶液底部取50 μL乳濁液加至5 mL的0.1% SDS溶液中,混勻,在波長為500 nm處測定吸光值。10 min后,再從得到的溶液底部取50 μL乳濁液加至5 mL的0.1% SDS溶液中,混勻,測定吸光值。0 min時的吸光值為A0,10 min時的吸光值為A10,乳化性(EAI)和乳化穩(wěn)定性(ESI)的計算公式如下:
式中:A0指乳化后迅速被稀釋的乳化液的吸光度;m指蛋白質(zhì)量濃度(g/mL);ΔA=A0-A10,A10指乳化液在靜置10 min后的吸光度,Δt=10 min。
1.2.7 數(shù)據(jù)統(tǒng)計與分析 所有實驗重復(fù)3次,所得實驗數(shù)據(jù)采用Origin7.5軟件作圖,SPSS17.0軟件進行顯著性分析(p<0.05)。
2 結(jié)果與分析
2.1 分子量分析
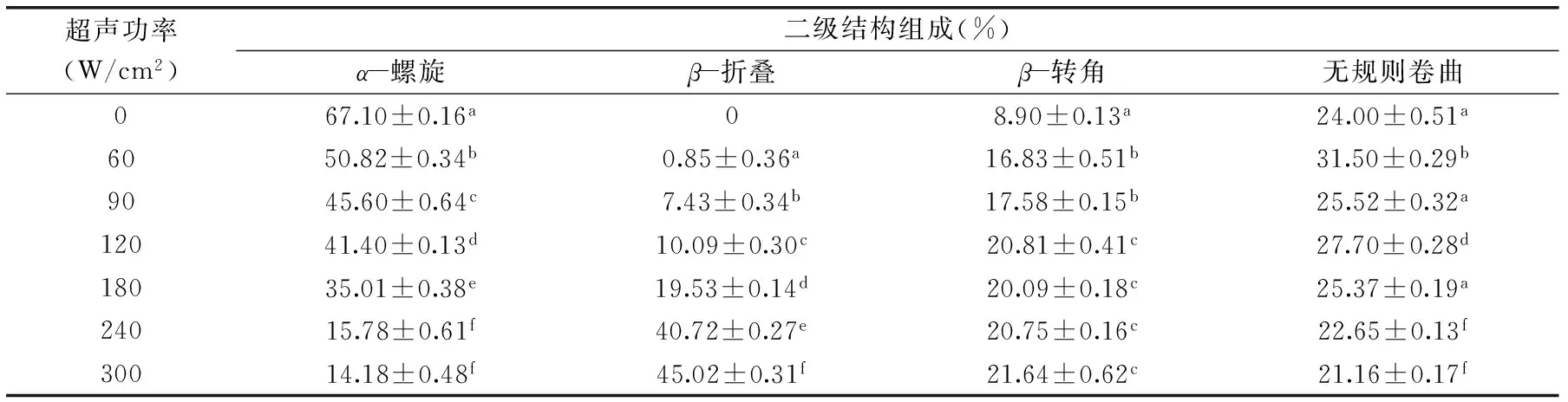
表1 超聲強度對BSA二級結(jié)構(gòu)各組分含量的影響(%)Table 1 Effect of ultrasound power on the content(%)of BSA secondary structure
注:實驗結(jié)果以平均值±標(biāo)準(zhǔn)偏差表示(n=3),同列不同小寫字母代表具有顯著性差異(p<0.05),超聲時間為5 min;表2同。
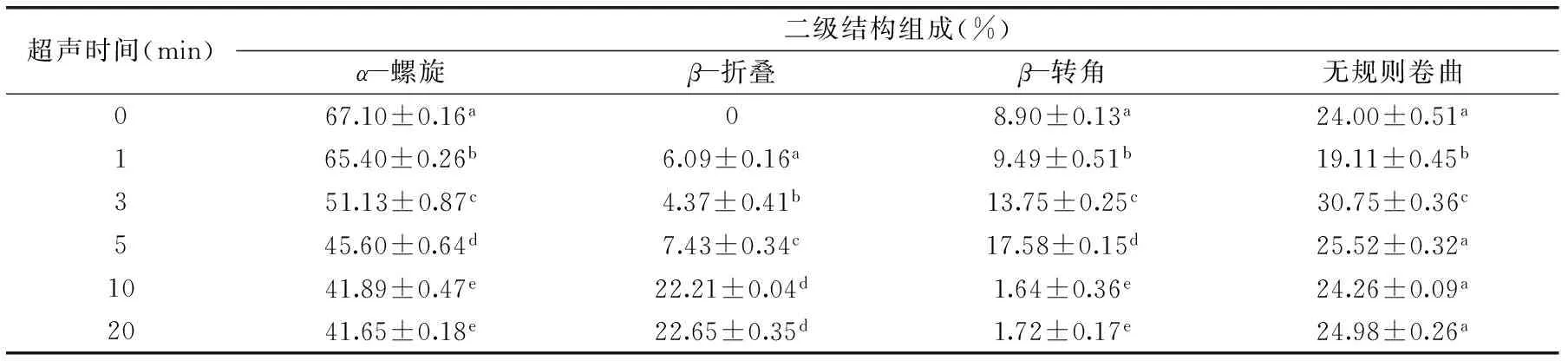
表2 超聲時間對BSA二級結(jié)構(gòu)各組分含量的影響(%)Table 2 Effect of ultrasound time on the content(%)of BSA secondary structure
注:超聲功率為90 W/cm2。
圖1為超聲處理對BSA分子量的影響,BSA由583個氨基酸組成,分子量為66.43 ku。與未處理的BSA相比,經(jīng)超聲處理的樣品電泳條帶無明顯變化,實驗表明BSA分別在超聲時間為5 min處理0~300 W/cm2,超聲功率為90 W/cm2處理0~20 min的條件下,BSA的分子量不會發(fā)生明顯改變。
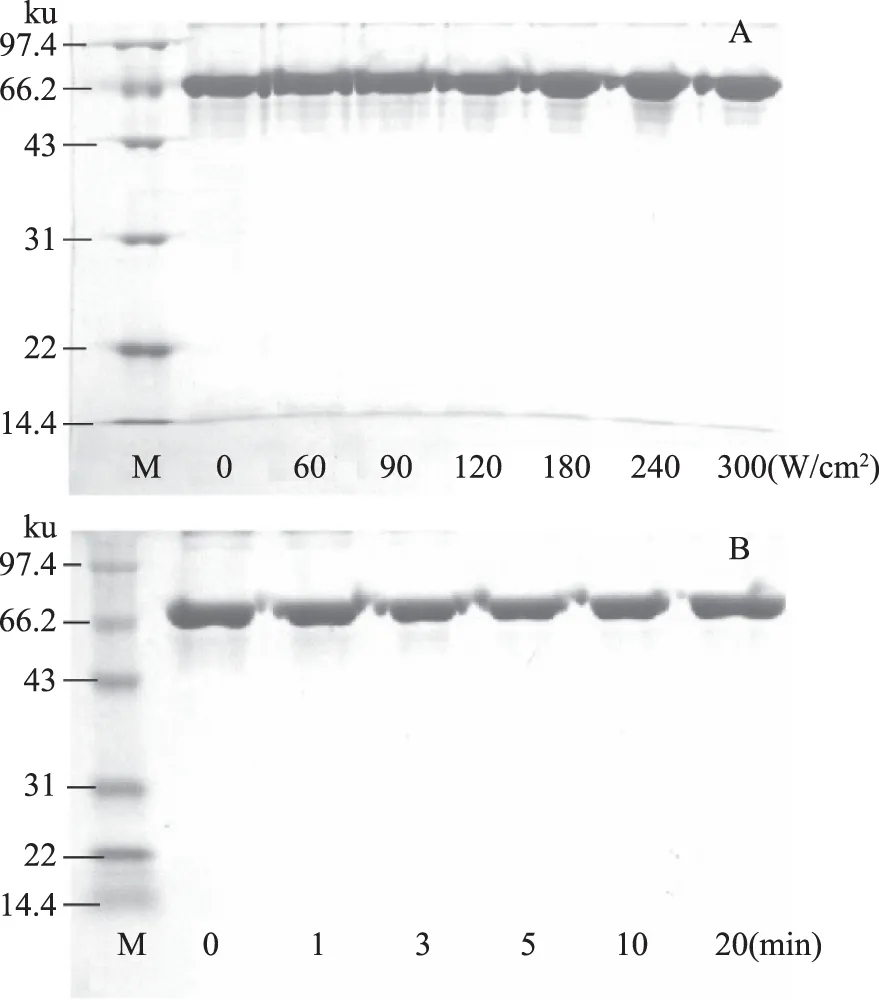
圖1 超聲處理對BSA分子量的影響Fig.1 The molecular weight of BSAin different ultrasound power
2.2 圓二色譜分析
Bio-Logic MOS 450圓二色譜儀可以用來測定BSA二級結(jié)構(gòu)中各組分的含量,解析超聲波對BSA二級結(jié)構(gòu)的影響。由表1可知,超聲波功率對BSA二級結(jié)構(gòu)有較大影響,其中β-折疊、β-轉(zhuǎn)角隨處理強度的延長呈增加的趨勢,而α-螺旋呈顯著下降的趨勢,含量從67.10%±0.16%下降到14.18%±0.48%。當(dāng)超聲功率為300 W/cm2、超聲時間為5 min時,β-折疊含量到達45.02%±0.31%。隨著超聲波功率的增加,BSA的β-轉(zhuǎn)角含量從8.90%±0.13%增加到21.64%±0.62%,無規(guī)則卷曲含量有先增加后減小的趨勢,總體上無顯著變化。
由表2可知,超聲時間對BSA二級結(jié)構(gòu)有較大的影響,其中α-螺旋呈顯著下降的趨勢,其含量從67.10%±0.16%下降到41.65%±0.18%;β-折疊隨處理時間的延長呈增加的趨勢,當(dāng)超聲功率為90 W/cm2、超聲時間為20 min時β-折疊含量到達22.65%±0.35%;β-轉(zhuǎn)角含量呈先增加后減小的趨勢,超聲時間10 min后其含量降低至1.64%±0.36%;無規(guī)則卷曲含量總體上無顯著變化。這可能是由于超聲波處理會破壞維持BSA高級結(jié)構(gòu)的次級鍵(如氫鍵、靜電相互作用、范德華力),從而導(dǎo)致結(jié)構(gòu)展開,β-折疊含量增加。總體而言,經(jīng)過超聲處理后,α-螺旋明顯降低,β-折疊含量明顯增加,β-轉(zhuǎn)角含量普遍先增加后減小,無規(guī)則卷曲總體上無顯著變化,初步認為超聲具有使α-螺旋向β-轉(zhuǎn)角和β-折疊轉(zhuǎn)化的趨勢,這與Liu等研究的結(jié)果趨勢一致[12]。
2.3 內(nèi)源性熒光分析
內(nèi)源熒光光譜是檢測BSA三級結(jié)構(gòu)的常用方法。BSA的內(nèi)源熒光主要來源于色氨酸(Trp),而熒光基團苯丙氨酸(Phe)和酪氨酸(Tyr)具有很低的量子產(chǎn)率,同時受到周圍氨基酸殘基的完全猝滅作用,導(dǎo)致Phe和Tyr對熒光的貢獻非常小[20],因此可以用Trp殘基作為BSA的內(nèi)源熒光探針來分析蛋白結(jié)構(gòu)的變化。圖2為不同條件超聲波處理對BSA內(nèi)源性熒光強度的影響。由圖2(A)可知,超聲時間為5 min時隨著超聲功率的增加,熒光強度呈先增大后降低的趨勢,在超聲功率為90 W/cm2熒光強度達到最大,說明此時超聲功率使BSA中的Trp殘基暴露于蛋白表面,致使其熒光強度增加。由圖2(B)可知,超聲功率為90 W/cm2時BSA的熒光強度隨超聲時間的延長,呈先增大后降低的趨勢,超聲時間3 min時BSA的熒光強度達到最大。這可能是由于BSA的電場作用使蛋白質(zhì)的靜電相互作用、氫鍵、疏水相互作用等發(fā)生變化,緊密的立體結(jié)構(gòu)變得松散,BSA中的兩個Trp殘基(Trp134和Trp213殘基)更多的暴露于極性環(huán)境中,從而熒光強度增加。而隨著處理功率和時間繼續(xù)延長,熒光強度呈降低的趨勢,這可能是因為超聲功率的增大和超聲時間的延長使BSA重新通過非共價鍵作用發(fā)生了部分折疊,暴露在蛋白表面的Trp134和Trp213殘基再次被掩埋到分子內(nèi)部,致使BSA的內(nèi)源性熒光強度降低。由圖2可以看出BSA最大發(fā)射波長并沒有發(fā)生明顯的紅移或藍移,表明本實驗的BSA處理僅使蛋白結(jié)構(gòu)發(fā)生了部分的展開或者折疊,并沒有使其結(jié)構(gòu)發(fā)生較大的改變。
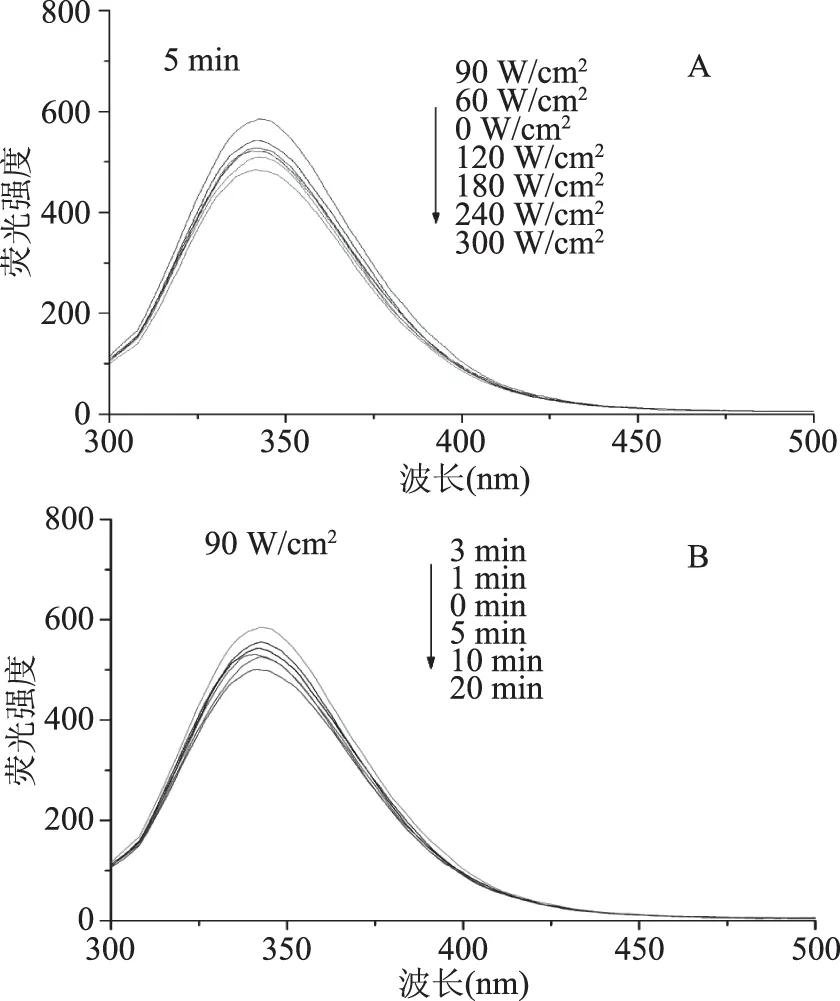
圖2 超聲波處理對BSA內(nèi)源性熒光強度的影響Fig.2 The intrinsic fluorescence intensity(A.U)of BSA in different ultrasound power
2.4 表面疏水性分析
蛋白質(zhì)的表面疏水性(H0)是蛋白質(zhì)表面與極性水溶液環(huán)境接觸的疏水基團數(shù)量的參數(shù)。如圖3所示為未經(jīng)超聲處理的BSA以及超聲處理后的BSA通過熒光發(fā)射光譜表現(xiàn)出來的表面疏水性。圖3(A)所示,超聲時間為5 min,不同超聲功率對BSA表面疏水性分析的影響,與未超聲的BSA相比,超聲處理后BSA的H0顯著增強。BSA的相對熒光強度隨超聲功率的增加先增加后減小,在超聲功率為240 W/cm2、超聲時間為5 min時H0達到最大;圖3(B)為超聲功率為90 W/cm2,不同超聲時間對BSA H0值的影響,與未超聲的BSA相比,超聲處理后BSA的H0增強。隨著超聲時間的增加,H0先增加后減小,在超聲功率90 W/cm2、超聲時間為10 min時H0達到最大,但超聲時間為3 min與5 min時,BSA的H0值無顯著變化。實驗表明:與未處理的BSA的H0相比,超聲后的H0均增加,不同的超聲波處理條件下,BSA的H0增加程度不同。H0值的顯著增加很有可能是因為原來埋藏在BSA內(nèi)部的疏水區(qū)域更多的暴露于蛋白質(zhì)表面[8],也可能是蛋白質(zhì)分子發(fā)生折疊或伸展有關(guān),當(dāng)?shù)鞍渍郫B時,其表面疏水性降低;當(dāng)?shù)鞍咨煺箷r,表面疏水性增加[24]。本實驗結(jié)果表明隨超聲功率的增大、超聲時間的延長,BSA的表面疏水性表現(xiàn)出先增強后有減弱的趨勢。
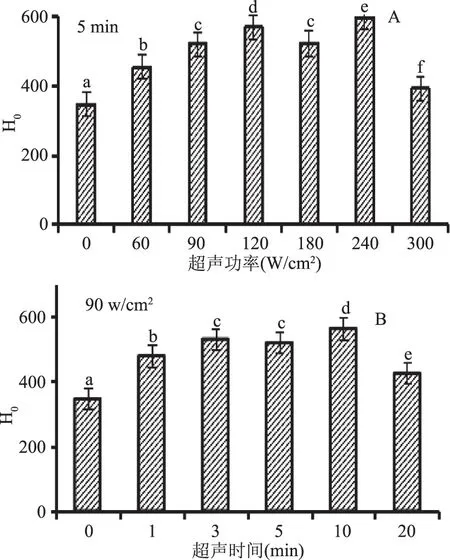
圖3 超聲波處理對BSA表面疏水性的影響Fig.3 The surface hydrophobicity of BSA in different ultrasound power
2.5 乳化性分析
乳化性表示單位質(zhì)量蛋白質(zhì)的界面穩(wěn)定性,用以描述蛋白質(zhì)溶液與油/水形成乳化液的界面性能。食品中蛋白質(zhì)的乳化性一般通過乳化活性(EAI)和乳化穩(wěn)定性(ESI)來評價。圖4(A)為超聲時間5 min,不同的超聲功率對BSA溶液的乳化性和乳化穩(wěn)定性的影響。結(jié)果表明,隨超聲功率的增加,EAI和ESI顯著增加后又降低,當(dāng)超聲功率60~120 W/cm2時,ESI無顯著變化,達到240 W/cm2時,EAI、ESI值達到最大。這可能是由于超聲的作用使蛋白分子的空間結(jié)構(gòu)被破壞,使蛋白分子部分展開,結(jié)構(gòu)變得疏松,更多的分子聚集到油-水界面上,也可能是超聲波產(chǎn)生的瞬時高溫改變蛋白質(zhì)的粒度、溶解性等[25],從而提高了蛋白的乳化性,但功率增大時乳化性能有所下降,這可能是因為超聲強度過大,蛋白質(zhì)變性增大,造成了蛋白質(zhì)的聚集[7,16]。
圖4(B)為超聲功率90 W/cm2,不同的超聲時間對BSA溶液的乳化性和乳化穩(wěn)定性的影響,結(jié)果顯示:隨超聲時間的延長,EAI、ESI值呈遞增趨勢,當(dāng)超聲時間為10 min時,EAI、ESI值達到最大,但總體變化不顯著。這可能是在一定超聲時間范圍內(nèi),蛋白質(zhì)結(jié)構(gòu)變得疏松,可溶性蛋白含量增加,乳化活性和乳化穩(wěn)定性從而增強,但當(dāng)超聲時間過長,蛋白質(zhì)變性增大,不溶性蛋白質(zhì)含量增多,乳化活力及乳化穩(wěn)定性隨之降低[26]。此外,蛋白質(zhì)的乳化性與其表面疏水性存在著正相關(guān)的關(guān)系[8],當(dāng)超聲時間為5 min、超聲強度逐漸增大至240 W/cm2和超聲強度90 W/cm2、超聲時間逐漸延長至10 min時,蛋白質(zhì)的表面疏水性均達到最大,促使蛋白質(zhì)分子與水形成油-水界面膜,但隨著超聲強度與時間的增加使得蛋白質(zhì)表面疏水性降低,使蛋白質(zhì)分子與水不易形成油-水界面膜,從而使得蛋白質(zhì)乳化性能降低。結(jié)果表明:與未處理的BSA乳化性相比,超聲后的乳化性均呈現(xiàn)增加的趨勢,BSA隨超聲處理強度的增大、處理時間的延長,其EAI值和ESI值表現(xiàn)出先增強后減弱的趨勢。
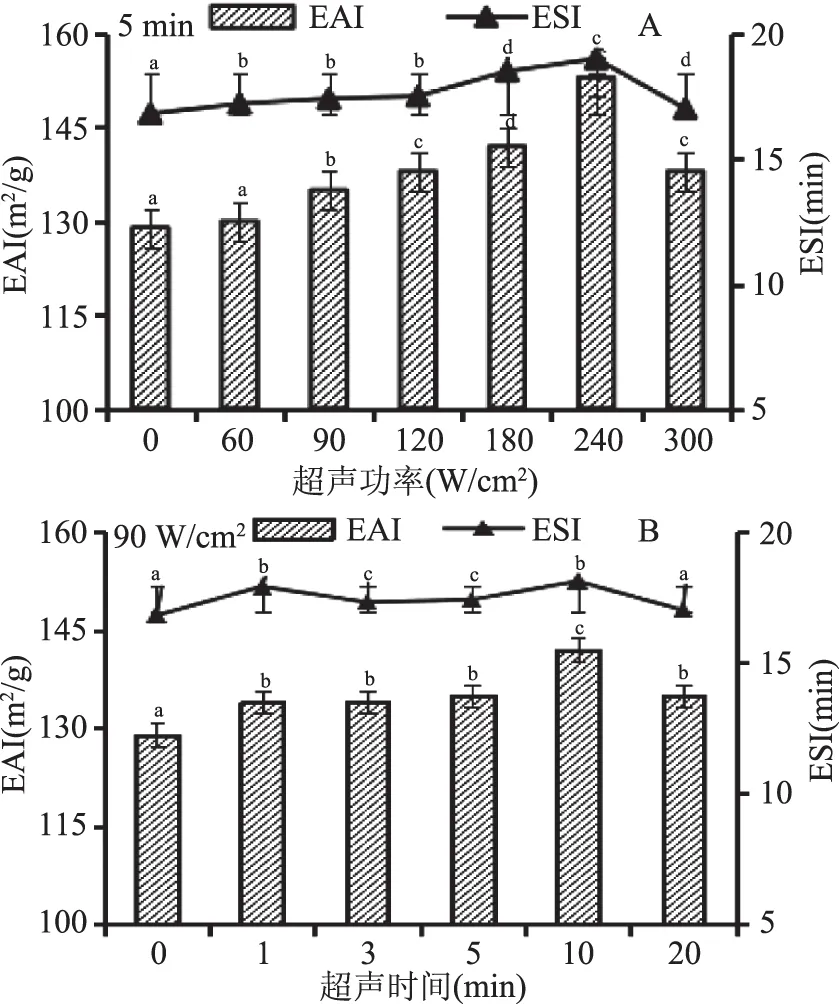
圖4 超聲波處理對BSA乳化性和乳化穩(wěn)定性的影響Fig.4 The emulsifying properties(EAI and ESI)of BSA in different ultrasound power注:A為超聲功率,B為超聲時間。
3 結(jié)論
超聲處理對BSA的一級結(jié)構(gòu)無顯著影響,而對其二、三級結(jié)構(gòu)有顯著影響。經(jīng)超聲處理后的BSA,α-螺旋含量顯著降低,β-轉(zhuǎn)角與β-折疊含量增加,說明超聲作用可使分子內(nèi)部氫鍵的排列取向發(fā)生改變,使多肽鏈中α-螺旋結(jié)構(gòu)伸展而變成線性結(jié)構(gòu),而無規(guī)則卷曲則可能是因其柔性更大,受超聲作用的影響不大,所以含量無顯著變化。經(jīng)超聲處理后的BSA內(nèi)源熒光強度、表面疏水性及乳化活性與未超聲處理的BSA相比,均顯著增加,其趨勢先增加后減小,這些變化說明超聲作用引起了蛋白分子構(gòu)象的變化,可能是因為超聲誘導(dǎo)蛋白質(zhì)三級結(jié)構(gòu)發(fā)生展開,從而引起原來埋藏在蛋白質(zhì)內(nèi)部的疏水基團更多地暴露于蛋白質(zhì)表面;也可能是超聲作用影響了蛋白質(zhì)的二級結(jié)構(gòu),從而破壞其緊密結(jié)構(gòu),導(dǎo)致蛋白質(zhì)的乳化性增加。結(jié)果表明:超聲波為改性蛋白質(zhì)的結(jié)構(gòu)提供了一種有效的方法,超聲波改變蛋白質(zhì)的結(jié)構(gòu),從而改善蛋白質(zhì)的乳化性。這為進一步探討超聲處理在乳化蛋白時對蛋白的改性機理提供一定的理論基礎(chǔ)。
[1]Ojha B,Das G. The interaction of 5-(alkoxy)naphthalen-1-amine with bovine serum albumin and its effect on the conformation of protein[J]. The Journal of Physical Chemistry B,2010,114(11):3979-3986.
[2]Ni Y,Wang S,Kokot S. Spectrometric study of the interaction between Alpinetin and bovine serum albumin using chemometrics approaches[J]. Analytica Chimica Acta,2010,663(2):139-146.
[3]Zhang X,Li L,Xu Z,et al. Investigation of the interaction of naringin palmitate with bovine serum albumin:spectroscopic analysis and molecular docking[J]. Plos One,2013,8(3):e59106.
[4]Song X,Zhou C,Fu F,et al. Effect of high-pressure homogenization on particle size and film properties of soy protein isolate[J]. Industrial Crops and Products,2013,43:538-544.
[5]Jeantet R,Baron F,Nau F,et al. High intensity pulsed electric fields applied to egg white:effect on Salmonella enteritidis inactivation and protein denaturation[J]. Journal of Food Protection?,1999,62(12):1381-1386.
[6]Legay M,Gondrexon N,Le Person S,et al. Enhancement of heat transfer by ultrasound:review and recent advances[J]. International Journal of Chemical Engineering,2011.
[7]Hu H,Wu J,Li-Chan E C,et al. Effects of ultrasound on structural and physical properties of soy protein isolate(SPI)dispersions[J]. Food Hydrocolloids,2013,30(2):647-655.
[8]Zhang Q,Tu Z,Xiao H,et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing,2014,92(1):30-37.
[9]Povey M J,Moore J D,Braybrook J,et al. Investigation of bovine serum albumin denaturation using ultrasonic spectroscopy[J]. Food Hydrocolloids,2011,25(5):1233-1241.
[11]郭玲,劉愛國,胡志和,等. 牛血清白蛋白的乳化和起泡特性[J]. 食品科學(xué),2010(19):137-140.
[12]劉斌,馬海樂,李樹君,等. 應(yīng)用 FTIR 研究超聲對牛血清白蛋白二級結(jié)構(gòu)的影響[J]. 光譜學(xué)與光譜分析,2010(8):2072-2076.
[13]陳芳,陳妍,張彥崢,等. 牛血清白蛋白的熒光穩(wěn)定性研究[J]. 應(yīng)用化工,2011,40(9):1508-1511.
[14]Stathopulos P B,Scholz G A,Hwang Y M,et al. Sonication of proteins causes formation of aggregates that resemble amyloid[J]. Protein Science,2004,13(11):3017-3027.
[16]Chen L,Chen J,Ren J,et al. Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2600-2609.
[17]Li S,Yang X,Zhang Y,et al. Effects of ultrasound and ultrasound assisted alkaline pretreatments on the enzymolysis and structural characteristics of rice protein[J]. Ultrasonics Sonochemistry,2016,31:20-28.
[18]De Castro M L,Priego-Capote F. Ultrasound-assisted crystallization(sonocrystallization)[J]. Ultrasonics Sonochemistry,2007,14(6):717-724.
[19]Villamiel M,Verdurmen R,Jong P D. Degassing of milk by high-intensity ultrasound[J]. Milchwissenschaft,2000,55(3):123-125.
[20]Zhang Q,Tu Z,Wang H,et al. Structural changes of ultrasonicated bovine serum albumin revealed by hydrogen-deuterium exchange and mass spectrometry[J]. Analytical and Bioanalytical Chemistry,2014,406(28):7243-7251.
[21]Zhang Q,Tu Z,Wang H,et al. Improved glycation after ultrasonic pretreatment revealed by high-performance liquid chromatography-linear Ion trap/orbitrap high-resolution mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2014,62(12):2522-2530.
[22]de la Hoz L,Netto F M. Structural modifications ofβ-lactoglobulin subjected to gamma radiation[J]. International Dairy Journal,2008,18(12):1126-1132.
[23]Jamdar S N,Rajalakshmi V,Pednekar M D,et al. Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J]. Food Chemistry,2010,121(1):178-184.
[24]Wang X,Tang C,Li B,et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids,2008,22(4):560-567.
[25]Yu J,Ahmedna M,Goktepe I. Peanut protein concentrate:Production and functional properties as affected by processing[J]. Food Chemistry,2007,103(1):121-129.
[26]Jambrak A R,Lelas V,Mason T J,et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering,2009,93(4):386-393.
Effect of ultrasound treatment on structure and emulsibilities of bovine serum albumin
ZHANG Kai,LIU Li-juan*
(Tumor Hospital of Jiangxi Province,Nanchang 330029,China)
The effect of ultrasound treated power and time on the structure and emulsibilities of bovine serum albumin(BSA)was studied by CD spectra,SDS-PAGE,ANS fluorescence probe emission spectra and UV absorption spectra. The results showed that ultrasound treatment had no significant influence on primary structure of BSA. However,it had a significant effect on secondary structure,tertiary structure. The content ofα-helix were decreased. The content ofβ-sheet was increased. The content ofβ-turn firstly increased and then decreased with the increasing of ultrasound treatment,unordered had no significant change. Intrinsic fluorescence intensity,surface hydrophobicity and emulsibility were firstly increased and then decreased with the increasing of ultrasound treated power and time. The EAI and ESI of BSA reached the maximun when it was treated at 240 W/cm2for 10 min. It indicated that the ultrasound treatment would become a potential method for changing structure and emulsibilities of BSA. Meanwhile,when protein was emulsified by ultrasound treatment,it also provide a theoretical basis for the study of the mechanism of ultrasonic modification of protein.
bovine serum albumin;ultrasound;structure property;emulsibility
2016-07-20
章開(1991-),女,碩士研究生,研究方向:藥品食品分析,E-mail:jun898989@foxmail.com。
*通訊作者:劉麗娟(1979-), 女,博士,副主任藥師,研究方向:藥品研發(fā),E-mail:liu_lijuanpharm@163.com。
國家自然科學(xué)基金項目(81260337)。
TS201.2
A
:1002-0306(2017)04-0116-06
10.13386/j.issn1002-0306.2017.04.014

