轉(zhuǎn)基因大豆DAS444066多重?zé)晒舛縋CR檢測(cè)方法的建立
付 偉,任 嬌,魏 霜,袁俊杰,周廣彪,吳希陽(yáng),朱水芳,劉中勇,*
(1.中國(guó)檢驗(yàn)檢疫科學(xué)研究院,北京 100176;2.汕頭出入境檢驗(yàn)檢疫局,廣東汕頭 515041;3.湛江出入境檢驗(yàn)檢疫局,廣東湛江 835000;4.暨南大學(xué)理工學(xué)院食品科學(xué)與工程系,廣東廣州 510632)
付 偉1,任 嬌2,魏 霜2,袁俊杰3,周廣彪2,吳希陽(yáng)4,朱水芳1,劉中勇2,*
(1.中國(guó)檢驗(yàn)檢疫科學(xué)研究院,北京 100176;2.汕頭出入境檢驗(yàn)檢疫局,廣東汕頭 515041;3.湛江出入境檢驗(yàn)檢疫局,廣東湛江 835000;4.暨南大學(xué)理工學(xué)院食品科學(xué)與工程系,廣東廣州 510632)
本文針對(duì)大豆內(nèi)源基因Lectin和轉(zhuǎn)基因大豆DAS44406-6品系的5′端插入位點(diǎn)序列,設(shè)計(jì)特異性引物及探針,建立同時(shí)檢測(cè)轉(zhuǎn)基因大豆DAS44406-6品系和大豆內(nèi)源基因Lectin的多重?zé)晒舛縋CR方法,并運(yùn)用15種轉(zhuǎn)基因大豆、3種轉(zhuǎn)基因玉米、1種轉(zhuǎn)基因油菜、1種轉(zhuǎn)基因水稻和非轉(zhuǎn)基因大豆對(duì)該方法進(jìn)行特異性評(píng)價(jià),并分析該方法的靈敏度和穩(wěn)定性。結(jié)果顯示,該方法能準(zhǔn)確從20種轉(zhuǎn)基因樣品和1種非轉(zhuǎn)基因樣品中檢出靶目標(biāo),檢測(cè)結(jié)果與待檢樣品信息一致,表明本方法具有良好的特異性;靈敏度高達(dá)0.01%;重復(fù)性實(shí)驗(yàn)表明DAS81419品系4種含量、9次重復(fù)反應(yīng)Ct值的標(biāo)準(zhǔn)偏差介于0.050~0.222,相對(duì)標(biāo)準(zhǔn)偏差介于0.169%~0.677%,均在可接受范圍內(nèi)。該方法特異性強(qiáng)、靈敏度高、穩(wěn)定性強(qiáng),適用于各口岸實(shí)驗(yàn)室進(jìn)行轉(zhuǎn)基因大豆DAS44406-6的快速、準(zhǔn)確的檢測(cè)。
多重?zé)晒舛縋CR,轉(zhuǎn)基因大豆DAS44406-6,檢測(cè)
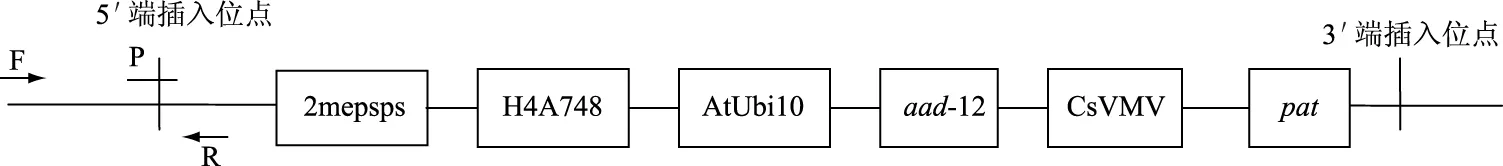
圖1 轉(zhuǎn)基因大豆DAS44406-6外源插入片段示意圖及特異性引物探針位點(diǎn)Fig.1 Insertion scheme of GM soybean DAS44406-6 and the corresponding location of specific primer and probe
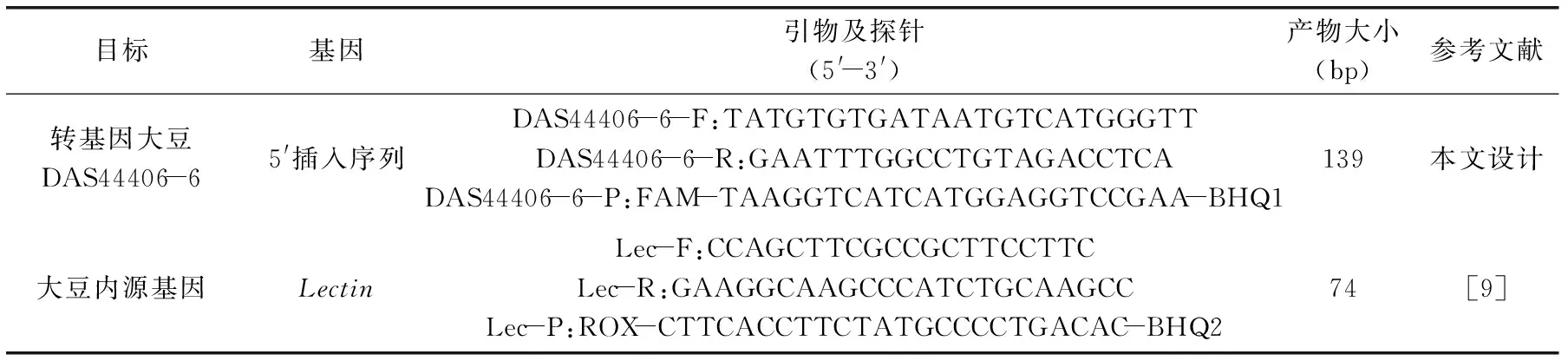
表1 引物探針序列Table 1 Sequence of primers and probes
自1996年轉(zhuǎn)基因作物開(kāi)始商業(yè)化種植以來(lái),每年都以驚人的速度發(fā)展。2015年全球轉(zhuǎn)基因作物的種植面積為1.797億公頃,與1996年的170萬(wàn)公頃相比增加了100倍,而轉(zhuǎn)基因大豆是種植面積最大的轉(zhuǎn)基因作物[1]。中國(guó)是大豆和大豆產(chǎn)品進(jìn)口國(guó),國(guó)內(nèi)需求量不斷增加引起轉(zhuǎn)基因大豆進(jìn)口量屢創(chuàng)新高[2]。2002年,我國(guó)農(nóng)業(yè)部發(fā)布《農(nóng)業(yè)轉(zhuǎn)基因生物標(biāo)識(shí)管理辦法》及衛(wèi)生部出臺(tái)《轉(zhuǎn)基因食品衛(wèi)生管理辦法》,規(guī)定轉(zhuǎn)基因食品必須強(qiáng)制性的進(jìn)行轉(zhuǎn)基因標(biāo)識(shí)[3]。正因如此,對(duì)轉(zhuǎn)基因大豆檢測(cè)技術(shù)的要求也越來(lái)越高。
目前為止,被批準(zhǔn)進(jìn)入中國(guó)的轉(zhuǎn)基因大豆品系只有10種(A2704-12、A5547-127、CV127、DP305423、DP305423×GTS40-3-2、DP356043、GTS40-3-2、MON87701、MON87701×MON89788、MON89788),轉(zhuǎn)基因大豆DAS44406-6沒(méi)有獲得我國(guó)批準(zhǔn)。轉(zhuǎn)基因大豆DAS44406-6是美國(guó)陶氏益農(nóng)公司研發(fā)的抗除草劑轉(zhuǎn)基因大豆,主要含有3個(gè)抗除草劑基因2mepsps、pat、aad-12,能同時(shí)耐受草銨膦、草甘膦和2,4-D除草劑。然而,目前我國(guó)沒(méi)有轉(zhuǎn)基因大豆DAS44406-6的檢測(cè)標(biāo)準(zhǔn)方法,不利于口岸實(shí)驗(yàn)室開(kāi)展非法轉(zhuǎn)基因品系的把關(guān)檢測(cè)。因此,建立轉(zhuǎn)基因大豆DAS44406-6的檢測(cè)方法具有相當(dāng)?shù)囊饬x。
轉(zhuǎn)基因大豆的檢測(cè)方法主要是基于核酸的檢測(cè)技術(shù),主要有PCR法[4-5]、多重PCR[6-7]、熒光定量PCR法[8]、數(shù)字PCR[9]、芯片法[10]、等溫?cái)U(kuò)增法[11-13]等。其中熒光定量PCR技術(shù)具有快速、靈敏、準(zhǔn)確、污染少、無(wú)需凝膠電泳等優(yōu)點(diǎn),被廣泛應(yīng)用于轉(zhuǎn)基因大豆成分的定量檢測(cè),并且歐盟轉(zhuǎn)基因標(biāo)準(zhǔn)及我國(guó)出入境檢驗(yàn)檢疫行業(yè)標(biāo)準(zhǔn)和國(guó)家標(biāo)準(zhǔn)也均采用該方法進(jìn)行檢測(cè)[14-15]。此外,轉(zhuǎn)基因大豆成分DAS44406-6實(shí)際檢測(cè)中,通常需要同時(shí)檢測(cè)大豆內(nèi)源基因,而多重PCR能在同一反應(yīng)體系中復(fù)合擴(kuò)增,可高效同時(shí)檢測(cè)出多個(gè)基因,方便快捷。因此,本研究旨在建立一套同時(shí)檢測(cè)轉(zhuǎn)基因大豆DAS44406-6和大豆內(nèi)源基因Lectin的單管多重?zé)晒舛縋CR,為出入境檢驗(yàn)檢疫口岸實(shí)驗(yàn)室轉(zhuǎn)基因大豆檢測(cè)提供新思路,為加強(qiáng)轉(zhuǎn)基因產(chǎn)品監(jiān)管力度提供技術(shù)支持。
1 材料與方法
1.1 材料與儀器
轉(zhuǎn)基因大豆GTS40-3-2、A2704-12、MON89788、A5547-127、DP-356043-5、CV127、MON87708、FG72、DAS44406-6、DAS68416、MON87701、MON87705、DP-305423-1、MON87769、DAS81419,轉(zhuǎn)基因玉米BT176、MON810、T25,轉(zhuǎn)基因油菜GT73,轉(zhuǎn)基因水稻TT51-5,非轉(zhuǎn)基因大豆 上述樣品均保存于中國(guó)檢驗(yàn)檢疫科學(xué)研究院;TaqMan? Universal PCR Master Mix 美國(guó)ABI公司。
Roche Lightcycler 480熒光定量PCR儀 瑞士Roche公司;NanoDrop核酸蛋白分析儀 美國(guó)Thermo公司。
1.2 實(shí)驗(yàn)方法
1.2.1 基因組DNA的提取 采用CTAB法[16]提取1.1中轉(zhuǎn)基因和非轉(zhuǎn)基因樣品的基因組DNA,提取后取1 μL用核酸蛋白分析儀測(cè)定提取的基因組DNA的濃度和純度,用TE將所有樣品標(biāo)定至100 ng/μL,保存于-20 ℃待用。
1.2.2 引物及探針 根據(jù)轉(zhuǎn)基因大豆DAS44406-6的5′端插入序列設(shè)計(jì)引物和探針,引物和探針位點(diǎn)如圖1所示,將設(shè)計(jì)的引物和探針在NCBI中進(jìn)行比對(duì),確定引物和探針的理論特異性,大豆內(nèi)源基因引物和探針參考文獻(xiàn)。上述所有引物及探針由生工生物工程(上海)股份有限公司合成(見(jiàn)表1)。
1.2.3 多重?zé)晒舛縋CR反應(yīng)體系 多重?zé)晒舛縋CR反應(yīng)體系包括2×TaqMan? Universal Master Mix 10 μL,各引物終濃度均為0.4 μmol/L,各探針終濃度均為0.2 μmol/L,DNA模板100 ng,ddH2O補(bǔ)足至20 μL。反應(yīng)程序?yàn)?50 ℃ UNG酶處理2 min;95 ℃預(yù)變性10 min;95 ℃15 s,60 ℃ 1 min,40個(gè)循環(huán),每個(gè)循環(huán)結(jié)束后收集熒光信號(hào)。
1.2.4 多重?zé)晒舛縋CR特異性實(shí)驗(yàn) 以1.2.1提取的15種轉(zhuǎn)基因大豆、3種轉(zhuǎn)基因玉米、1種轉(zhuǎn)基因油菜、1種轉(zhuǎn)基因水稻的基因組DNA為模板,并以非轉(zhuǎn)基因大豆的基因組DNA為模板作為陰性對(duì)照,按照1.2.3的反應(yīng)體系及程序進(jìn)行熒光定量PCR擴(kuò)增。同時(shí)以轉(zhuǎn)基因大豆DAS44406-6歐盟標(biāo)準(zhǔn)方法[14]中的引物和探針作為特異性驗(yàn)證的陽(yáng)性對(duì)照。
1.2.5 多重?zé)晒舛縋CR靈敏度測(cè)試 以1.2.1提取的轉(zhuǎn)基因大豆DAS44406-6和非轉(zhuǎn)基因大豆的基因組DNA為材料,按照一定的體系分?jǐn)?shù)進(jìn)行混合,分別配制成轉(zhuǎn)基因大豆含量為100%、10%、1%、0.1%、0.01%、0.001%的樣品,以1.2.3的反應(yīng)體系進(jìn)行多重?zé)晒舛縋CR,每個(gè)濃度梯度重復(fù)3次,以確定本方法檢測(cè)方法的靈敏度。
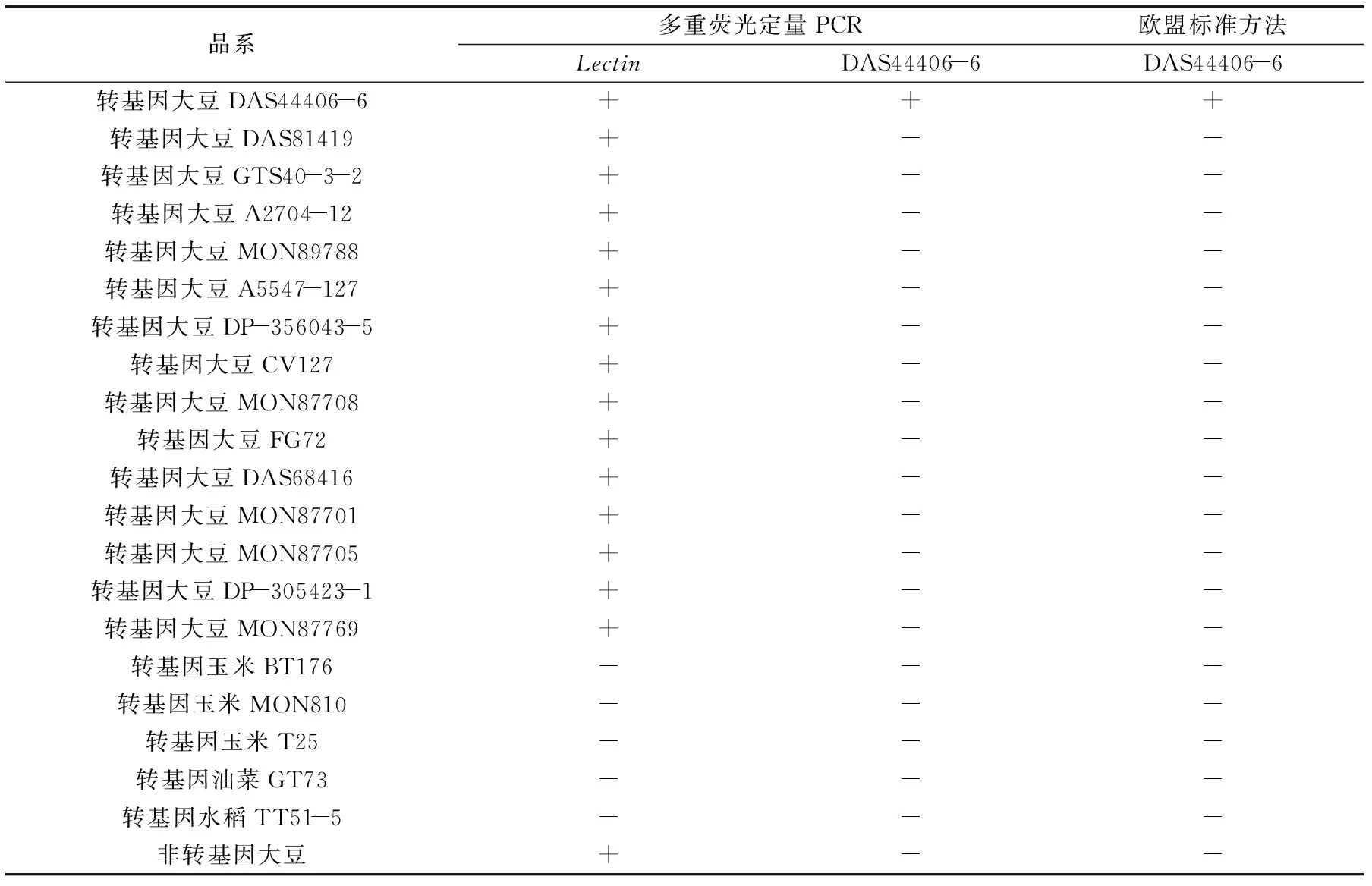
表2 多重?zé)晒舛縋CR特異性驗(yàn)證Table 2 Specificity test of the multiplex real-time PCR
注:+代表陽(yáng)性,-代表陰性。
1.2.6 多重?zé)晒舛縋CR重復(fù)性實(shí)驗(yàn) 對(duì)1.2.5種配置成的轉(zhuǎn)基因大豆含量為100%、10%、1%、0.1%的樣品,以1.2.3的反應(yīng)體系進(jìn)行多次熒光定量PCR,每個(gè)濃度重復(fù)9次,計(jì)算這4個(gè)濃度、每個(gè)濃度9次重復(fù)的標(biāo)準(zhǔn)偏差(SD)和相對(duì)標(biāo)準(zhǔn)偏差(RSD),進(jìn)行統(tǒng)計(jì)學(xué)分析。
2 結(jié)果與分析
2.1 多重?zé)晒舛縋CR的建立
調(diào)整2對(duì)引物和探針的濃度,引物濃度調(diào)整范圍為0.5、0.4、0.3、0.2 μmol/L,探針濃度調(diào)整范圍為0.2、0.15、0.1、0.05 μmol/L,最終確定2對(duì)引物的濃度均為0.4 μmol/L,2條探針的濃度均為0.1 μmol/L,建立了多重?zé)晒舛縋CR檢測(cè)轉(zhuǎn)基因大豆DAS44406-6,結(jié)果如圖2所示,2個(gè)基因均順利擴(kuò)增,陰性對(duì)照無(wú)擴(kuò)增。
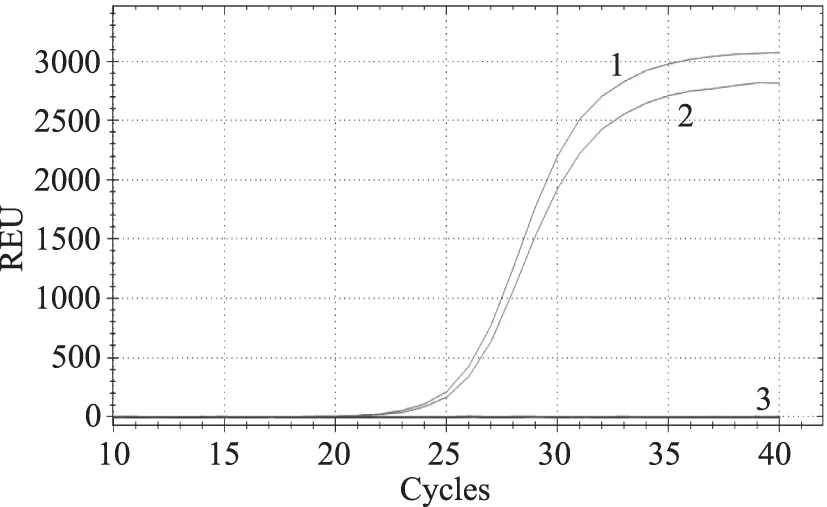
圖2 多重?zé)晒舛縋CR的建立Fig.2 Establish of the multiplex real-time PCR
2.2 多重?zé)晒釶CR特異性實(shí)驗(yàn)
結(jié)果如表2所示,所有的轉(zhuǎn)基因大豆和非轉(zhuǎn)基因大豆樣品Lectin基因結(jié)果均為陽(yáng)性,其余樣品Lectin基因結(jié)果均為陰性;僅有轉(zhuǎn)基因大豆DAS44406-6樣品出現(xiàn)DAS44406-6品系特異性陽(yáng)性結(jié)果,其余樣品均為陰性,品系特異性結(jié)果與歐盟標(biāo)準(zhǔn)方法一致。上述結(jié)果表明本研究建立的多重?zé)晒舛縋CR檢測(cè)方法對(duì)大豆內(nèi)源基因Lectin及轉(zhuǎn)基因大豆DAS44406-6品系均表現(xiàn)高特異性。

表3 多重?zé)晒舛縋CR體系的重復(fù)性實(shí)驗(yàn)Table 3 Reproducible test of the multiplex real-time PCR
2.3 多重?zé)晒釶CR靈敏度測(cè)試
如圖3所示,當(dāng)模板含量為100%~0.001%時(shí),大豆內(nèi)源基因Lectin以及轉(zhuǎn)基因大豆DAS44406-6品系均可觀察到擴(kuò)增曲線(xiàn),且模板含量與Ct值成比例關(guān)系,當(dāng)模板含量為100%~0.01%時(shí),每個(gè)含量的2個(gè)基因、3次重復(fù)均能順利擴(kuò)增,而當(dāng)模板含量為0.001%時(shí),均無(wú)擴(kuò)增,因此本方法同時(shí)檢出Lectin內(nèi)源基因以及DAS44406-6品系的最低檢出限為0.01%。許多國(guó)家實(shí)施轉(zhuǎn)基因食品標(biāo)識(shí)管理制度,將轉(zhuǎn)基因食品和傳統(tǒng)食品區(qū)分開(kāi)來(lái),從而保障消費(fèi)者的知情權(quán)和選擇權(quán),并且規(guī)定食品中含有的轉(zhuǎn)基因生物成分不能超過(guò)一定的閾值。不同國(guó)家對(duì)轉(zhuǎn)基因標(biāo)識(shí)閾值規(guī)定不同,例如歐盟為0.9%(轉(zhuǎn)基因成分來(lái)源獲得歐盟批準(zhǔn))和0.5%(轉(zhuǎn)基因成分來(lái)源未獲得歐盟批準(zhǔn))[17];巴西、澳大利亞、捷克、沙特阿拉伯、以色列為1%[18];瑞士、韓國(guó)為3%[19];日本、俄羅斯、泰國(guó)、中國(guó)臺(tái)灣地區(qū)為5%[20]。標(biāo)識(shí)管理制度能否有效實(shí)施依賴(lài)于轉(zhuǎn)基因產(chǎn)品檢測(cè)技術(shù),這就要求對(duì)轉(zhuǎn)基因產(chǎn)品的檢測(cè)技術(shù)要能夠進(jìn)行精確定量。本研究中轉(zhuǎn)基因大豆DAS44406-6和大豆內(nèi)源基因Lectin的擴(kuò)增條件一致,且檢測(cè)靈敏度可以達(dá)到0.01%,完全可以滿(mǎn)足國(guó)際上對(duì)轉(zhuǎn)基因食品檢測(cè)低限的要求。
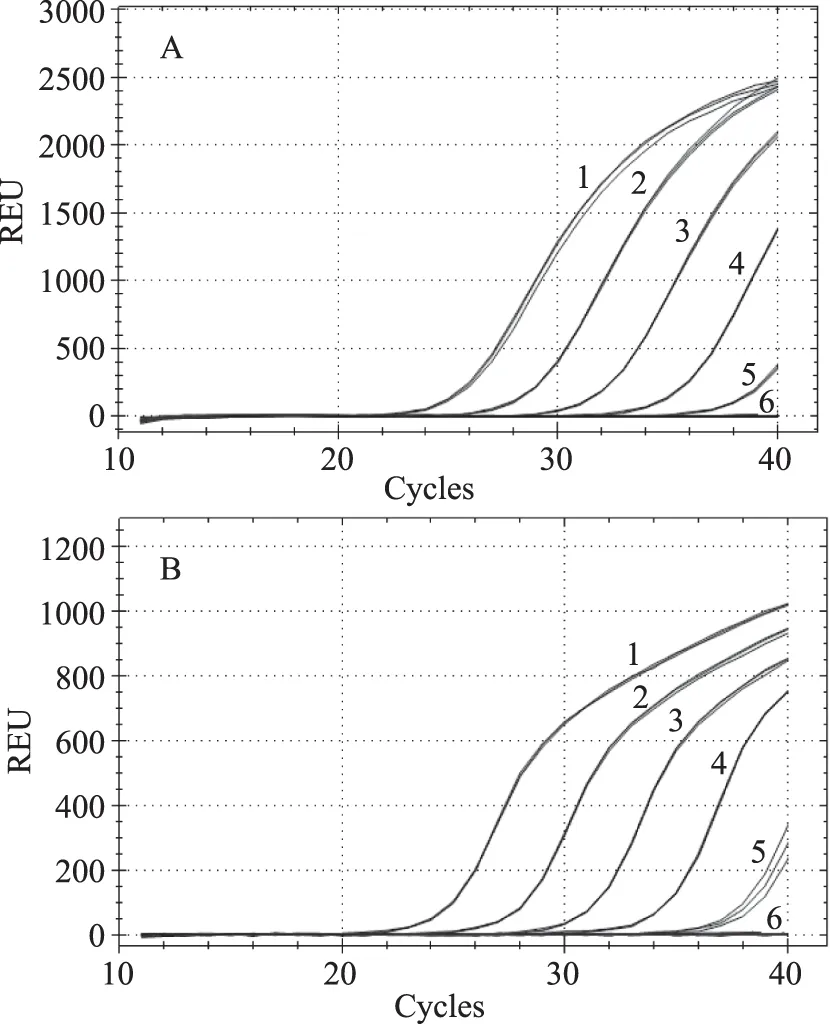
圖3 多重?zé)晒舛縋CR靈敏度測(cè)試Fig.3 Sensitivity test of the multiplex real-time PCR
2.4 多重?zé)晒釶CR重復(fù)性測(cè)試
對(duì)100%、10%、1%、0.1%轉(zhuǎn)基因大豆DAS44406-6共4個(gè)含量,每個(gè)濃度9次重復(fù)的擴(kuò)增結(jié)果進(jìn)行分析。結(jié)果表明,Lectin基因4種含量、9次重復(fù)反應(yīng)Ct值的標(biāo)準(zhǔn)偏差介于0.064~0.095,相對(duì)標(biāo)準(zhǔn)偏差介于0.204%~0.295%;DAS81419品系4種含量、9次重復(fù)反應(yīng)Ct值的標(biāo)準(zhǔn)偏差介于0.050~0.222,相對(duì)標(biāo)準(zhǔn)偏差介于0.169%~0.677%,均在可接受范圍內(nèi)[17-20],表明本研究建立檢測(cè)方法具有比較好的可重復(fù)性。
3 結(jié)論
針對(duì)目前我國(guó)沒(méi)有建立標(biāo)準(zhǔn)的轉(zhuǎn)基因大豆DAS44406-6,采用大豆內(nèi)源基因Lectin作為指示PCR反應(yīng)假陽(yáng)性的有效方式,針對(duì)大豆內(nèi)源基因Lectin和轉(zhuǎn)基因大豆DAS44406-6品系的5′端插入位點(diǎn)序列,設(shè)計(jì)特異性引物及探針,建立一種多重?zé)晒舛縋CR方法,在單一反應(yīng)管內(nèi)同時(shí)檢測(cè)轉(zhuǎn)基因大豆DAS44406-6和大豆內(nèi)源基因Lectin兩種基因,并運(yùn)用15種轉(zhuǎn)基因大豆、3種轉(zhuǎn)基因玉米、1種轉(zhuǎn)基因油菜、1種轉(zhuǎn)基因水稻和非轉(zhuǎn)基因大豆對(duì)該方法進(jìn)行特異性評(píng)價(jià),靈敏度高達(dá)0.01%,重復(fù)性實(shí)驗(yàn)表明DAS81419品系4種含量、9次重復(fù)反應(yīng)Ct值的標(biāo)準(zhǔn)偏差介于0.050~0.222,相對(duì)標(biāo)準(zhǔn)偏差介于0.169%~0.677%,均在可接受范圍內(nèi),該方法提高了轉(zhuǎn)基因檢測(cè)效率,有較好的推廣和應(yīng)用前景。
[1]Clive James. 2015年全球生物技術(shù)/轉(zhuǎn)基因作物商業(yè)化發(fā)展態(tài)勢(shì)[J]. 中國(guó)生物工程雜志,2016,36(4):1-11.
[2]崔寧波,張正巖. 轉(zhuǎn)基因大豆研究及應(yīng)用進(jìn)展[J]. 西北農(nóng)業(yè)學(xué)報(bào),2016,26(8):1-13.
[3]中華人民共和國(guó)農(nóng)業(yè)部. 農(nóng)業(yè)轉(zhuǎn)基因生物標(biāo)識(shí)管理辦法[Z].北京:中華人民共和國(guó)農(nóng)業(yè)部,2002.
[4]呂山花,常汝鎮(zhèn),陶波,等. 抗草甘膦轉(zhuǎn)基因大豆PCR檢測(cè)方法的建立與應(yīng)用[J]. 中國(guó)農(nóng)業(yè)科學(xué),2003(8):883-887.
[5]Gachet E,Martin G G,Vigneau F,et al. Detection of genetically modified organisms(GMOs)by PCR:a brief review of methodologies available[J]. Trends in Food Science & Technology,1998,9(11):380-388.
[6]Sint D,Raso L,Traugott M. Advances in multiplex PCR:balancing primer efficiencies and improving detection success[J]. Methods in Ecology and Evolution,2012,3(5):898-905.
[7]魏霜,陳貞,蘆春斌,等. 多重PCR檢測(cè)轉(zhuǎn)基因水稻的轉(zhuǎn)基因成分[J]. 食品科學(xué),2012(12):159-162.
[8]王渭霞,賴(lài)?guó)P香,洪利英,等. 實(shí)時(shí)定量PCR檢測(cè)轉(zhuǎn)基因水稻科豐6號(hào)插入拷貝數(shù)和轉(zhuǎn)基因含量[J]. 農(nóng)業(yè)生物技術(shù)學(xué)報(bào),2012(1):9-15.
[9]Fu W,Zhu P,Wang C,et al. A highly sensitive and specific method for the screening detection of genetically modified organisms based on digital PCR without pretreatment[J]. Scientific Reports,2015,5.
[10]Fu W,Wang H,Wang C,et al. A high-throughput liquid bead array-based screening technology for Bt presence in GMO manipulation[J]. Biosensors and Bioelectronics,2016,77:702-708.
[11]朱琳峰,彭煥,黃文坤,等. 抗草甘膦轉(zhuǎn)基因大豆Cp4-epsps基因快速簡(jiǎn)便的LAMP檢測(cè)方法[J]. 植物保護(hù),2015(3):86-92.
[12]Huang S,Xu Y,Yan X,et al. Development and application of a quantitative loop-mediated isothermal amplification method for detecting genetically modified maize MON863[J]. Journal of the Science of Food and Agriculture,2015,95(2):253-259.
[13]Xu J,Zheng Q,Yu L,et al. Loop-mediated isothermal amplification(LAMP)method for detection of genetically modified maize T25[J]. Food Science & Nutrition,2013,1(6):432-438.
[14]http://gmo-crl.jrc.ec.europa.eu/summaries/EURL-VL-0112%20VR_Final.pdf[OL].
[15]中國(guó)檢驗(yàn)檢疫科學(xué)研究院. 植物及其加工產(chǎn)品中轉(zhuǎn)基因成分實(shí)時(shí)熒光PCR定性檢驗(yàn)方法[S].
[16]王永,蘭青闊,張莉,等. 改良Chelex-100法和CTAB法用于轉(zhuǎn)基因抗草甘膦大豆檢測(cè)效果的比較[J]. 大豆科學(xué),2008(5):898-901.
[17]The European Parliament and the Council of the European Union. Regulation(EC)No 1829/2003 of the European Parliament and of the Council of 22 September 2003 on genetically modified food and feed[J]. Official Journal of the European Communities,2003(L268):1-23.
[18]趙將,生吉萍. 轉(zhuǎn)基因食品標(biāo)識(shí)的問(wèn)題與困惑[J]. 中國(guó)農(nóng)業(yè)大學(xué)學(xué)報(bào),2015,20(3):1-8.
[19]Chung S A,Francom M G,Ting K. 韓國(guó)農(nóng)業(yè)生物技術(shù)年報(bào)(2011年)[J]. 生物技術(shù)進(jìn)展,2013,1:15.
[20]金蕪軍,賈士榮,彭于發(fā). 不同國(guó)家和地區(qū)轉(zhuǎn)基因產(chǎn)品標(biāo)識(shí)管理政策的比較[J]. 農(nóng)業(yè)生物技術(shù)學(xué)報(bào),2004,12(1):1-7.
Multiplex real-time PCR for the detection of genetically modified soybean DAS44406-6
FU Wei1,REN Jiao2,WEI Shuang2,YUAN Jun-jie3,ZHOU Guang-biao2,WU Xi-yang4,ZHU Shui-fang1,LIU Zhong-yong2,*
(1.Chinese Academy of Inspection and Quarantine,Beijing 100176,China;2.Shantou Entry-Exit Inspection and Quarantine Bureau,Shantou 515041,China;3.Department of Food Science and Engineering,College of Science and Technology,Jinan University,Zhanjiang 835000,China;4.Zhanjiang Entry-Exit Inspection and Quarantine Bureau,Guangzhou 510632,China)
Specific primers and probes based on the 5′ flanking sequence of exogenous fragments of genetically modified(GM)soybean DAS44406-6 and endogenousLectingene of soybean were designed. A multiplex real-time PCR for the detection of GM soybean DAS44406-6 and endogenousLectingene of soybean simultaneously had been developed. The specificity,sensitivity and stability of this method had been tested by 15 GM soybean,3 GM maize,1 GM rape,1 GM rice and 1 non-GM soybean. Results indicated that this multiplex real-time PCR method could accurately detect target from 20 GM samples and 1 non-GM sample,which was in accordance to the predicted results.. The sensitivity of this method was 0.01%. The repeatability test showed that the standard deviation(SD)of the Ct value ranged from 0.050 to 0.222 and the relative standard deviation(RSD)ranged from 0.169% to 0.677% of the 9 replicates about 4 concentration DNA templates,which were all in acceptable range. In conclusion,this multiplex real-time PCR method was high specific,sensitive and reliable,and would be an effective tool for the detection of GM DAS44406-6 in the laboratory of CIQ(China entry-exit inspection and quarantine bureau,CIQ).
multiplex real-time PCR;genetically modified soybean DAS44406-6;detection
2016-08-09
付偉(1983-),女,博士,副研究員,研究方向:轉(zhuǎn)基因生物安全,E-mail:fuwei0212@163.com。
*通訊作者:劉中勇(1962-),男,本科,研究員,研究方向:生物安全,E-mail:liuzy@cichk.com.hk。
廣東省科技計(jì)劃項(xiàng)目(2014A040401029);轉(zhuǎn)基因產(chǎn)品抽制樣和精準(zhǔn)檢測(cè)技術(shù)(2016ZX08012-001);廣州市科技計(jì)劃項(xiàng)目(2014J4100105)。
TS214
A
:1002-0306(2017)04-0063-05
10.13386/j.issn1002-0306.2017.04.003

