MRS在界定腦膠質瘤病理級別和病變范圍中的診斷價值
王新偉 趙智偉
1)河南平頂山市第一人民醫院神經外科 平頂山 467000 2)河南科技大學第一附屬醫院康復科 洛陽 437000
MRS在界定腦膠質瘤病理級別和病變范圍中的診斷價值
王新偉1)趙智偉2)
1)河南平頂山市第一人民醫院神經外科 平頂山 467000 2)河南科技大學第一附屬醫院康復科 洛陽 437000
目的 探討氫質子磁共振波譜成像(MRs)在界定腦膠質瘤病理級別和病變范圍中的診斷價值。方法 回顧分析2013-11—2016-09經臨床或病理證實為腦腫瘤的患者25例,包含低級別膠質瘤10例與高級別膠質瘤15例,對所有患者實施MRS鑒別,分析其鑒別情況。結果 所有腫瘤患者的實質中心區與正常者相比均表現出N-乙酰天門冬氨酸(NAA)與肌酸(Cr)降低,而膽堿復合物(Cho)峰升高,出現高級別膠質瘤7例;不同腫瘤患者實質中心區、囊變區及瘤周水腫區的NAA/Cho值均低于正常值,差異均有統計學意義(P<0.05);高級別膠質瘤實質中心區、囊變區及瘤周水腫區間的NAA/Cho值比較,差異有統計學意義(P<0.05);轉移瘤實質中心區、囊變區及瘤周水腫區的NAA/CHO值兩兩比較,差異均有統計學意義(P<0.05);低級別膠質瘤與高級別膠質瘤間的實質中心區、囊變區及瘤周水腫區NAA/Cho值比較,差異均有統計學意義(P<0.05)。結論 MRS可較準確界定腦膠質瘤侵潤邊界,值得普及。
MRS;腦膠質瘤;病變范圍
MRS能夠無創性檢查人體病變代謝,且能夠無創量化人體內腦代謝物,腦腫瘤不同部位所產生代謝物的量與種類均不相同,通過MRS檢測能夠將這些差異進行有效區分。對膠質瘤侵潤邊界的鑒別與診斷是臨床上的難點,而膠質瘤是常見的顱內腫瘤,區分瘤體與正常組織的邊界對于手術切除的徹底性和正常組織及功能的保護性均有重大臨床意義[1]。本文研究MRS在界定腦膠質瘤邊界中的診斷價值,現報道如下。
1 資料與方法
1.1 一般資料 選取2013-11—2015-09經臨床或病理證實為腦腫瘤患者25例,男14例,女11例;年齡16~65(41.5±3.2)歲;其中低級膠質瘤10例,高級膠質瘤 15例。在接受MRS檢查之前,所有患者均未接受任何顱內手術、化療或放療等治療。
1.2 方法 選擇西門子1.5T超導MR儀,頭部正交線圈,對全部患者實施MRI平掃橫斷和冠狀、矢狀掃描。掃描參數,SE序列T1WI為TR/TE:500/8.7 ms,層厚5 mm,間距2 mm,FOV 208×230 mm,矩陣372×512。T2WI為TR/TE:5 000/100 ms,層厚5 mm,間距2 mm,FOV 207×230 mm,陣矩404×640,T2Flair序列TR/TE:9 000/102 ms,反轉時間(T1)為2 500 ms,層厚5 mm,間距2 mm,FOV 208 mm×230 mm,矩陣418×512。常規進行MRI增強掃描,掃描參數:SE序列T1WI為為TR/TE:500/8.7 ms,層厚5 mm,間距2 mm。依據病灶特點選擇腫瘤最大層面作MRS定位像,分別對對應的腫瘤實體部位、囊變部位、瘤周水腫和對側相應的正常組織部位等實施掃描,從而得到相應部位MRS圖像。興趣區要盡量避開顱骨、脂肪及含氣組織,以保證譜線的質量,掃描采用多體素檢查技術,點分辨波譜(point resolved spectroscopy,PRESS)序列,TR 1 500 ms,TE 35 ms,層厚為10 mm,掃描前手動勻場,波譜采集時間為7 min 12 s。
1.3 數據分析 分析采取雙盲法,由2名具有豐富臨床經驗的診斷醫師對25例患者的腦腫瘤實體區、囊變區、瘤周水腫區以及對側部位的正常組織MRI圖像進行區分與分析。
1.4 觀察指標 觀察腫瘤實體區、囊變區、水腫區的N-乙酰天門冬氨酸(NAA)、肌酸(cr)、膽堿復合物(Cho)及Lip等,并計算NAA/Cho值。
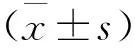
2 結果
全部患者的實質中心區與正常者相比NAA與Cr降低,而Cho峰升高,出現Lip峰的7例全部為高級別膠質瘤;腫瘤患者實質中心區、囊變區及瘤周水腫區的NAA,Cho值均低于正常值,差異均有統計學意義(P<0.05);高級別膠質瘤實質中心區、囊變區及瘤周水腫區間的NAA/Cho值比較,差異有統計學意義(P<0.05);低級別膠質瘤與高級別膠質瘤間的實質中心區、囊變區及瘤周水腫區NAA/Cho值比較,差異均有統計學意義(P<0.05)。見表l。
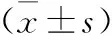
表1 高級別膠質瘸、低級別膠質瘤及轉移瘸中不同區域MRS檢查的NAA/Cho值比較
3 討論
膠質瘤作為常見的原發性顱內腫瘤,其惡性程度不同,影像表現也會有所不同,且膠質瘤周圍往往伴有不同程度的水腫,水腫帶對于區分正常腦組織與病變腦組織具有重要臨床意義。臨床常將高級別膠質瘤和低級別膠質瘤混淆,對臨床治療產生影響,常規MRI檢查一般有較好的多方位成像與軟組織分辨能力,這一點對鑒別與診斷有一定貢獻,但在膠質瘤的級別及病變界限鑒別還是未能達到理想效果[1]。
MRS是一種無創性的檢查技術,可以反映組織器官的代謝信息,同時能夠在波譜圖中體現出來。NAA是神經元標志物的一種,一般存在神經元中,如果檢測區的NAA峰值下降,間接表明檢測區的神經元細胞質量或數量發生了一定的變化[2]。當腦組織出現病變時,神經元細胞會出現不同程度受損或是被病變組織替代,NAA、Cr及Cho的峰形和波峰高度也會出現相應的變化[2]。
Bradac等[3]研究認為,腦膠質瘤能夠破壞正常的神經元細胞,而NAA大量集中在神經元細胞中,膠質瘤病理級別越高,對神經元的破壞程度就越強,NAA減少往往提示腫瘤性病變。Cr在能量代謝活躍的膠質瘤中可作為供能原料,且Cr含量與膠質瘤級別呈負相關,即隨著膠質瘤級別的增高,細胞代謝和增殖就會越旺盛,大量消耗Cr,導致Cr值下降。Delorme等[4]研究表明,膠質瘤中正常的白質纖維束減少,因此NAA降低。低分化的膠質瘤的Cho峰較高而NAA峰較低,且Cho值與腫瘤間變程度正相關。Li等[5]研究表明,Cr、NAA值增高有利于區分良、惡性膠質瘤。Ⅱ級膠質瘤內的Cr、NAA值較Ⅲ級膠質瘤增高[6],原因可能是Cr、NAA在腦膠質瘤中存在的特點所決定。
膠質瘤因其起源于腦組織,所以含有不同量的神經元細胞,高級別膠質瘤一般伴隨瘤周水腫和壞死囊變,而神經元含量在實體區、囊變區及周圍水腫區內不同,表現為Cho峰、NAA峰、Lip峰和正常腦組織比較有差異,一般表現為Cho增高、NAA下降及Lip峰異常[7]。腫瘤內神經細胞的含量會伴隨膠質瘤級別升高而減少,NAA/Cr、Cho/NAA、Cho/Cr等比值在高級別膠質瘤與低級別膠質瘤中有明顯區別。我們的研究表明實質中心區、囊變區及瘤周水腫區的NAA,Cho值均低于正常值,差異均有統計學意義(P<0.05);高級別膠質瘤實質中心區、囊變區及瘤周水腫區間的NAA/Cho值比較,差異有統計學意義(P<0.05);低級別膠質瘤與高級別膠質瘤間的實質中心區、囊變區及瘤周水腫區NAA/Cho值比較,差異均有統計學意義(P<0.05)。出現Lip峰的7例全部為高級別膠質瘤,提示NAA/Cr與腫瘤級別具有相關性。隨著膠質瘤的惡性病變,反映神經元質量和數量的NAA峰會顯著下降,Cho則升高,且可發生Lip峰異常增高。發生以上原因可能與腫瘤的級別有關,隨著腫瘤級別的增高,其囊變壞死就越明顯,殘存的正常神經元就越少,且高度惡性伴壞死的腫瘤一般會出現典型的Lip峰,一些低級別腫瘤中也有可能出現這種情況。
[1] Zakaria R,Das K,Radon M,et al.Diffusion-weighted MRI characteristics of the cerebral metastasis to brain boundary predicts patient outcomes[J].BMC medical imaging,2014,14(1):26-30.
[2] Dou W,Zhang M,Zhang X,et al.Convex-Envelope Based Automated Quantitative Approach to Multi-Voxel 1 H-MRS Applied to Brain Tumor Analysis[J].PLoS One,2015,10(9):e0 137 850.
[3] Bradac O,Vrana J,Jiru F,et al.Recognition of anaplastic foci within low-grade gliomas using MR spectroscopy[J].British journal of neurosurgery,2014,28(5):631-636.
[4] Delorme S,Weber MA.Applications of MRS in the evaluation of focal malignant brain lesions[J].Cancer imaging:the official publication of the International Cancer Imaging Society,2006,6(1):95-99.
[5] Li X,Lu Y,Pirzkall A,et al.Analysis of the spatial characteristics of metabolic abnormalities in newly diagnosed glioma patients[J].Journal of magnetic resonance imaging:JMRI,2002,16(3):229-237.
[6] Guisado DI,Singh R.A Novel Methodology for Apply-ing Multivoxel MR Spectroscopy to Evaluate Convec-tion-Enhanced Drug Delivery in Diffuse Intrinsic Pontine Gliomas[J].AJNR Am J Nearoradiol,2016,37(7):1 367-1 373.
[7] Sauwen N,Adou M,Van Cauter S,et al.Comparison of unsupervised classification methods for brain tumor segmentation using multi-parametric MRI[J].NeuroImage Clinical,2016,12(1):753-64.
(收稿2016-04-28)
R739.41
B
1673-5110(2017)04-0083-03

