鹿茸水提物對四氯化碳致小鼠肝損傷的防護作用研究
覃燕妮
(廣西壯族自治區南寧市中醫醫院,廣西 南寧 530001)
鹿茸水提物對四氯化碳致小鼠肝損傷的防護作用研究
覃燕妮
(廣西壯族自治區南寧市中醫醫院,廣西 南寧 530001)
目的 研究鹿茸水提物對四氯化碳(CCl4)所致小鼠急性化學性肝損傷的防護作用及機制。方法 將SPF級昆明種小鼠分為正常組、模型組、鹿茸水提物高劑量組(40 g/kg)、鹿茸水提物中劑量組(20 g/kg)、鹿茸水提物低劑量組(10 g/kg)及聯苯雙酯組(200 mg/kg)。正常組和模型組以生理鹽水灌胃,鹿茸水提物各劑量組和聯苯雙脂組分別給予相應藥物,連續給藥7 d,每天1次。采用ELISA試劑盒測定各組小鼠丙氨酸氨基轉移酶(ALT)、天門冬酸氨基轉移酶(AST)、超氧化物歧化物(SOD)、丙二醛(MDA)、還原型谷胱甘肽(GSH)和谷胱甘肽過氧化物酶(GSH-PX)的含量。采用ELISA試劑盒測定小鼠血清中炎癥因子腫瘤壞死因子-α(TNF-α)、單核細胞趨化蛋白(MCP-1)、白細胞介素-6(IL-6)含量,采用熒光定量PCR法測定炎癥因子TNF-α,MCP-1,IL-6的基因表達水平。采用HE染色法觀察各組小鼠肝細胞損傷程度。結果 鹿茸水提物高劑量組能明顯降低肝損傷小鼠血清的AST及ALT活性(P<0.01),還能顯著提高肝組織中SOD,GSH和GSH-PX的活性(P<0.05或 P<0.01),并降低MDA含量,降低炎癥因子TNF-α,MCP-1,IL-6含量和基因表達。HE染色結果表明鹿茸能減輕CCl4誘導的小鼠急性肝損傷。結論 鹿茸對CCl4誘導的小鼠急性肝損傷具有一定防護作用,其作用機制可能是通過清除自由基,抑制脂質過氧化,還可能通過減少炎癥反應,從而減輕肝損傷。
鹿茸;四氯化碳;肝損傷;小鼠
近年來,越來越多的毒物或藥物引起肝損傷,雖然治療方法在不斷發展,但并未得到根本解決,肝損傷的防治依然是一個世界性嚴峻課題。鹿茸為鹿科動物梅花鹿 Cervus Nippon Temminck var.mantchuricus Swinhoe或馬鹿 Cervus elaphus L.尚未骨化的幼角,是傳統中醫的名貴中藥,具有廣泛的藥理作用,如調節心血管、強壯、性激素樣、促進創傷愈合、抗衰老等[1]。但鹿茸抗肝損傷作用及作用機理,目前尚不十分清楚。本研究中對鹿茸抗肝損傷作用及作用機理進行了研究,旨在闡明鹿茸新的藥理作用,為充分開發鹿茸新的藥用價值,研制開發鹿茸抗肝損傷新藥提供理論基礎。現報道如下。
1 材料與方法
1.1 動物、材料與儀器
1.1.1 動物
SPF級雄性昆明種小鼠,體質量(20±2)g,由廣西醫科大學實驗動物中心提供,動物合格證編號為SCXK桂2014-0002,動物使用許可證號為SYXK桂2014-0053。
1.1.2 藥物與試劑
鹿茸水提物由廣西醫科大學藥理教研室自行提取;四氯化碳(CCl4,成都市科龍化工試劑廠,批號為20150965);聯苯雙酯滴丸(廣西星群藥業股份有限公司,批號為HF40038);天門冬酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)、超氧化物歧化酶(SOD)和丙二醛(MDA)試劑盒,均由南京建成生物工程研究所提供,批號為20150527。
1.1.3 儀器
TU-1901型雙光束紫外-可見分光光度計(北京普析通用儀器有限責任公司);EL204型電子天平(上海梅特勒-托多利多儀器有限公司)。
1.2 試驗方法
1.2.1 動物分組及給藥方法[2]
選取 SPF級雄性昆明種小鼠 60只,隨機分成 6組,每組10只,即正常對照組(NC)、模型組(MC)、聯苯雙酯組(BPDC,200 mg/kg),鹿茸水提物高、中、低劑量組(LRH,LRM,LRL,給藥劑量分別為40 g/kg,20 g/kg,10 g/kg)。正常組和模型組小鼠按每10 g體質量0.2 mL灌胃生理鹽水(NS),其余各組小鼠灌胃相應藥物,每天1次,連續灌胃7 d。末次給藥后1 h,除正常對照(NC)組外,其余各組小鼠腹腔注射0.2%CCl4花生油溶液10 mL/kg。禁食不禁水24 h后,取血及臟器進行測定。
1.2.2 觀察指標
一般指標:試驗過程中每天觀察小鼠活動狀況及對外來刺激的反應,監測小鼠體質量變化。
肝臟指數:取血后頸椎脫臼處死小鼠,快速剖腹取出肝臟,用冰生理鹽水漂洗去除積血,拭凈后稱重并記錄,按公式計算肝臟指數,肝臟指數=[肝臟質量(g)/體質量(g)]×100%。
血清生化指標[3]:摘除小鼠眼球取血,將凝固的血液于3 000 r/min離心10 min,分離血清,按各試劑盒說明書的要求測定血清中的AST及ALT活性、炎癥因子,如腫瘤壞死因子-α(TNF-α)、單核細胞趨化蛋白(MCP-1)、白細胞介素-6(IL-6)含量。
肝組織生化指標[4]:選適量肝組織,用冷生理鹽水漂洗去除積血,擦干,稱重,加入其質量9倍體積的冰生理鹽水制成10%肝勻漿,4℃ 3 500 r/min離心15 min,取上清液,按各試劑盒說明書的要求測定SOD,MDA,還原型谷胱甘肽(GSH),谷胱甘肽過氧化物酶(GSH-PX)含量。
肝臟病理學檢查:取肝臟左葉距邊緣0.5 cm處小塊組織,用10%甲醛固定,按常規脫水、透明、浸蠟、包埋、切片后顯微鏡下觀察組織形態學,拍攝片。肝細胞脂肪變性程度和壞死及炎癥活動度判斷標準分4級[5],見表1。

表1 肝細胞脂肪變性程度和壞死及炎癥活動度分級標準
1.2.3 熒光定量PCR法[6]
引物的設計:結果見表2。
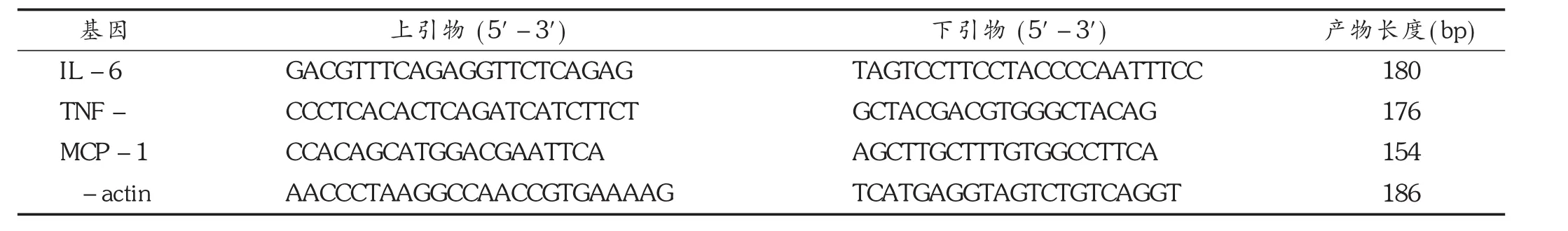
表2 PCR引物信息
內參照基因與目的基因擴增效率檢測:將正常組cDNA進行倍比稀釋,獲得原倍、2-1倍、2-2倍、2-3倍、2-4倍、2-5倍、2-6倍濃度的cDNA,并將其作為模板,用上述引物分別擴增β-actin與TNF-α,MCP-1,IL-6。每個樣本設3個平行管,20 μL反應體系為2×SY BR Prem ix Ex Taq 10 μL,上下游引物各1 μL,cDNA 3 μL,ROX Reference D yeⅡ0.4 μL,ddH2O 4.6 μL。反應條件為95℃ 60 s;95℃ 10 s,55℃ 20 s,72℃ 20 s,72℃時收集熒光信號,共進行40個循環。PCR擴增結束后,從55~95℃全程讀取熒光信號獲得融解曲線,以確定擴增產物的特異性。以稀釋倍數的2的對數值為 X軸,β-actin和 TNF-α,MCP-1,IL-6的CT值為 Y軸,進行線性回歸,觀察兩條線的斜率,以確定內參βactin基因與目的基因TNF-α,MCP-1,IL-6的擴增效率是否一致。
TNF-α,MCP-1,IL-6 m R N A的表達水平檢測:分別以β-actin和TNF-α,MCP-1,IL-6引物進行熒光定量PCR,獲得CT均值后,計算Δ CT(CT內參-CT目的)和ΔΔ CT(試驗組Δ CT-正常組Δ CT)。并計算試驗組TNF-α,MCP-1,IL-6 mRNA表達改變的倍數(2-ΔΔCT)。
1.3 統計學處理
2 結果
2.1 一般指標觀察
各組小鼠體質量均有所增加,與正常對照組相比,模型組小鼠體質量增加較緩慢,小鼠反應遲鈍,倦臥少動,精神萎靡,毛色黯淡無光澤,出現脫毛現象。鹿茸水提物高、中劑量組比低劑量組小鼠毛色略好,反應略快,營養狀態尚可。
2.2 肝臟指數
與正常對照組比較,模型組小鼠肝臟指數明顯上升(P<0.05);與模型組比較,鹿茸水提取中、高劑量給藥組小鼠肝臟指數有降低趨勢(P<0.05)。表明鹿茸水提物對小鼠的肝臟質量有影響。見表3。
表3 鹿茸水提物對肝損傷小鼠肝臟指數的影響(s,n=10)

表3 鹿茸水提物對肝損傷小鼠肝臟指數的影響(s,n=10)
注:與NC組相比,△P<0.05;與MC組相比,*P<0.05。
組別NC組MC組BPDC組LRL組LRM組LRH組劑量(g/kg)--0.20 10 20 40肝臟指數(%)4.24±0.63 5.27±0.94△4.25±0.58 4.77±0.63 4.58±0.86*4.35±0.57*
2.3 血清AST及ALT水平
鹿茸水提物高、中劑量組和BPDC組血清AST含量均降低(P<0.05);鹿茸低劑量對小鼠血清AST的影響無統計學意義(P>0.05)。鹿茸水提物高劑量組和BPDC組血清ALT含量均降低(P<0.05);鹿茸水提物中、低劑量對小鼠血清ALT的影響無統計學意義(P>0.05)。見表4和圖1。
2.4 肝組織SOD,MDA,GSH和GSH-PX水平
鹿茸水提物各劑量組和BPDC組肝組織中SOD,GSH和GSH-PX的活性均顯著提高(P<0.05或 P<0.01),MDA含量降低(P<0.05)。見表5和圖2。
表4 鹿茸水提物對肝損傷小鼠血清ALT及AST影響(s,U/L,n=10)
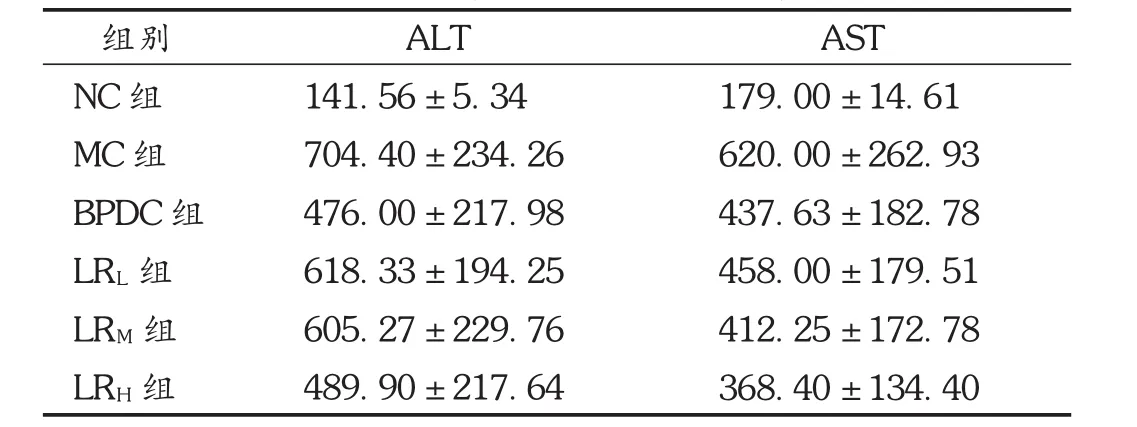
表4 鹿茸水提物對肝損傷小鼠血清ALT及AST影響(s,U/L,n=10)
注:與 NC組相比,△P<0.05;與 MC組相比*P<0.05,**P<0.01,***P<0.001。表5和表6同。
LRM組LRH組605.27±229.76*489.90±217.64**412.25±172.78**368.40±134.40***
2.5 炎癥因子表達
鹿茸水提物各劑量組和BPDC組TNF-α mRNA,MCP-1 mRNA,IL-6 mRNA的基因水平均顯著降低,小鼠血清中TNF-α,MCP-1,IL-6的含量降低(P<0.05或P<0.01)。見表6和圖3。
2.6 肝臟病理組織學變化
對CCl4所致急性肝損傷小鼠肝組織病理組織學進行觀察,光學顯微鏡下,可見正常對照組小鼠肝細胞以中央靜脈為中心呈索狀排列放射狀行走,肝細胞、肝細胞索、肝竇無異常,肝間質無充血、水腫和炎細胞浸潤,匯管區無纖維增生。模型組小鼠肝小葉結構欠清晰,肝小葉周邊及部分小葉中央區肝細胞呈大片凝固性壞死,壞死呈槽狀或橋接連片樣,部分肝細胞則呈氣球樣變性或脂肪變性,胞漿疏松化并有不同程度的炎癥反應,匯管區未見纖維增生。鹿茸水提物低劑量組與模型組接近;鹿茸水提物中劑量組小鼠肝小葉結構不清晰,小葉周邊肝細胞呈小片壞死;鹿茸水提物高劑量組及BPDC組小鼠肝細胞呈輕度彌漫性顆粒樣變性,未見充血、水腫和炎細胞浸潤。病理分級結果表明,鹿茸水提物各劑量組及BPDC組小鼠肝損傷程度與模型組比較,差異均有統計學意義(P<0.01或 P<0.05)。見表7及圖4。
表5 鹿茸水提物對肝損傷小鼠肝組織SOD,MDA,GSH和GSH-PX的影響(s,n=10)

表5 鹿茸水提物對肝損傷小鼠肝組織SOD,MDA,GSH和GSH-PX的影響(s,n=10)
組別NC組MC組BPDC組LRL組LRM組LRH組SOD(U/mg)470.85±19.11 146.83±18.39△452.90±10.79***183.80±13.99 245.30±10.89*350.90±10.52**MDA(nmol/mg)8.89±1.34 18.55±1.73△10.10±1.48**16.90±1.79 13.10±2.18*11.00±1.92**GSH(U/mg)44.67±3.17 23.71±4.48△40.67±3.27***28.67±1.18*34.67±3.21**38.67±1.17***GSH-PX(U/mg)2 266.35±178.29 553.44±272.98△2 063.35±168.21***669.35±78.29 1 123.35±128.88*1 875.35±175.20**
表6 鹿茸水提物對肝損傷小鼠炎癥因子的影響(s,n=10)

表6 鹿茸水提物對肝損傷小鼠炎癥因子的影響(s,n=10)
組別NC組MC組BPDC組LRL組LRM組LRH組IL-6 mRNA 1.00±0.11 1.63±0.39△1.23±0.34***1.53±0.32*1.33±0.35**1.16±0.15***TNF-α mRNA 1.01±0.13 1.88±0.49△1.10±0.23***1.77±0.29*1.42±0.12**1.11±0.36***MCP-1 mRNA 0.99±0.21 1.92±0.20△1.20±0.17***1.64±0.12*1.36±0.43**1.19±0.39***IL-6(pg/mL) 95.35±12.29 190.20±10.17△134.35±12.78***161.35±12.78*144.35±12.78**120.35±12.29***TNF-α(pg/mL) 86.35±11.20 208.35±12.56△125.35±12.78***177.66±16.21*146.66±16.21**111.35±12.37***MCP-1(pg/L) 104.33±12.34 212.35±15.29△80.35±12.78***188.67±16.34*126.67±16.34**71.56±16.76***
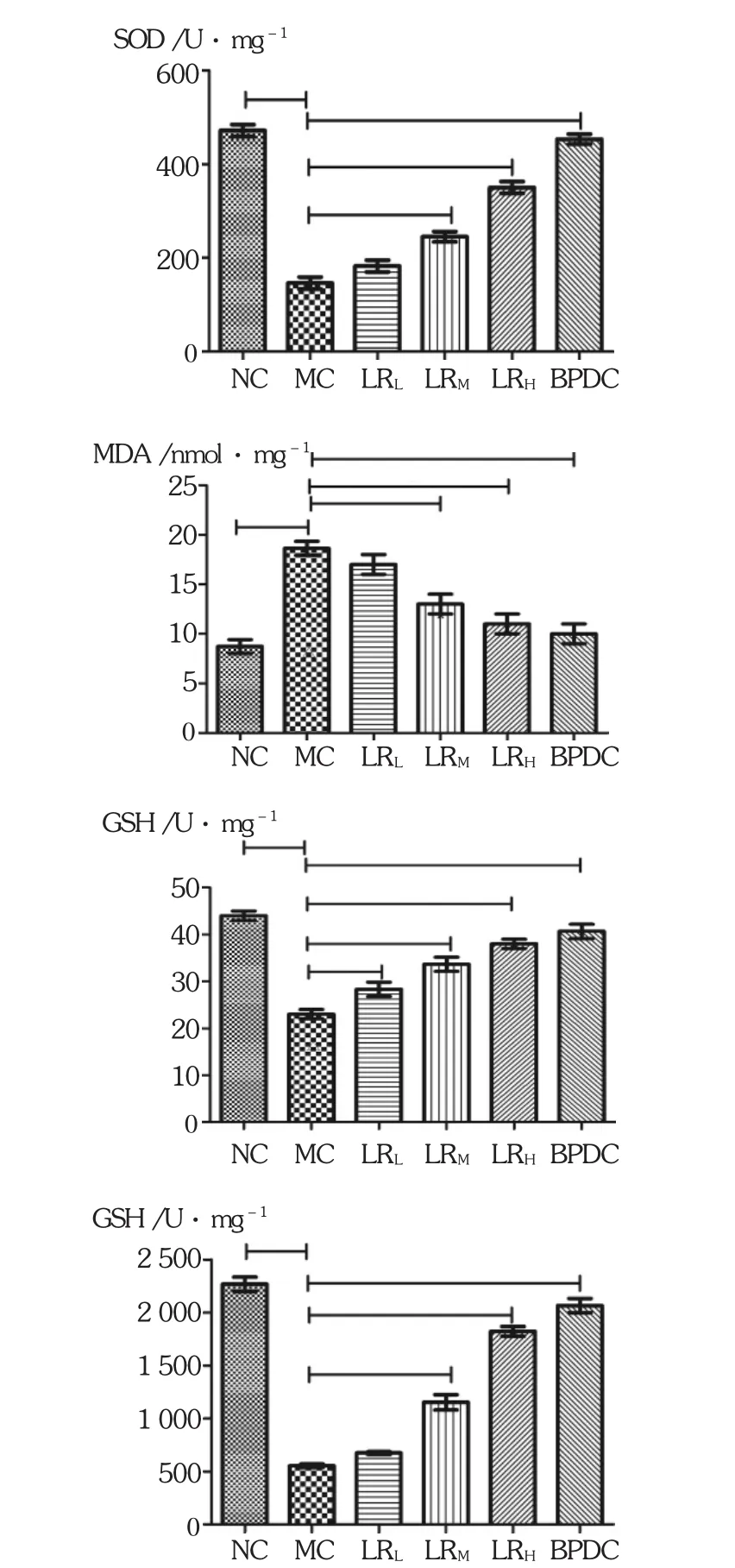
圖2 鹿茸水提物對肝損傷小鼠肝組織SOD,MDA,GSH和GSH-PX的影響(n=10)
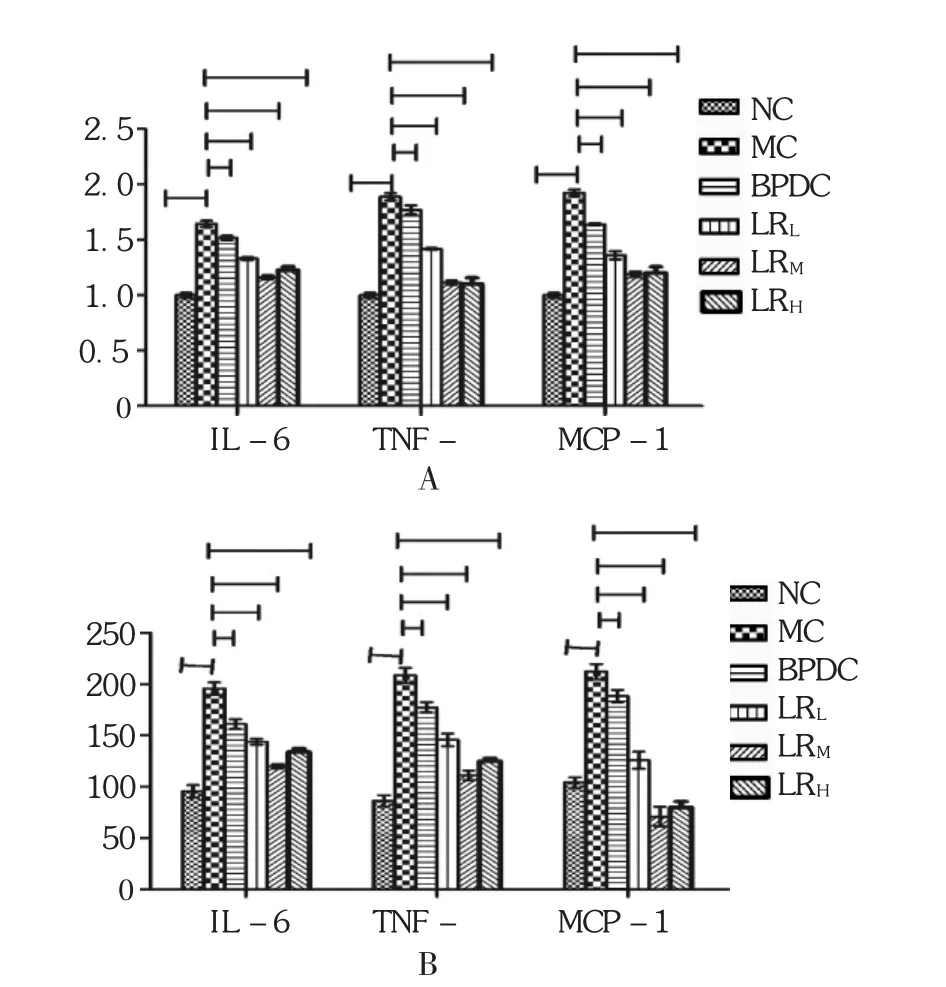
圖3 鹿茸水提物對肝損傷小鼠肝組織SOD,MDA,GSH和GSH-PX的影響(n=10)
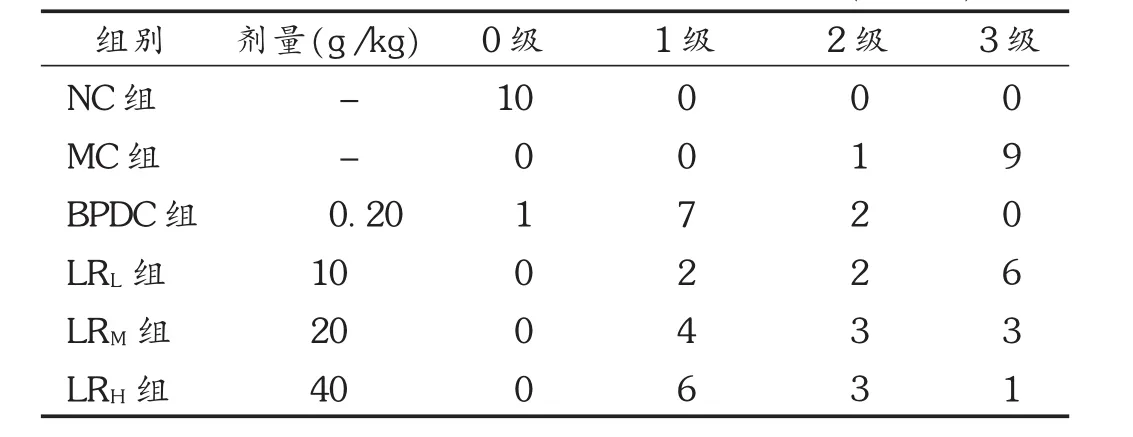
表7 各組小鼠肝損傷程度的病理分級情況(n=10)
3 討論
嚴重或持續的肝損傷最終導致肝功能衰竭,化學性肝損傷模型是目前國際常用的肝損傷模型。CCl4為經典急性化學性損傷的誘導劑,可直接損傷肝細胞膜,使大量Ca2+涌入細胞并主要聚集在線粒體內,致使線粒體膜電勢喪失,呼吸鏈功能障礙,電子傳遞鏈電子外漏增加,促進了氧自由基的產生[7];同時,其在體內經肝微粒體細胞色素P450代謝激活,生成自由基及一系列氧活性物,最終導致MDA形成增多,肝細胞膜通透性增加[8]。
ALT和AST是迄今國內用于評價肝臟產生急性損傷的最常用酶學檢查指標,能客觀地反映出肝細胞急性損傷的程度。ALT只存在于細胞漿內,80%的AST存在于線粒體內,細胞漿內只占20%[9]。肝臟產生急性損傷的早期,肝細胞通透性增加,胞漿內的ALT大量釋放入血,但細胞尚未被破壞或損傷較輕,血清中AST升高不明顯。而當肝細胞嚴重病變壞死后,線粒體受損使AST釋放,導致血清中AST升高[10]。
在各種原因導致肝臟急性肝損傷的過程中,機體均能通過酶系統與非酶系統產生氧自由基,氧自由基能攻擊肝細胞膜中的多不飽和脂肪酸,引發脂質過氧化作用,形成具有醛基、酮基、羥基、羰基、氫過氧基等一系列基團的脂質過氧化物,引起肝細胞代謝及功能障礙甚至死亡[11]。SOD是一類廣泛分布于組織細胞內的金屬酶,體內SOD水平與自由基含量呈負相關,其水平的高低可間接反映機體內自由基的含量,對于自由基繼發損傷病情的診斷、自由基清除治療療效跟蹤和預后判斷與評估等具有十分重要的參考價值[12]。MDA作為脂質過氧化的產物,其量能反映機體內脂質過氧化的程度,從而反映出細胞損傷的程度。GSH是一種能在肝臟內生成,由谷氨酸、半胱氨酸和甘氨酸形成的三肽化合物,分為還原型谷胱甘肽和氧化型谷胱甘肽兩類。GSH能直接同氧自由基起反應,還能作為谷胱甘肽過氧化酶的底物,還原體內已生成的氧自由基[13]。肝臟中GSH的濃度依賴于肌肉、腸道器官的谷氨酸、半胱氨酸儲備,正是由于這些儲備,在肝臟受損產生應激的初期,GSH水平升高,來保護肝臟免受應激狀態下的氧化損傷[14]。GSHPX是機體內特異性地催化GSH對氫過氧化物的還原反應的酶,具有清除細胞內有害的過氧化物代謝產物,阻斷脂質過氧化鏈反應,保護細胞膜結構和功能完整的作用。因此,SOD,MDA,GSH和GSH-PX的測定常常相互配合,以綜合評價肝細胞的過氧化損傷程度和藥物對肝損傷的療效[15]。
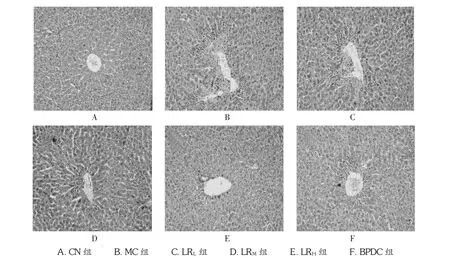
圖4 鹿茸對小鼠肝臟病理組織學的影響(HE,×100)
研究表明[16],炎癥反應在化學誘導的肝損傷和修復過程中發揮的重要作用,CCl4的毒性作用會造成肝組織局灶性壞死,損傷的肝細胞、肝竇內皮細胞、被激活的Kupffer細胞可以釋放TNF-α,IL-6,MCP-1等細胞因子,引發炎性反應,加重肝損傷程度。
本研究結果表明,鹿茸水提物能降低小鼠血清ALT和AST含量,提高SOD,GSH,GSH-PX的活性,降低肝損傷小鼠的肝臟指數和肝組織中肝脂質過氧化產物MDA的生成,對四氯化碳誘導的急性肝損傷均具有一定的防護作用。鹿茸水提物還能降低炎癥因子TNF-α,MCP-1,IL-6含量和基因表達。其作用途徑可能是通過提高SOD,GSH和GSH-PX等清除自由基的酶活性,也可能是通過增強合成這些酶的功能,來增強機體抗自由基的防御系統的功能;或是通過減少炎癥反應從而減輕CCl4引起的肝損傷。可見,鹿茸水提物對急性肝損傷作用的機制可能存在諸多靶點,仍有待進一步研究。
[1]段小群,焦 楊,張士軍,等.玉郎傘多糖對過氧化氫誘導大鼠原代肝細胞損傷的保護作用[J].時珍國醫國藥,2007,18(7):1 592-1 593.
[2]楊亞軍,李慶耀,梁生林,等.車前草總三萜對四氯化碳致小鼠肝損傷的保護作用[J].中成藥,2012,34(1):140-142.
[3]孫海青,王小琪,時紅波,等.肝爽顆粒對CCl4誘導的慢性肝損傷小鼠模型和肝損傷細胞模型的保護作用[J].臨床肝膽病雜志,2015,31(7):1 114-1 119.
[4]于偉凡.馬鞭草總黃酮對四氯化碳致小鼠急性肝損傷的影響[J].醫藥導報,2013,32(10):1 289-1 292.
[5]鄒禮樂,王巧稚,彭 柯,等.復方丹參注射液對缺氧/復氧HK-2細胞損傷保護機制的研究[J].時珍國醫國藥,2013,24(3):596-598.
[6]徐 鑫,屈彩芹.肝損傷機制[J].醫學綜述,2008,14(5):747.
[7]劉彥雙,朱淑霞,王永利.急性肝損傷模型的研究進展[J].河北醫藥,2007,29(6):613.
[8]陳 健,黃媛恒,王乃平,等.玉郎傘多糖和皂苷對氧自由基清除作用研究[J].中藥藥理與臨床,2007,23(5):100.
[9]施 暢,廖明陽.某些化學物致肝損傷機制的研究進展[J].衛生毒理學雜志,2004,18(3):96.
[10]付書婕,黃建春,王乃平,等.玉郎傘多糖對小鼠急性酒精性肝損傷保護作用的研究[J].中國藥房,2009,20(6):406.
[11]中華醫學會消化病學分會肝膽疾病協作組.急性藥物性肝損傷診治建議(草案)[J].中華消化雜志,2007,27(11):765.
[12]高普均,王小從,樸云峰,等.五杞膠囊對小鼠急性肝損傷的保護作用[J].吉林大學學報:醫學版,2003,29(4):448.
[13]趙春景,魏 來.葛根素對CCl4所致大鼠急性肝損傷的保護作用[J].第三軍醫大學學報,2005,27(7):625.
[14]辛 念,熊建新,韓淑英,等.蕎麥種子總黃酮對四氯化碳所致急性肝損傷的保護作[J].第三軍醫大學學報,2005,27(14):1 456.
[15]楊龍飛,金家興,高文秀,等.清肝浸膏對小鼠實驗性肝損傷模型的保護作用[J].中國實驗方劑學雜志,2006,12(6): 41-42.
[16]楊 威,王茜莎,王敏偉,等.陸英顆粒對急性實驗性肝損傷的保護作用研究[J].中藥材,2005,28(12):1 085-1 088.
Protective Effect of Pilose Antler Against Carbon Tetrachloride-Induced Liver Injury in M ice
Qin Yanni
(Nanning Hospital of Traditional Chinese Medicine,Nanning,Guangxi,China 530001)
Objective To observe the protective effect of pilose antler on acute liver injury induced by carbon tetrachloride in mice.M ethods The SPF Kunming mice were divided into normal control group(NC),model group(MC),high-,medium-and low-doses of pilose antler groups,and BPDC group.The mice of NC and MC groups were treated with normal saline(NS),and all doses of pilose antler groups and BPDC group were treated with LDM (40,20,10 g/kg)and BPDC(200 mg/kg)respectively.All mice were treated with drugs or NS for 7 consecutive d,ig,qd.1 h after the last administration of drugs,each group of mice was induced by CCl4,ip,except the normal control group.The activities of ALT and AST in serum,the content of SOD,MDA,GSH and GSH-PX in liver tissue were measured by ELISA.The content of TNF-a,MCP-1 and IL-6 were measured by ELISA.Relative quantitative real-time PCR were used to determine the expressions of TNF-a,MCP-1 and IL-6 genes.Hematoxylin and eosin(HE)stain was used to examine the degree of hepatic injury.Results The activities of ALT and AST in serum were obviously decreased in the high pilose antler group (P<0.01).The activities of SOD,GSH and GSH-PX in liver were also enhanced obviously(P<0.05 or P<0.01)and the activity of MDA was decreased in that group.The expressions of TNF-α,MCP-1 and IL-6 genes were down-regulated in the high pilose antler group.The result of HE stain indicated that pilose antler could attenuating attenuated carbon tetrachloride-induced liver injury in mice.Conclusion s Pilose antler has protective effect on acute liver injury induced by CCl4 in mice.The mechanism may be involved in attenuating free radical and inhibiting the lipid peroxidation.
pilose antler;carbon tetrachloride;liver injury;mice
R285.6;R282.74
A
1006-4931(2016)23-0033-06
覃燕妮,主管藥師,主要從事治療肝損傷藥物的研究工作,(電子信箱)66828673@qq.com。
2016-08-11;
2016-09-18)
圖1 鹿茸水提物對肝損傷小鼠血清ALT,AST影響(n=10)

