奧曲肽與烏司他汀聯合治療急性重癥胰腺炎的效果及機制
姚振濱,張偉,張天,庫馬爾
(石河子大學醫學院第一附屬醫院,新疆石河子832000)
?
奧曲肽與烏司他汀聯合治療急性重癥胰腺炎的效果及機制
姚振濱,張偉,張天,庫馬爾
(石河子大學醫學院第一附屬醫院,新疆石河子832000)
目的 觀察奧曲肽與烏司他汀聯合治療急性重癥胰腺炎的效果并探討其機制。方法 選取急性重癥胰腺炎患者112例,隨機分為觀察組與對照組各56例,對照組給予奧曲肽治療,25 μg/h持續泵入,0.6 mg/d;觀察組在此基礎上加用烏司他汀,將烏司他汀10萬U溶于500 mL的5%葡萄糖溶液中靜脈滴注,2次/d。10 d后比較兩組治療效果,采用ELISA法檢測血清IL-6、TNF-α,采用酶化學法檢測血淀粉酶,采用碘-淀粉比色法測定尿淀粉酶,采用日立7600型全自動生化分析儀檢測血清C反應蛋白。結果 觀察組治愈30例,顯效12例,有效8例,無效6例,總有效率89.3%;對照組分別為18、12、14、12例,78.6%,兩組總有效率比較,P均<0.05。觀察組與對照組血清IL-6水平分別為(29.0±4.2)、(45.7±5.3)ng/L,TNF-α水平分別為(18.9±3.5)、(25.2±3.2)ng/L,兩組比較,P均<0.05。觀察組與對照組血蛋白酶水平分別為(0.2±0.1)、(0.7±0.3)×103U/L,尿蛋白酶水平分別為(0.3±0.2)、(0.7±0.2)×103U/L,C反應蛋白水平分別為(45.2±6.7)、(46.5±7.1)×103U/L,兩組比較,P均<0.05。結論 奧曲肽與烏司他汀聯合治療急性重癥胰腺炎的效果優于奧曲肽單用,其機制可能與降低炎癥性細胞因子水平有關。
急性重癥胰腺炎;奧曲肽;烏司他汀
急性重癥胰腺炎(SAP)在急性胰腺炎中所占比例為20%~30%,其病情兇險,預后較差,并發癥較多,病死率為30%~60%[1]。SAP發病機制復雜,確切機制至今尚不明確,而胰酶激活與炎癥反應成為臨床研究熱點。SAP患者早期會產生多器官功能障礙甚至多器官衰竭而死亡[2]。血中細胞因子與炎癥介質的過度表達會造成組織損傷,在生物體內,一氧化氮是重要信使與效應分子,可參與多種生理病理過程[3]。國內外研究一般建議進行早期非手術治療。奧曲肽是一種與八肽生長抑素類似的人工合成天然生長抑素,能對胰酶的分泌與合成產生有效抑制作用,對胰腺細胞進行保護。烏司他汀作為廣譜酶抑制劑,對于胰蛋白酶等多種蛋白水解酶抑制作用明顯,對于透明質酸酶等有一定作用。2011年7月~2015年7月,我們采用奧曲肽與烏司他汀聯合治療SAP 56例,取得較好效果。現報告如下。
1 資料與方法
1.1 臨床資料 選擇112例SAP患者,男69例、女43例,年齡34.5~71.1(46.7±19.2)歲。臨床表現為劇烈而持續的上腹部疼痛、腹脹、惡心、嘔吐、發熱、乏力、腰部非外傷性急性疼痛不適,伴血尿和血清淀粉酶異常升高,經CT檢查證實為SAP,符合2006年中國急性胰腺炎診治指南。將患者隨機分為觀察組與對照組各56例,兩組一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2 治療方法 兩組均先給予胃腸減壓等常規治療。對照組給予奧曲肽治療,用生理鹽水稀釋奧曲肽,經25 μg/h持續泵入,0.6 mg/d;觀察組在對照組基礎上另加烏司他汀治療,將烏司他汀10萬U溶于500 mL的5%葡萄糖溶液中,靜脈滴注,2次/d。兩組療程均為10 d。
1.3 觀察指標 ①療效:觀察治療前后患者主要癥狀(腹痛、惡心、發熱等)改善情況,依據文獻[4]進行療效判定:10 d內患者臨床癥狀消失,同時實驗室指標均恢復至正常水平為痊愈;10 d內患者癥狀進步等級超過2個,或實驗室指標恢復超過75%為顯效;10 d內患者癥狀有進步,或實驗室指標恢復超過50%為有效;10 內患者癥狀無改變或加重甚至死亡為無效。②實驗室指標:主要是血清IL-6、TNF-α、血蛋白酶、尿蛋白酶、C反應蛋白。患者于清晨取靜脈血,采用ELISA法檢測血清IL-6、TNF-α,采用酶化學法檢測血淀粉酶,采用碘-淀粉比色法測定尿淀粉酶,采用日立7600型全自動生化分析儀檢測血清C反應蛋白。
1.4 統計學方法 采用SPSS13.0統計軟件。計量資料以表示,比較采用t檢驗;計數資料比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者療效比較 觀察組治愈30例,顯效12例,有效8例,無效6例,總有效率89.3%(53/56);對照組分別為18、12、14、12例,78.6%(44/56),兩組總有效率比較,P<0.05。
2.2 兩組治療前后實驗室指標水平比較 見表1。
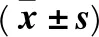
表1 兩組治療前后實驗室指標水平比較
3 討論
患有SAP時,患者體內的胰酶會被異常激活,不僅會對胰腺本身造成傷害,還會使單核巨噬系統激活,造成大量炎癥介質合成與釋放,之后進入血液系統全身循環,最終發生全身性炎癥反應綜合征[5]。IL-6、TNF-α是SAP的主要促炎因子,其濃度與患者病情有關,如何有效阻斷炎性介質傳播對降低SAP病情嚴重程度非常重要,同時對于SAP治療效果的提高亦有明顯作用。TNF-α可作用于不同細胞,使IL-1、IL-6等細胞因子釋放。IL-6為單核細胞與血管內皮細胞所產生的主要炎癥介質,能使肝臟合成急性期反應蛋白[6]。因此,對于胰酶自身的激活及避免全身炎性反應的發生在治療SAP中有重要意義。
奧曲肽是一種與八肽生長抑素類似的人工合成天然生長抑素,能對胰酶的分泌與合成產生有效的抑制作用,從而降低胰酶含量,使括約肌松弛,對胰腺細胞進行保護[7]。同時對于穩定溶酶體膜有一定作用,刺激產生肝網狀系統,改善內毒素血癥抑制血小板活化因子釋放,從而降低并發癥的發生率,最終使胰腺得到修復[8]。烏司他汀作為廣譜酶抑制劑,對于胰蛋白酶等多種蛋白水解酶抑制作用明顯,對于透明質酸酶等亦有一定作用[9]。烏司他汀能減少由于自身消化而吸收的毒素,并且還能通過對炎癥介質產生與釋放進行抑制,維持血管內皮細胞正常功能,從而減小微循環并降低組織的損傷程度。除此之外,烏司他汀還能使溶酶體膜功能穩定,對溶酶體的釋放產生抑制并進行調節[10]。對于抑制心肌抑制因子的產生,阻斷急性胰腺炎休克的發生,烏司他汀作用同樣明顯,因此烏司他汀對于減小局部與遠隔臟器傷害有重要作用。
與急性胰腺炎相關的細胞因子有促炎因子TNF-α、IL-1、IL-6、IL-8等和抗炎因子IL-10等[11]。急性胰腺炎時TNF-α最早見于胰腺,隨后大量產生于肺、肝、脾,在急性胰腺炎病程中起決定性作用[12]。IL-6與急性胰腺炎的嚴重程度密切相關,在急性胰腺炎急性期,輕癥和重癥二者間有顯著差異,且與MODS及病死率有關[13]。淀粉酶是惟一能在正常時尿中出現的血漿酶,淀粉酶升高是急性胰腺炎的重要診斷指標之一[14]。淀粉酶升高的程度雖并不一定和胰腺損傷程度相關,但其升高的程度越大,患急性胰腺炎的可能性越大,因此均用淀粉酶作為急性胰腺炎診斷的首選指標[15]。本研究中奧曲肽與烏司他汀聯用后,TNF-α和IL-6、淀粉酶顯著降低,說明奧曲肽與烏司他汀聯用可更顯著改善胰腺炎患者的炎癥反應。
綜上所述,在治療SAP時,奧曲肽與烏司他汀聯用的效果優于奧曲肽單用,其機制可能與降低炎癥性細胞因子水平有關。
[1] 郭華,陳炅,索冬衛,等.奧曲肽聯合烏司他丁治療急性重癥胰腺炎臨床療效及安全性分析[J].中華醫學雜志,2015,95(19):1471-1474.
[2] Elsaid MF, Kamel H, Chalhoub N. Whole genome sequencing identifies a novel occludin mutation in microcephaly with band-like calcification and polymicrogyria that extends the phenotypic spectrum[J]. Am J Med Genet A,2014,164A(6):1614-1617.
[3] 胡小麗,蒲紅,岳光平,等.奧曲肽聯合不同用藥方案治療急性重癥胰腺炎效果分析[J].西部醫學,2015,27(7):1049-1051.
[4] Cui LH, Wang XH, Peng LH. The effects of early enteral nutrition with addition of probiotics on the prog-nosis of patients suffering from severeacute pancreatitis[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2013,8(4):224-228.
[5] 彭雙田.烏司他丁聯合奧曲肽治療急性重癥胰腺炎的療效評價[J].醫學臨床研究,2013,30(6):1198-1199.
[6] 田國華,張國順,張愛新,等.烏司他丁聯合清胰湯治療急性重癥胰腺炎大鼠的實驗研究[J].中國綜合臨床,2012,28(8):827-830.
[7] Mentula P, Kylnp ML, Kemppainen E, et al. Plasma antiinflammatory cytokines and monocyte human leucocyte antigen-DR expression in patients with acute pancreatitis[J]. Scand J Gastroenterol, 2004,39(2):178-187.
[8] 雷淑芬,周曉霞,魏以新,等.烏司他丁降低急性重癥胰腺炎并發肺損傷的臨床研究[J].中國藥業,2010,19(11):85-86.
[9] Itoh T, Satou T, Nishida S. Edaravone protects against apoptotic neuronal cell death and improves cerebral function after traumatic brain injury in rats[J]. Neurochem Res, 2010,35(2):348-355.
[10] Yamamoto Y, Yanagisawa M, Tak NW, et al. Repeated edaravone treatment reduces oxidative cell damage in rat brain induced by middle cerebral artery occlusion[J]. Redox Rep, 2009,14(6):251-258.
[11] Yang F, Wu H, Li Y, et al. Prevention of severe acute pancreatitis with octreotide in obese patients: a prospective multi-center randomized controlled trial[J]. Pancreas, 2012,41(8):1206-1212.
[12] Zhou MT, Chen BC, Sun HW, et al. Continuous regional arterial infusion with fluorouracil and octreotide attenuates severe acute pancreatitis in a canine model[J]. PLoS One, 2013,7(5):448-449.
[13] Jingmin O, Xiping Z, Chun W, et al. Study of dexamethasone, baicalin and octreotide on brain injury of rats with severe acute pancreatitis[J]. Inflamm Res, 2012,61(3):265-275.
[14] Xu W, Zhou YF, Xia SH. Octreotide for primary moderate to severe acute pancreatitis: A meta-analysis[J]. Hepatogastroenterology, 2013,60(126):1504-1508.
[15] Kolotushkin IA, Balnykov SI, Shubin LB. Estimation of the role of octreotide in treatment of severe pancreatic necrosis[J]. Khirurgiia, 2015(6):216-219.
10.3969/j.issn.1002-266X.2016.41.015
R657.51
B
1002-266X(2016)41-0049-03
2016-08-15)

