GnRH拮抗劑對輔助生殖患者血清及卵泡液中IGF-I、IGFBP-I及雌孕激素水平的影響
張俊娣,韓艷,李玉潔,楊蘭英,郝桂敏
(1廊坊市人民醫院,河北廊坊065000;2河北醫科大學第二醫院生殖醫學中心)
?
GnRH拮抗劑對輔助生殖患者血清及卵泡液中IGF-I、IGFBP-I及雌孕激素水平的影響
張俊娣1,韓艷1,李玉潔1,楊蘭英1,郝桂敏2
(1廊坊市人民醫院,河北廊坊065000;2河北醫科大學第二醫院生殖醫學中心)
目的 探討促性腺激素釋放激素(GnRH)拮抗劑對胰島素樣生長因子I(IGF-I)、胰島素樣生長因子結合蛋白I(IGFBP-I)及雌孕激素水平的影響,尋求最佳的促排卵方案。方法 選擇行IVF/ICSI-ET助孕的不孕癥患者90例,按促排卵方案不同隨機分為三組各30例,A、B組于月經第2~3天啟用促性腺激素(Gn)促排卵,當主導卵泡直徑達到14mm或LH達到5mIU/mL或E2大于600pg/mL時分別啟動GnRH拮抗劑0.25、0.125mg/d,直至注射HCG當日。C組黃體中期開始使用GnRH-a0.1mg/d,連用14d確定達到垂體降調節標準后啟動Gn促排卵。比較三組HCG日及取卵日靜脈血中IGF-I、IGFBP-I、雌二醇(E2)、孕酮(P)水平及取卵日卵泡液中IGF-I、IGFBP-I水平,對用藥情況及臨床結局等參數進行分析。結果 三組間HCG日血清、取卵日血清及卵泡液中IGF-I、IGFBP-I水平比較,P均<0.05。三組間HCG日血清P、E2、E2/P比較,P均>0.05。C組中1例患者發生輸卵管妊娠,A組中1例患者未進行胚胎移植。三組Gn用藥天數、Gn用藥總量、HCG日子宮內膜厚度、獲卵數相比,P均>0.05。A、B、C組ICSI卵子成熟率分別為87/97(88.77%)、46/174(83.90%)、112/156(71.79%),A、B組與C組比較,P均<0.05。A、B、C組受精率分別為93.24%、88.66%、89.27%,A與C組及A組與B組比較,P均<0.05。A、B、C組全胚冷凍率分別為20.00%、10.00%、40.00%,B組與C組比較,P<0.05,三組間胚胎冷凍率、胚胎種植率、新鮮周期臨床妊娠率、首次移植周期臨床妊娠率、首次移植早期流產率、新鮮周期活產率比較,P均>0.05。A、B、C組輕、中度卵巢過度刺激綜合征(OHSS)發生率分別為23.33%、3.33%、56.67%,A、B組與C組比較,P均<0.05。結論GnRH拮抗劑的應用可提高輔助生殖患者血清及卵泡液中IGF-I、IGFBP-I水平,降低血清E2水平,改變卵泡的微環境,提高卵子質量,降低OHSS發生風險,且GnRH拮抗劑劑量降至0.125mg亦可獲得滿意的臨床助孕結局。
不孕癥;促性腺激素釋放激素拮抗劑;胰島素樣生長因子I;胰島素樣生長因子結合蛋白I;雌激素;孕激素
輔助生殖技術(ART)開展至今已30余年,為千萬不孕患者帶來福音。臨床應用控制性促超排卵(COH)方案日趨增多。促性腺激素釋放激素(GnRH)拮抗劑方案是促排卵方案的又一次技術進步,其可預防LH早熟峰,同時避免對卵子質量造成不良影響[1]。本研究試圖通過比較不同促排卵方案對體外受精-胚胎移植(IVF-ET)患者血清及卵泡液中胰島素樣生長因子I(IGF-I)、胰島素樣生長因子結合蛋白I(IGFBP-I)及雌孕激素水平的影響,探討GnRH拮抗劑方案的臨床應用價值,以尋求最佳的控制性促排卵方案。
1 資料與方法
1.1 臨床資料 選擇2014年1~6月因輸卵管因素在河北醫科大學第二醫院生殖醫學中心行IVF/ICSI-ET助孕的不孕癥患者90例,納入標準:①年齡<35歲,月經周期25~35 d,可自發排卵;②體質量指數18~24 kg/m2;③血清泌乳素在正常范圍,卵巢儲備功能正常,即基礎FSH≤10 mIU/mL,基礎雌二醇(E2)≤50 pg/mL,FSH/LH<3.6,基礎竇卵泡計數>10個。患者均符合IVF手術指征,并知情同意。根據促排卵方案不同隨機分為三組各30例,三組間年齡、體質量指數、不孕年限、基礎竇泡數、基礎血清FSH、LH、E2水平比較差異無統計學意義(P>0.05)。
1.2 治療方法 A、B組于月經第2~3天啟用促性腺激素(Gn)促排卵,當主導卵泡直徑達到14 mm或LH達到5 mIU/mL或E2大于600 pg/mL時分別啟動GnRH拮抗劑0.25、0.125 mg/d,直至注射HCG當日。C組黃體中期開始使用GnRH-a 0.1 mg/d,連用14 d確定達到垂體降調節標準(FSH<5 mIU/mL,LH<5 mIU/mL,E2≤50 pg/mL)后啟動Gn促排卵。當至少3個卵泡達到18 mm時應用人絨毛膜促性腺激素(HCG)10 000 IU,36~38 h后在超聲監測下行穿刺取卵。移植后14 d驗尿HCG,陽性者于移植后30 d行陰超檢查,監測到宮內或宮外妊娠囊為臨床妊娠。
1.3 血清及卵泡液中IGF-Ⅰ、IGFBP-Ⅰ、E2、P檢測 留取HCG日及取卵日肘靜脈血5 mL、取卵日卵泡液5 mL,以3 000 r/min離心10 min后取血清置于-80 ℃凍存。采用ELISA法測定血清及卵泡液中IGF-Ⅰ、IGFBP-Ⅰ水平,采用電化學發光法測定HCG日E2、P水平,各項質控符合要求。
1.4 臨床指標觀察 三組患者Gn的用藥時間、用藥總量,HCG日子宮內膜厚度及獲卵數,受精率、ICSI卵子成熟率。計算新鮮周期臨床妊娠率、首次移植周期生化妊娠率和臨床妊娠率、胚胎種植率,全胚冷凍率,胚胎冷凍率。
1.5 統計學方法 采用SPSS13.0統計軟件。計量資料以表示,組間比較采用t檢驗;計數資料比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 三組血清及卵泡液中IGF-Ⅰ、IGFBP-Ⅰ、E2、P水平比較 見表1。
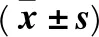
表1 三組血清及卵泡液中IGF-Ⅰ、IGFBP-Ⅰ、E2、P水平比較
2.2 三組臨床指標比較 C組1例患者發生輸卵管妊娠,A組1例患者未進行胚胎移植。三組Gn用藥時間、Gn用藥總量、HCG日子宮內膜厚度、獲卵數相比,P均>0.05。B、C組ICSI 卵子成熟率分別為87/97(88.77%)、46/174(83.90%)、112/156(71.79%),A、B組與C組比較,P均<0.05。A、B、C組受精率分別為393/421(93.24%)、328/370(88.66%)、474/531(89.27%),A與C組及A組與B組比較,P<0.05。A、B、C組全胚冷凍率分別為6/30(20.00%)、3/30(10.00%)、12/30(40.00%),B組與C組比較,P<0.05。A、B、C組胚胎冷凍率分別為13/24(54.17%)、14/27(51.85%)、10/18(55.56%),胚胎種植率分別為14/56(25.00%)、18/64(28.12%)、12/39(30.77%),新鮮周期臨床妊娠率分別為12/23(52.17%)、12/27(44.44%)、11/18(61.11%),首次移植周期臨床妊娠率分別為11/29(37.93%)、14/30(46.67%)、16/30(53.33%),首次移植早期流產率分別為1/11(9.09%)、0、1/16(6.25%),新鮮周期活產率分別為10/12(83.33%)、12/12(100%)、10/11(85.71%),三組間胚胎冷凍率、胚胎種植率、新鮮周期臨床妊娠率、首次移植周期臨床妊娠率、首次移植早期流產率、新鮮周期活產率比較,P均>0.05。A、B、C組輕、中度卵巢過度刺激綜合征(OHSS)發生率分別為7/30(23.33%)、1/30(3.33%)、17/30(56.67%),A、B組與C組比較,P均<0.05。
3 討論
不孕癥是一組男女性生殖能力減退或喪失的器質性或功能性疾病,IVF-ET技術已成為治療不孕不育癥的理想治療措施之一。主要包括促排卵、卵泡檢測與取卵、精子的優選和處理、體外受精、胚胎的體外培養和移植等步驟[2]。控制性超排卵是目前IVF-ET中不可或缺的關鍵步驟,是輔助生殖技術獲得成功妊娠的重要方面之一。GnRH為下丘腦弓狀核神經元分泌的肽類激素,能促進LH和FSH釋放。GnRH-a為人工合成的十肽類化合物,在體內作用與GnRH相同。GnRH激動劑黃體中期長方案被認為適用于卵巢儲備功能正常的不孕患者最佳用藥方案。但多年臨床工作中發現該方案增加了Gn用量,不能有效控制OHSS發生[3]。GnRH拮抗劑是近年來逐步用于臨床的一種新的促超排卵藥物,其通過與GnRH競爭性結合GnRH受體而發揮作用,抑制對促性腺激素的分泌作用。具有用藥時間短、用藥劑量小的優點。
在臨床助孕結局方面,2003年以前的文獻多報道GnRH拮抗劑在臨床妊娠率及種植率方面均低于GnRH激動劑,但最近相關研究均顯示兩者無統計學差異,肖勁松等[4]的一項薈萃分析顯示,GnRH拮抗劑方案與GnRH激動劑黃體期長方案在臨床妊娠率方面無統計學差異。Tiboni等[5]研究中將患者分為GnRH拮抗劑0.25 mg組和0.125 mg組,結果證實在種植率、平均獲卵數、受精率方面組間差異無統計學意義。本研究結果顯示,GnRH拮抗劑方案與GnRH激動劑長方案的臨床妊娠率、獲卵數、胚胎種植率、胚胎冷凍率、早期流產率和活產率無統計學差異,且A組與B組亦無統計學差異,與上述研究結果一致。說明GnRH拮抗劑方案使用得當并不降低臨床妊娠率,且將GnRH拮抗劑劑量調至0.125 mg不僅能獲得滿意的妊娠結局,還能縮減治療費用。
OHSS是促排卵治療中的嚴重并發癥,發病率為1%~10%,卵巢過度刺激導致卵巢明顯增大、血管通透性增加、體液外漏,激發體內一系列反應,嚴重時危及患者生命。GnRH拮抗劑不僅能減少OHSS發生,且無垂體抑制,與激動劑長方案在獲卵率及妊娠率方面無統計學差異[6]。本研究結果顯示,A、B組OHSS發生率低于C組,A、B組在OHSS發生風險方面無統計學差異,說明GnRH拮抗劑的應用有效降低了OHSS發生,且GnRH拮抗劑劑量增減并不影響OHSS發生風險。
IGF是生長激素誘導靶細胞產生的一種具有促生長作用的肽類物質。女性卵巢顆粒細胞和卵泡膜細胞可合成IGF,且與卵泡生長、成熟或閉鎖及優勢卵泡的選擇、卵子成熟等方面密切相關[7]。管群等[8]研究報道,卵泡液中隨IGF-Ⅰ水平的升高其受精率和優質胚胎形成率均明顯升高,說明高水平的IGF-I有利于提高受精率和優質胚胎形成率。本研究結果顯示,A、B組IGF-Ⅰ、IGFBP-Ⅰ水平均高于C組,且A組ICSI卵子成熟率高于C組,A組的IGF-Ⅰ、IGFBP-Ⅰ水平高于B組,但兩組的ICSI卵子成熟率無統計學差異,說明GnRH拮抗劑的應用能改變卵泡液的微環境,有利于優質胚胎形成,但GnRH拮抗劑劑量的改變未對卵子的發育成熟造成負面影響。三組方案HCG日E2、P水平無統計學差異,說明GnRH拮抗劑的應用不會降低HCG日E2水平,且未增加IVF-ET中P升高的風險。
綜上所述,GnRH拮抗劑的應用可提高輔助生殖患者血清及卵泡液中IGF-Ⅰ、IGFBP-Ⅰ水平,提高受精率及ICSI卵子成熟率,改變卵泡微環境,提高卵子質量,降低OHSS發生風險,且GnRH拮抗劑劑量降至0.125 mg亦可獲得滿意的臨床助孕結局。
[1] Gilliam ML. Gonadotrophin-releasing hormone antagonists for assisted reproductive technology[J]. Obstet Gynecol, 2011,118(3):706-707.
[2] 況花榮,陳同強,劉波蘭.體外受精-胚胎移植技術及其進展[J].科技信息,2010,12(21):555-556.
[3] 孫瑜,朱依敏.促性腺激素釋放激素拮抗劑方案在右卵巢低反應風險患者中的應用價值[J].浙江大學學報(醫學版),2009,38(3):305-310.
[4] 肖勁松,陳雙隕,張春蓮,等.促性腺激素釋放激素拮抗劑在體外受精-胚胎移植中有效性的系統性評價[J].中國循證醫學雜志, 2010,10(12):1432-1438.
[5] Tiboni GM, Palumbo P, Leonzio E, et al. Effectiveness of a low gonadotroph-in-releasing hormone antagonist dose in preventing premature luteinizing hormone rise during controlled ovzrian stimulation[J]. Gynecol Endocrinol, 2010,27(11):885-889.
[6] Ludwig M, Katalinic A, Diedrich K. Use of GnRH antagonists in ovarian stimulation for assisted reproductive technologies compared to the long protocol.Meta-analysis[J]. Arch Gynecol Obstet, 2001,265(4)175-182.
[7] Spicer LJ, Santiago CA, Davidson TR, et al. Follicular fluid concentrations of free insulin-like growth factor (IGF)-I during follicular development in mares[J]. Domest Anim Endocrinol, 2005,29(4):573-581.
[8] 管群,楊偉娜,張琪瑤,等.卵泡液中胰島素樣生長因子-I水平與生殖的相關性研究[J].中國優生與遺傳雜志,2009,17(5):124-125.
10.3969/j.issn.1002-266X.2016.41.030
R271.14
B
1002-266X(2016)41-0086-03
2016-02-27)

