失敗模式與影響分析方法在藥品檢驗中的應用探討
詹宇杰
(重慶市食品藥品檢驗檢測研究院·重慶市藥物過程與質量控制工程技術研究中心,重慶 401121)
失敗模式與影響分析方法在藥品檢驗中的應用探討
詹宇杰
(重慶市食品藥品檢驗檢測研究院·重慶市藥物過程與質量控制工程技術研究中心,重慶 401121)
目的 提高藥品檢驗管理體系風險管理能力。方法 通過對藥品檢驗5個子系統功能的分析,建立“人”子系統的失敗模式,并進行影響分析,對風險優先數高的失敗模式進行控制。結果 明確了藥品檢驗5個子系統的主要功能,建立了11個“人”子系統的失敗模式,并進行了影響分析,對不能接受的風險(失敗模式)進行了有效控制。結論 在藥品檢驗中應用失敗模式與影響分析,能有效地管理風險,使管理體系得到持續改進。
失敗模式與影響分析;藥品檢驗;風險管理;失敗模式
2011年1月1日,《藥品生產質量管理規范》(GMP)2010年修訂版開始實施,將風險管理這一全新管理方式引入藥品生產質量管理。在質量認證、生產許可、注冊核查、監督檢查中,越來越多地涉及到風險管理。“風險”是危害發生的可能性和該危害嚴重性的組合,“風險管理”是風險的評估、控制、溝通和回顧的系統化過程[1]。失敗模式與影響分析(FMEA)是風險管理中的重要工具,20世紀50年代,美國開始將其應用于航天、航空、汽車工業的可靠性分析。FMEA在藥品生產質量風險管理中應用廣泛,對風險的分析和控制易于理解、掌握。筆者通過對藥品檢驗系統進行分析,明確各子系統功能,為建立失敗模式提供數據,應用FMEA對藥品檢驗中的風險進行評估和控制,使管理體系得到持續改進。
1 FM EA概述
1.1 分析方法
FMEA對于匯總故障重要模式、引起故障的因素和故障可能的效應,是一種強有力的工具。失敗模式、影響及危害性分析(FMECA)是FMEA的擴展[2],在實際應用中習慣與FMEA合并使用。FMEA有多種實施方法和表達形式,通常是對系統進行分析,通過識別失敗模式、相關失敗原因及失敗的直接或最終影響來實現[2]。FMEA是一種識別各種潛在失敗模式嚴重性并給出為降低風險所采取措施的方法[2],不僅進行分析、評估,還對不接受的風險提出降低風險的改進措施,使系統內已經認識到的風險通過適當控制均可接受。基本步驟是:按子系統列出各個失敗模式的結果→對失敗結果給出嚴重性(SEV)的分數→列出失敗模式的原因(可以是多個)→給出原因出現概率(OCC)的分數→識別用于發現失敗模式當前的控制手段→對每一個原因和控制手段給出發現可能性(DET)的分數→對每一條計算風險優先數(RPN)(RPN=SEV×OCC×DET)→基于RPN確定失敗模式和原因的優先次序(評估)→確定對不可接收的風險采取的行動→采取行動后重新計算風險優先數(pRPN)→基于pRPN重新對失敗模式和原因進行評估,確定是否接受。
1.2 主要步驟
確定失敗模式:系統能否正常工作是由系統中某些重要單元的性能決定的,系統性能評價的關鍵是識別那些重要的單元。首先應評估系統邊界范圍內的所有項目,確定潛在的失敗模式。評估應在分析對象相對應的最低層次上進行,分析子系統和系統功能可能的失敗原因及失敗影響[2]。
失敗原因:應確定和描述各種潛在失敗模式最有可能的失敗原因。失敗原因可通過分析現場失敗(失敗的真實檢驗過程)或試驗件失敗(模擬檢驗過程)來確定[2]。藥品檢驗系統按要素分為5個子系統,它們某一個功能的缺失就是一個失敗模式,通過分析失敗的原因,可按表1評分方法評估其影響或危害性。

表1 評估失敗模式影響(危害)嚴重性(SEV)的評分
失敗原因發生的概率(OCC):為了恰當地評估失敗模式的影響或危害性,應確定每一個失敗原因的發生概率(OCC),見表2。

表2 評估失敗原因發生的概率(OCC)評分[1]
失敗原因被發現的可能性(DET):在系統或用戶受到影響(危害)前識別和消除失敗的可能性。DET值的排序通常與嚴重性(SEV)、發生概率(OCC)的排序相反。DET值越高,發現的可能性越小。較低的可發現性(DET)將導致較高的風險優先數(RPN),處理失敗模式的優先級較高。見表3。

表3 評價發現可能性(DET)的評分
失敗模式風險優先數的評估:風險優先數是定量確定危害性的一種方法,是SEV,OCC,DET三者的乘積,即RPN=SEV×OCC×DET。RPN可用于確定減緩和消除失敗模式的優先次序。除了依據RPN的大小外,失敗模式的嚴重性也是重要考量的因素,如RPN相同,嚴重性高者優先[2]。RPN在實際使用中,將1~8定義為低風險,可直接接受;9~36為中度風險、37~125為高風險,應采取適當措施降低嚴重性、發生概率和提高發現可能性,使風險削減后達到可接受程度。風險削減后再對嚴重性(pSEV)、發生幾率(pSEV)、發現可能性(pDET)、風險優先數(pRPN)進行評估,得到新的優先排序,并在日常工作中予以相應程度的關注。
2 藥品檢驗系統分析及FM EA的應用
2.1 5個子系統
藥品檢驗是指對藥品、保健食品、化妝品、藥品包裝材料與容器等進行的監督檢驗、評價檢驗、委托檢驗、注冊檢驗、進口檢驗等。藥品檢驗是一個相關或相互影響要素的集合,這個集合就是“系統”,包括硬件、軟件(及其相互作用)或過程。藥品檢驗的基本過程:樣品接收及樣品信息錄入(包括檢前留樣)→樣品分檢→樣品檢驗→檢驗數據匯總→合成報告書→報告書的審核簽發→報告書打印、發放、寄送與存檔。為了便于分析,筆者將藥品檢驗系統按要素分為“人”“機”“料”“法”“環”5個子系統。
“人”子系統包括機構和人員。基本功能:滿足檢驗任務和檢驗服務的組織機構,足夠數量的經過有效培訓的具有適當資質的各類人員,明確清晰、層次界線分明的機構和人員的職責,人員身心健康,健全的培訓體系,良好的機構和人員的評價系統。該子系統最活躍、最不穩定,也最難控制,是最重要的子系統。
“機”子系統包括儀器、設備,特別是關鍵儀器、設備的校準、確認、使用與維護等。基本功能:關鍵儀器、設備經適當確認,校準的范圍和精度滿足相關檢驗的要求,按相應的操作規程使用和維護。藥品檢驗機構現階段對儀器設備的確認工作做得不夠,是今后改進的重要方向。
“料”子系統包括待檢樣品、檢前留樣、檢驗所需要的對照品、標準品、菌種、試藥、試劑、氣體、容器、耗材等。基本功能:待檢樣品能真實反映商品(產品)的質量屬性,符合審計要求的穩定的供應商或生產商,按規定程序、條件接收、貯存、發放對照品、標準品、菌種、試藥、試劑、氣體、容器、耗材。
“法”子系統是藥品檢驗的管理標準、檢驗標準、操作規程、各種記錄及報告書,也就是文件系統,包括質量手冊、程序文件,管理程序、檢驗標準,操作規程,各種記錄,報告書等。基本功能:文件層次清晰,所有文件均受控,管理和操作都以文件為依據,如實記錄各種操作,即沒有記錄即沒有發生,避免口頭傳遞、交流重要信息,報告書寄送及時、存檔安全有序。檢驗中標準的更新、補充檢驗方法與項目、主管部門的臨時要求都是活躍的變量,應該特別給予關注。
“環”子系統包括檢驗的外部環境和內部環境,主要是檢驗房屋內的環境。主要功能:足夠的空間和功能明確的區域,相關操作、儀器與設備所在空間及對照品、標準品、菌種、試藥、試劑等的貯存條件應在規定溫度、濕度、光照的環境內,精密儀器定置環境防震防磁防潮,無菌、微生物限度、不溶性微粒、內毒素檢查等操作在相應的潔凈環境下,危險物品的防燃防爆環境與設施,檢驗的各種操作防止相互影響,確保檢驗環境對人員的保護。
2.2 FM EA在“人”子系統中的應用
藥品檢驗實驗室“人”子系統包括組織架構、職責、資質、培訓、健康等,見表4和表5。可見,失敗模式1和7由于RPN低于9而沒有采取新措施降低風險就直接接受了,其余9個失敗模式都針對原因和原有控制方法采取了新的措施來降低RPN使其達到可接受的程度。藥品檢驗既是一個復雜的系統,又是一種服務。在服務FMEA中,通常可在發生度和可檢測度范圍內做預期改變,而嚴重度保持不變[4]。
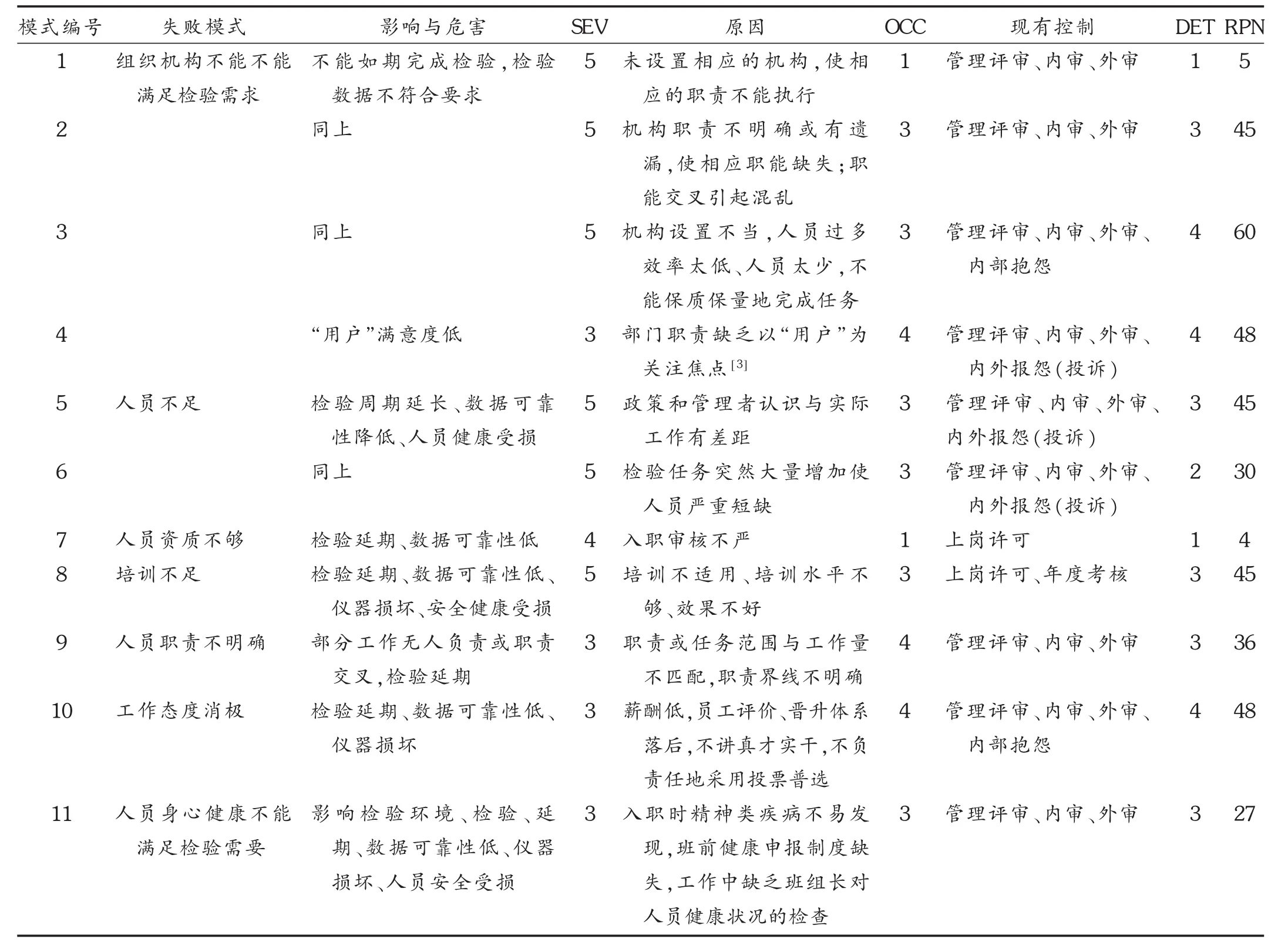
表4 “人”子系統中的FMEA分析評估

表5 “人”子系統中的FMEA分析控制
3 討論
FMEA作為一種風險管理的工具,是重要的早期預防活動,可防止故障和錯誤的發生并阻止對客戶造成損害[4]。FMEA對現已存在的藥品檢驗系統可找出失敗模式,并進行分析控制,提高藥品檢驗單位的形象和競爭力,提高客戶的滿意度;也可用于設計、建造全新的實驗室,系統變更或設計一個新的流程時,找出潛在的失敗模式,并尋求解決控制的方法,選擇具有更高可靠性和安全性的過程或服務,使風險得以削弱到大家能接受的程度,讓技術服務在提供前就趨于完美。FMEA可為藥品檢驗管理體系的持續改進提供依據和相應措施,為藥品檢驗實驗室的管理體系提供全新、科學、有力的工具和方法,對藥品檢驗實驗室的管理必將產生深遠影響。
對導致整個系統或系統主要功能發生失敗的部件(子系統)進行FMEA分析控制非常有效。藥品檢驗系統非常復雜,具有多種功能,且由不同的子系統組成,需要分析大量詳細的系統信息、很多可能的工作模式,進行FMEA有較多困難且煩瑣,有待繼續利用FMEA對其他子系統逐步進行評價控制研究。
[1]國家食品藥品監督管理局藥品認證中心.藥品GMP指南·口服固體制劑分冊[M].北京:中國醫藥科技出版社,2011:4-8.
[2]GB/T7826-2012/IEC60812:2006.系統可靠性分析技術失效模式和影響分析(FMEA)程序[S].
[3]李 鈞,李志寧.制藥質量體系及GMP的實施[M].北京:化學工業出版社,2012:58.
[4]Stamatis MH.失效模式影響分析FMEA從理論到實踐[M].第2版.北京:國防工業出版社,2005:5-23,157.
R954
A
1006-4931(2016)04-0015-04
詹宇杰,主管藥師,研究方向為藥品檢驗及質量控制,(電話)023-86072759(電子信箱)zhan1226@qq.com。
2015-08-14;
2015-10-19)

