大菱鲆家系選育二代7種免疫因子的分析
田岳強, 郭建麗, 黃智慧, 3, 馬愛軍, 3, 王新安, 3, 楊 志, 曲江波
?
大菱鲆家系選育二代7種免疫因子的分析
田岳強1, 2, 郭建麗1, 黃智慧1, 3, 馬愛軍1, 3, 王新安1, 3, 楊 志4, 曲江波4
(1. 中國水產科學研究院黃海水產研究所農業部海洋漁業可持續發展重點實驗室青島市海水魚類種子工程與生物技術重點實驗室山東青島266071; 2. 上海海洋大學, 上海201306; 3. 青島海洋科學與技術國家實驗室海洋生物學與生物技術功能實驗室, 山東青島 266071; 4. 煙臺開發區天源水產有限公司, 山東煙臺 264003)
為選育高成活率的大菱鲆()抗鰻弧菌()群體, 對30個大菱鲆選育二代家系(F2)和1個普通養殖群體進行鰻弧菌攻毒實驗(周期為14 d), 統計分析死亡率。選取死亡率不同的6個選育家系和普通養殖群體構成7個實驗組, 采用半定量-聚合酶鏈反應(semi-quantitative polymerase Chain reaction , RT-PCR) 技術對它們肝臟、脾臟、頭腎的相關免疫因子——溶菌酶(Lysozyme)、抗菌肽(Hepcidin)、熱激蛋白70(HSP70)、熱激蛋白90(HSP90)、免疫球蛋白(IgM)、C-型凝集素(C-type lectin)、Lily-型凝集素(Lily-type lectin) 的表達量開展研究, 并應用SPSS 16.0軟件對攻毒前后各免疫因子的表達量與攻毒后存活率之間的相關性進行分析。研究結果表明: 攻毒前后選育家系幼魚肝臟、脾臟、頭腎中7個免疫因子的表達量普遍高于普通養殖幼魚, 且在7個實驗組中, 攻毒后的表達量相較攻毒前均呈現下降趨勢; 攻毒前, 肝臟中lysozyme、IgM的表達量與存活率為極顯著性正相關(<0.01), HSP70、HSP90、C-type lectin、Lily-type lectin的表達量與存活率為顯著性正相關(<0.05); 脾臟中, Hepcidin、HSP70和HSP90的表達量與存活率為極顯著性正相關(<0.01); 頭腎中, HSP70的表達量與存活率為顯著正相關(<0.05)。綜上, 可以推斷選育家系相對于普通養殖群體大菱鲆抗鰻弧菌性能更強, 且7種免疫因子在鰻弧菌感染魚體的過程中發揮重要的抗感染作用; 從F2中獲得一個抗鰻弧菌性能較強的家系(23號), 可用于今后大菱鲆抗鰻弧菌品系的選育指導工作, 為大菱鲆高成活率群體的選育提供參考資料和理論依據。
大菱鲆(); 鰻弧菌(); 選育家系; 免疫因子; RT-PCR
大菱鲆(), 隸屬于鰈形目(Pleuronectiformes)、菱鲆科(Bothidae)、菱鰈屬(), 為原產于北歐的底棲冷水性魚類[1]。1992年中國水產科學院黃海水產研究所率先將其引進中國, 目前大菱鲆養殖已發展為年產量超過60 000t的海水養殖支柱產業[2]。但是中國進口大菱鲆群體種質較單一, 加之累代養殖和近親交配, 其種質退化日趨明顯, 并且伴隨著大菱鲆養殖業的迅猛發展和集約化程度的不斷提高, 病害問題日漸突出[3-5], 嚴重制約了大菱鲆養殖產業的可持續發展。
自“十一五”開始, 中國陸續立項支持大菱鲆良種選育的相關研究, 旨在選育出生長快、抗逆性強的新品種[2]。從2007年起, 本課題組采用電子標記輔助的大規模家系選育技術和分子輔助育種技術, 開始了大菱鲆的良種選育工作[6-10]。目前已成功選育出生長快、成活率高的新品種“多寶一號”以及耐高溫[9-10]的新品系。然而, 大菱鲆高成活率品系的選育及相關抗病的詳細機制國內鮮有報道, 為了指導本課題組高成活率品系的選育, 開展此研究。眾所周知, 溶菌酶、抗菌肽、熱激蛋白、免疫球蛋白和凝集素等均是魚類重要的免疫因子,國內外許多專家對它們在抵抗感染性致病菌的防御機制中起到的作用進行研究。如周麗等[11]對引起牙鲆體表潰爛的病原纖毛蟲——指狀擬舟蟲()誘導牙鲆免疫反應產生的免疫球蛋白進行分析, 發現病原纖毛蟲免疫注射牙鲆, 可誘導牙鲆發生特異性免疫反應, 產生抗體; Shike等[12-13]報道抗菌肽mRNA表達量變化受外界病原微生物的正調控; 林天勢等[14]用病原菌感染大黃魚(), 感染48 h后, 各組織HSP90表達量明顯上升等。
本研究對以高成活率為選育目標的大菱鲆家系選育二代和普通養殖群體幼魚進行鰻弧菌()攻毒實驗, 檢驗選育家系抗鰻弧菌性能, 并分析了肝臟、脾臟和腎臟中的多種免疫因子的表達水平及其與存活率的關系, 為大菱鲆高成活率性狀選育提供參考資料和理論依據。
1 材料與方法
1.1 實驗材料
1.1.1 實驗用魚
實驗家系用魚來源于本課題組于2010年5月在煙臺天源水產國家級良種場所構建的同批次選育家系[8]。于2011年5月開展攻毒實驗, 即從30個家系中分別挑取40尾幼魚, 從購自日照養殖場的普通群體中挑取40尾幼魚, 同時從選育家系與普通養殖群體中共挑選40尾組成1個混合組, 共計32組, 分別養殖于32個直徑110 cm、高68 cm的圓柱形玻璃鋼桶內。養殖海水為過濾深井海水, 循環流水, 桶內海水高度控制在50 cm, 水溫為(13±1)℃, 氧氣泵連續通氧, DO≥7.3 mg/L, 鹽度為28‰, 早晚各喂1次, 暫養14 d。為保證后續攻毒實驗用菌量在各組之間無顯著差異, 挑選的所有用魚規格均勻[體長均值為(17.79±2.8) cm, 體質量均值為(275.98±21.36)g, 均值±標準差]。后期免疫分析所用的6個家系是根據攻毒后死亡率的高低, 從30個家系中挑選獲得。
1.1.2 鰻弧菌
攻毒實驗所用的鰻弧菌為本實驗室保存并經過鑒定的鰻弧菌菌株。菌株接種于滅菌的TSB培養基(TSB 30g, NaCl 15g, 蒸餾水1 000 mL溶解), 28℃, 200 r /min培養約24 h, 測定OD600值, 并用0.9%生理鹽水稀釋至已測定的半致死濃度106cfu/mL。
1.2 實驗方法
1.2.1 攻毒實驗
暫養結束后, 參照文獻[15-16]的方法, 對選育家系及普通養殖群體幼魚腹腔注射1μL/g[17]經過稀釋的鰻弧菌菌液, 同時對混合組腹腔注射1 μL/g 0.9%生理鹽水作為對照。感染期間水溫控制在(14±1)℃,實驗持續14 d, 統計死亡情況并及時撈出死魚。對每組死魚隨機抽取3尾進行涂片鏡檢, 均發現鰻弧菌。
1.2.2 樣品采集
在注射前和注射后第15天分別從各組隨機取5尾大菱鲆幼魚, 剪取幼魚肝臟、脾臟、頭腎, 置于加入組織保護液的無RNA酶離心管中, 即為肝臟、脾臟、頭腎的樣品。樣品放入液氮中保存備用。
1.2.3 免疫因子的測定和分析
1.2.3.1 RNA提取
利用TIANGEN動物組織總RNA提取試劑盒提取肝臟、脾臟和頭腎樣品的RNA。將5個樣本按照等同的RNA含量進行混合, 分裝并用封口膜封存, –80℃儲存。
1.2.3.2 RNA反轉錄成cDNA
在RNase-free離心管中加入1 μg混勻后的RNA以及1 μL random hexamer primer(隨機引物), 加入RNase-free ddH2O至12 ++μL, 65℃反應5 min。向上述反應體系中加入4 μL 5×Reaction Buffer、1 μL (20 U/μL)RIboLock RNase Inhibitor、2 μL 10 mmol/L dNTP Mix以及1 μL(200 U/μL)RevertAid M-MuLV R反轉錄酶, 反應體系總體積為20 μL。PCR擴增, 反應條件為: 25℃ 5min, 42℃ 60 min, 75℃ 5 min。
1.2.3.3 免疫因子的PCR擴增與分析
對7種免疫因子的特異引物(表1), 在Taq polymerase的作用下進行特異性擴增, 并用β-actin作為內參對RT-PCR產物進行分析。PCR反應體系20 μL: cDNA 1 μL, 10×buffer 1.5 μL, 上、下游引物各0.5 μL, 2.5 mmol/L dNTPs 1.3 μL, Taq DNA聚合酶0.2 μL, 無RNA水15 μL。PCR反應條件: 94℃預變性5 min; 94℃變性30 s, 退火45 s, 72℃延伸45 s, 按表1設置循環數; 72℃延伸5 min, 反應結束。利用1.7%瓊脂糖凝膠電泳系統對PCR產物進行檢測, 利用凝膠成像軟件(UV-systems)對條帶強度進行分析。每個樣品的凝膠電泳進行3次重復, 灰度值以[均值±標準差]表示。

表1 PCR反應中特異性引物的核苷酸序列
1.3 數據處理
采用SPSS16.0統計軟件進行單因素方差分析, 用Duncan法進行多重比較,<0.05為差異顯著。
進行皮爾遜檢驗(Pearson correlation), 對攻毒前各免疫因子的相對表達量與大菱鲆攻毒后的死亡率進行相關性分析。Pearson相關系數公式為:
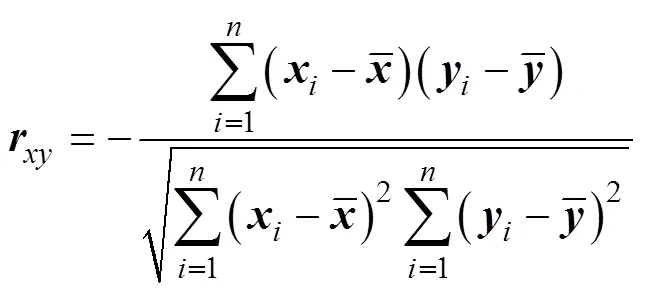
2 結果
2.1 攻毒后大菱鲆的累積死亡情況
注射生理鹽水的混合組在實驗期間未出現死亡, 可排除養殖環境和注射對實驗的干擾。攻毒后, 30個家系的累積死亡率在(23.34±4.72)%~(75.00±2.36)%, 普通養殖群體的累積死亡率為(81.67±2.35)%, 各家系的死亡率均低于普通養殖群體(編號31)(圖1); Duncan多重比較結果表明, 30個家系中有27個的累積死亡率顯著低于普通養殖群體(<0.05)。選取死亡率由低到高具有代表性的6個家系作為家系組, 分別命名為家系組1~6, 死亡率平均值分別為25.00%、33.33%、41.65%、56.66%、66.66%、75.00%, 對應家系號為23號、6號、8號、7號、15號、5號, 普通選育群體命名為普通組, 共7個實驗組用于免疫因子分析。
2.2 肝臟攻毒前后各免疫因子的表達分析
應用7種免疫因子的特異性引物對肝臟cDNA進行PCR擴增, PCR產物利用1.7%瓊脂糖凝膠電泳系統進行檢測, 利用凝膠成像軟件(UV-systems)分析條帶強度, 由此得出攻毒實驗對大菱鲆肝臟7種免疫因子表達水平的影響, 如圖2。應用SPSS16.0分別對各實驗組肝臟之間免疫因子的表達量進行方差分析及多重比較, 并用檢驗分析7種免疫因子攻毒前后的差異性, 結果見表2。肝臟中各免疫因子的表達量在攻毒后普遍呈現下降趨勢; 攻毒前, 6個家系組的各免疫因子表達量全部高于普通組(<0.05), 7個實驗組的免疫因子表達量的高低與其存活率呈一定的正相關關系; 攻毒后, 大多數家系組的免疫因子表達量高于普通組(<0.05)。
2.3 脾臟攻毒前后各免疫因子的表達分析
應用7種免疫因子的特異性引物對脾臟cDNA進行PCR擴增, 結果見圖3。應用SPSS16.0分別對各實驗組脾臟之間免疫因子的表達量進行方差分析及多重比較, 并用檢驗分析免疫因子攻毒前后的差異性, 結果見表3。脾臟中各免疫因子的表達量在攻毒后普遍呈現下降趨勢; 無論攻毒前后, 6個家系組的各免疫因子表達量普遍高于普通組(<0.05); 攻毒前, 7個實驗組的免疫因子表達量的高低與其存活率呈一定的正相關關系。
B. 攻毒前; A. 攻毒后(圖3、圖4同)
B. before the challenge; A. after the challenge (same as in Fig. 3 and Fig. 4)
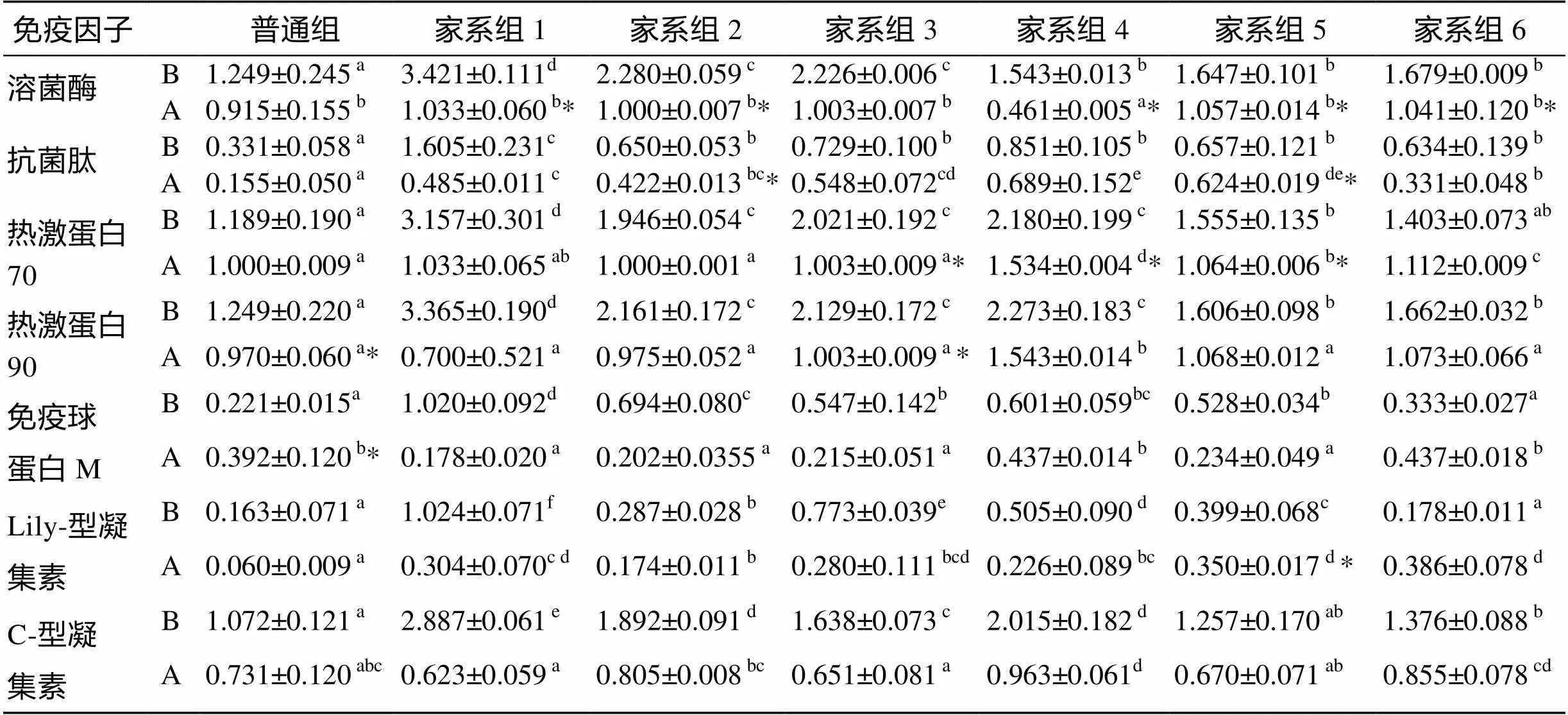
表2 大菱鲆肝臟7種免疫因子灰度值測定結果
注: B. 攻毒前, A. 攻毒后。同行中, 標有不同小寫字母者表示同種免疫因子相同實驗階段下不同組間差異顯著(<0.05), 標有相同小寫字母者表示組間差異不顯著(>0.05); 標有“*”者表示該組在不同實驗階段下差異顯著(<0.05), 沒標“*”者表示該組在不同實驗階段下差異不顯著(>0.05)(表3, 表4同)

表3 大菱鲆幼魚脾臟7種免疫因子灰度值測定結果
2.4 頭腎攻毒前后各免疫因子的表達分析
應用7種免疫因子的特異性引物對頭腎cDNA進行PCR擴增, 結果見圖4。應用SPSS16.0分別對各實驗組頭腎免疫因子攻毒前后的表達量進行方差分析及多重比較, 并用檢驗分析免疫因子攻毒前后的差異性, 結果見表4。頭腎中各免疫因子的表達量在攻毒后普遍呈現下降趨勢; 無論攻毒前后, 6個家系組的免疫因子表達量普遍高于普通組(<0.05); 攻毒前, 7個實驗組免疫因子的表達量與其存活率相關關系不如肝臟與脾臟中明顯。

表4 大菱鲆幼魚頭腎7種免疫因子灰度值測定結果
2.5 攻毒前7種免疫因子表達量與存活率的相關性分析
將各實驗組肝臟、脾臟和頭腎中7種免疫因子攻毒前的表達量與攻毒后的存活率(存活率=1–死亡率)進行相關性分析, 如表5所示。肝臟中, 溶菌酶(Lysozyme)、免疫球蛋白M(IgM)的表達量與存活率為極顯著性正相關(<0.01), 熱休克蛋白70(HSP70)、熱休克蛋白90(HSP90)、C-型凝集素(C-type lectin)、Lily-型凝集素(Lily-type lectin)的表達量與其為顯著性正相關(<0.05); 脾臟中, 抗菌肽(Hepcidin)、熱激蛋白70(HSP70)和熱激蛋白90(HSP90) 的表達量與存活率為極顯著正相關(<0.01); 頭腎中熱休克蛋白70(HSP90)的表達量與存活率為顯著正相關(<0.05)。

表5 大菱鲆肝臟、脾臟和頭腎的7種免疫因子攻毒前的表達量與存活率的相關性分析
注: 顯著相關(<0.05); **. 極顯著相關(<0.01)
3 討論與小結
非特異性免疫系統是動物抵御外界病原體侵染的重要防線, 魚類作為較低等的脊椎動物, 相對于哺乳動物而言, 其特異性免疫系統機制還處于較原始的狀態, 因此在抵抗入侵病原微生物生理反應中, 魚類的非特異性免疫防御系統所承擔的角色顯得更為關鍵[18-19]。魚類的肝臟、脾臟和頭腎都是合成免疫因子的重要器官, 加之溶菌酶、抗菌肽、熱激蛋白70、熱激蛋白90、IgM、C-型凝集素、Lily-型凝集素7種重要的免疫因子在魚體抵抗感染性致病菌的最前沿防御機制中起著至關重要的作用。因此, 分析各重要免疫因子在肝臟、脾臟和頭腎組織中的表達情況, 可以在一定程度上對機體的抗病力進行判斷。
本研究立足于前人經驗, 應用Duncan多重比較死亡率, 選取6個F2家系和1個普通群體, 采用RT-PCR手段對它們肝臟、脾臟和頭腎的7種免疫因子展開研究, 分析攻毒前肝臟、脾臟和頭腎中相關免疫因子的表達量與攻毒后存活率之間的相關性, 分析結果討論如下:
攻毒后, 各家系的死亡率均低于普通養殖群體, 30個家系中有27個家系的累積死亡率顯著低于非選育群體(<0.05)。說明F2選育家系在抗鰻弧菌方面優于普通養殖群體。
肝臟、脾臟與頭腎中, 無論攻毒前后, 6個家系組肝臟、脾臟、頭腎中7個免疫因子的表達量普遍高于普通組, 見表2、表3、表4。這表明, 免疫因子在家系組的重要免疫器官中的表達能力優于普通組, 初步判定選育家系F2的抗鰻弧菌性能優于普通養殖群體。
在肝臟、脾臟和頭腎中, 對比攻毒前后多組免疫因子的表達量出現了顯著差異, 作者推測這些免疫因子在鰻弧菌感染魚體的過程中, 發揮了重要的抗感染作用。然而, 各免疫因子在攻毒后, 表達量出現下降趨勢, 與之前部分學者得出的上升趨勢的結論不完全一致[20-24]。如強俊等[20]對“吉富”、“新吉富”、“埃及尼羅”3種不同品系的尼羅羅非魚()進行高密度脅迫發現, 應激48 h內, 吉富羅非魚(Jifu)與新吉富羅非魚(New Jifu)溶菌酶活力水平以及肝臟HSP70 mRNA水平呈先上升后下降的變化, 埃及尼羅羅非魚(Egypt)血清溶菌酶活力與肝臟HSP70 mRNA水平在應激后48 h內始終高于應激前(<0.05)。作者認為是由于取樣時間不同造成的。之前的研究均在攻毒實驗后的第24、48小時等時間點取樣, 本實驗目的是對各家系的抗性性能進行分析, 篩選出抗鰻弧菌性能較強的家系, 為今后的抗性選育工作提供理論依據, 因此在實驗設計中, 模擬養殖環境, 避免取樣后魚缸中密度變化造成實驗誤差, 在實驗結束即攻毒后第15天取樣, 該時間點可能不在各免疫因子表達量增加的階段, 而正好處于免疫因子表達下降階段。
對比表2、表3、表4, 肝臟、脾臟和頭腎中, 相同實驗組在攻毒前后, 表達量出現顯著性差異的免疫因子并不一致。作者推測, 這3種不同的免疫器官, 在抗鰻弧菌時, 其免疫應答機理不同, 當外源病毒侵染魚體時, 3個器官起免疫主導作用的免疫因子不同。
分析免疫因子攻毒前表達量與存活率之間的相關性發現, 肝臟中, Lysozyme、IgM的表達量與存活率為極顯著性正相關(<0.01), HSP70、HSP90、C-type lectin、Lily-type lectin的表達量與其為顯著性正相關(<0.05); 脾臟中, Hepcidin、HSP70和HSP90 的表達量與存活率為極顯著正相關(<0.01); 頭腎中HSP70的表達量與存活率為顯著正相關(<0.05)。作者將得出的與存活率成顯著或者極顯著正相關的免疫因子作為可靠的免疫指標, 對今后大菱鲆高成活率育種工作提供指導。以這些指標為依據, 作者對6個家系組攻毒前各免疫因子的表達量進行分析, 如表2、表3、表4。攻毒前, 家系組1的肝臟、脾臟、頭腎中, 與存活率顯著相關的免疫因子表達量均最高, 其對應的存活率為75.00%, 從而可以判斷該家系組在抗鰻弧菌方面相對于其他選育家系有較強的優勢, 其對應的家系號為23。今后在抗鰻弧菌品種的選育過程中, 可以選取此家系為親本繼續構建, 也可取其存活個體進行抗鰻弧菌分子標記的篩選工作等。
通過本實驗, 可以推測F2相對于普通養殖群體大菱鲆, 在抗鰻弧菌方面具有一定的優勢, 得到一個抗鰻弧菌性能較好的家系23號, 而且以上7種非特異免疫因子在鰻弧菌感染魚體的過程中, 發揮重要的抗感染作用。得出了一些與存活率成顯著或者極顯著正相關的免疫因子, 可作為可靠的免疫指標, 指導大菱鲆高成活率育種工作。
參考文獻:
[1] Blanquer A, Alayse J P. Allozyme variation in turbot() and brill() (Osteichthyes, Pleuronectiformes, ScoPhthalmidae) throughout their range in Europe[J]. Fish Biology, 1992, 41(5): 725-736.
[2] 雷霽霖, 劉新富, 關長濤. 中國大菱鲆養殖20年成就和展望——慶祝大菱鲆引進中國20周年[J]. 漁業科學進展, 2012, 33(4): 123-130.Lei Jilin, Liu Xinfu, Guan Changtao. Turbot culture in China for two decades: Achievements and prospect[J]. Progress in Fishery Sciences, 2012, 33(4): 123-130.
[3] 申雪艷, 宮慶禮, 雷霽霖, 等.進口大菱鲆L苗種的遺傳結構分析[J]. 海洋與湖沼, 2004, 35(4): 332-341. Shen Xueyan, Gong Qingli, Lei Jilin, et al. Population genetic structure analysis of the imported turbot seedlingsL. using RAPD and microsatellite technique[J]. Oceanologia Et Limnologia Sinica, 2004, 35(4): 332-341.
[4] 雷霽霖, 馬愛軍, 陳超, 等. 大菱鲆(L.)養殖現狀與可持續發展[J]. 中國工程科學, 2005, 7(5): 30-34. Lei Jilin, Ma Aijun, Chen Chao, et al. The present status and sustainable development of turbot (L.) culture in China[J]. Engineering Science, 2005, 7(5): 30-34.
[5] 秦蕾, 王印庚, 閻斌倫. 大菱鲆微生物性疾病研究進展[J]. 水產科學, 2008, 27(11): 598-602. Qin Lei, Wang Yingeng, Yan Binlun. Advances in research on diseases of turbotaffected by microorganisms[J]. Fisheries Science, 2008, 27(11): 598-602.
[6] 馬愛軍, 王新安, 雷霽霖. 大菱鲆()不同生長階段體重的遺傳參數和育種值估計[J]. 海洋與湖沼, 2010, 40(2): 187-194. Ma Aijun, Wang Xin’an, Lei Jilin. Genetic parameterization for turbot: implication to breeding strategy[J]. Oceanologia Et Limnologia Sinica, 2009, 40(2): 187-194.
[7] 馬愛軍, 王新安, 薛寶貴, 等. 大菱鲆()選育家系的構建和培育技術研究[J]. 海洋與湖沼, 2010, 41(3): 301-306. Ma Aijun, Wang Xin′an, Xue Baogui, et al. Investigation on family construction and rearing techniques for turbot (l.) family selection[J]. Ocea-n-o-logia Et Limnologia Sinica, 2010, 41(3): 301-306.
[8] 馬愛軍, 王新安, 黃智慧, 等. 大菱鲆()家系選育F2早期選擇反應和現實遺傳力估計[J]. 海洋與湖沼, 2012, 43(1): 57-61. Ma Aijun, Wang Xin′an, Huang Zhihui, et al. Response to selection and realized heritability for early growth in the second-generation breeded line of turbot (L)[J]. Oceanologia Et Limnologia Sinica, 2012, 43(1): 57-61.
[9] Liang X M, Ma A J, Wang X A, et al.Morphological comparison between a selected fast-growing strain and the common cultured strain of turbot[J]. Chinese Journal of Oceanology and Limnology, 2012, 30(4): 563-568.
[10] 馬愛軍, 黃智慧, 王新安, 等. 大菱鲆耐高溫品系選育及耐溫性能評估[J]. 海洋與湖沼, 2012, 43(4): 797-804. Ma Aijun, Huang Zhihui, Wang Xin'an, et al. The selective breeding of thermal tolerance family and appraisal of performance in turbot[J]. Oceanologia Et Limnologia Sinica, 2012, 43(4): 797-804.
[11] 周麗, 戰文斌, 宋微波, 等. 指狀擬舟蟲誘導牙鲆抗血清免疫球蛋白分析[J]. 中國水產科學, 2000, 7(2): 28-31. Zhou Li, Zhan Wenbin, Song Weibo, et al. Analysis of immunogloblin M (IgM) in serum of Japanese flounder,[J]. Journal of Fisheryences of China, 2000, 7(2): 28-31.
[12] Shike H, Lauth X, Westerman M E, et al. Bass hepcidin is a novel antimicrobial peptide induced by bacterial challenge[J]. European Journal of Biochemistry, 2002, 269(8): 2232-2237.
[13] Shike H, Shimizu C, Lauth X, et al. Organization and expression analysis of the zebrafish hepcidin gene, an antimicrobial peptide gene conserved among vertebrates[J]. Developmental & Comparative Immunology, 2004, 28(7-8): 747-754.
[14] 林天勢, 薛良義, 孫愛飛, 等. 溫度和病原菌感染對大黃魚熱激蛋白90基因表達的影響[J]. 中國細胞生物學學報, 2012, 34(6): 555-564. Lin Tianshi, Xue Liangyi, Sun Aifei, et al. Effect of temperature and pathogen on HSP90 expression in[J]. Chinese Journal of Cell Biology, 2012, 34(6): 555-564.
[15] 陳松林, 田永勝, 徐田軍, 等. 牙鲆抗病群體和家系的建立及其生長和抗病性能初步測定[J]. 水產學報, 2008, 32(5): 665-673. Chen Songlin, Tian Yongsheng, Xu Tianjun, et al. Development and characterization for growth rate and disease resistance of disease-resistance population and family in Japanese flounder()[J]. Journal of Fisheries of China, 2008, 32(5): 665-673.
[16] 莫照蘭, 徐永立, 張培軍. 養殖牙鲆鰻弧菌疫苗的研究[J]. 海洋科學, 2002, 26(4): 63-66. Mo Zhaolan, Xu Yongli, Zhang Peijun. Vaccination againston cultured flounder,[J]. Marine Sciences, 2002, 26(4): 63-66.
[17] 馬愛軍, 郭建麗, 王新安, 等. 大菱鲆選育家系抗鰻弧菌性能[J]. 中國水產科學, 2014, 21(3): 484-493. Ma Aijun, Guo Jianli, Wang Xin'an, et al. Family selection and estimation of disease resistance in turbot,[J]. Journal of Fishery Sciences of China, 2014, 21(3): 484-493.
[18] Bergljót M. Innate immunity of fish (overview)[J]. Fish & Shellfish Immunology, 2006, 20(2): 137-151.
[19] 佟雪紅, 徐世宏, 劉清華, 等. 大菱鲆早期發育過程中免疫器官的發生[J]. 海洋科學, 2011, 35(6): 62-67. Tong Xuehong, Xu Shihong, Liu Qinghua, et al. Ontogeny of immune organs during early developmental stages of turbot[J]. Marine Sciences, 2011, 35(6): 62-67.
[20] 強俊, 楊弘, 何杰, 等. 3種品系尼羅羅非魚生長及高密度脅迫后生理響應變化的比較[J]. 中國水產科學, 2014, 21(1): 142-152. Qiang Jun, Yang Hong, He Jie, et al. Comparison on growth performance in three different strains ofand physiological responses after short-term high stocking density stress[J]. Journal of Fishery Sciences of China, 2014, 21(1): 142-152.
[21] 萬文菊, 王紀亭, 石存斌, 等. 溶藻弧菌感染對劍尾魚HSP70基因表達的影響[J]. 大連水產學院學報, 2007, 22(5): 330-334. Wan Wenju, Wang Jiting, Shi Cunbin, et al. Gene expression of HSP70 in green swordtailexposed to[J]. Journal of Dalian Fisheries University, 2007, 22(5): 330-334.
[22] 魏然, 張士璀, 王長法, 等. 鹽度多牙鲆非特異性免疫功能的影響[J]. 海洋科學進展, 2003, 21(2): 209-213. Wei Ran, Zhang Shicui, Wang Changfa, et al. Effects of changes in salinity on nonspecific immune function of Japanese flounder[J]. Advances in Marine Science, 2003, 21(2): 209-213.
[23] 劉波, 王美垚, 謝駿, 等. 低溫應激對吉富羅非魚血清生化指標及肝臟HSP70基因表達的影響[J]. 生態學報, 2011, 31(17): 4866-4873. Liu Bo, Wang Meiyao, Xie Jun, et al. Effects of acute cold stress onserum biochemical and immune parameters and liver HSP70 gene expression in GIFT strain of Nile tilapia()[J]. Acta Ecologica Sinica, 2011, 31(17): 4866-4873.
[24] 劉洪展, 鄭風榮, 孫修勤, 等. 氨氮脅迫對刺參幾種免疫酶活性的影響[J]. 海洋科學, 2012, 36(8): 47-52. Liu Hongzhan, Zheng Fengrong, Sun Xiuqin, et al. Effect of exposure to ammonia nitrogen stress on immune enzyme of holothurian[J]. Marine Sciences, 2012, 36(8): 47-52.
(本文編輯: 譚雪靜)
Analysis of seven immune-related genes in selective second filial families (F2) of turbot ()
TIAN Yue-qiang1, 2, GUO Jian-li1, HUANG Zhi-hui1, 3, MA Ai-jun1, 3, WANG Xin-an1, 3, YANG Zhi4, QU Jiang-bo4
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Qingdao 266071, China; 2. Shanghai Ocean University, Shanghai 201306, China; 3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China; 4. Yantai Tianyuan Aquatic Limited Corporation, Yantai 264003, China)
For breeding turbot group with high survival rates and resistance to, 30 selective second filial families (F2) with a high survival rate and one common culture group of turbot (L.) were infected with. Six F2and one control groups were picked out as samples for detecting the following immune responses. Gene expressions of seven immune-related factors (lysozyme, HSP90, HSP70, IgM, hepcidin, C-type lectin, and lily-type lectin) were analyzed in turbot livers, spleens, and head kidneys using RT-PCR. Correlation analysis between the expression of these immune genes before infection and survival rate after challenge assays (period of 14 days) was carried out using SPSS 16.0 software. Results showed that regardless of samples infected with, the expression of immune-related genes in the six F2populations was generally stronger than that in the control and the expression status of most immune genes was higher in the seven experimental groups withoutstress thanin the injected groups. The expression of the remaining six immune genes, except hepcidin, beforeinfection showed a significantly positive correlation with survival rate in livers (< 0.05) and the gene expression of lysozyme and IgM exhibited a highly significant positive correlation (< 0.01). Gene expressions of hepcidin, HSP70, and HSP90 showed a highly significant positive correlation with survival rate in spleens (< 0.01); the expression of HSP70 exhibited a significant positive correlation with survival rate in head kidneys (< 0.05). Therefore, F2selective families with a high survival rate could possess an outstanding resistance againstand the seven immune-related genes could play important roles in bacterial resistance of turbot. We obtained a selective family (No. 23) with a strong resistance against, which could guide selection of turbot strains with disease-resistance trait in the future and provide a reference and theoretical basis for turbot breeding.
;; selective second filial families; immune-related gene; RT-PCR
Mar. 5, 2015
S941
A
1000-3096(2016)09-0009-09
10.11759/hykx20150305002
2015-03-05;
2015-05-07
國家863 計劃項目(2012AA10A408-8); 現代農業產業技術體系建設專項基金共同資助(CARS-50-G01); 中國博士后科學基金項目(2015M572096); 山東省自然科學基金項目(ZR2014CP001)
田岳強(1988-), 男, 山東省泰安人, 碩士, 主要從事魚類遺傳育種研究, 電話: 15865385685, E-mail: tyqiang1988@163.com; 馬愛軍, 通信作者, 電話: 0532-85835103, E-mail: maaj@ysfri.ac.cn
[Foundation: National 863 Program (2012AA10A408-8); Modern Agro-Industry Technology Research System (CARS-50-G01); China Postdoctoral Science Foundation(2015M572096); the Shandong Provincial Natural Science Foundation (ZR2014CP001)]

