ERCC1、TUBB3、RRM1、TOP2A基因聯(lián)合檢測在中晚期食管癌個體化治療中的應用
李偉民,趙建亭,楊曉光,程鑫,閆冀豫,鄺文明
(鶴壁市人民醫(yī)院,河南鶴壁458030)
?
ERCC1、TUBB3、RRM1、TOP2A基因聯(lián)合檢測在中晚期食管癌個體化治療中的應用
李偉民,趙建亭,楊曉光,程鑫,閆冀豫,鄺文明
(鶴壁市人民醫(yī)院,河南鶴壁458030)
目的 觀察癌組織中切除修復交叉互補基因1(ERCC1)、β微管蛋白3(TUBB3)、核苷酸還原酶亞基1(RRM1)、拓撲異構酶ⅡA(TOP2A)基因聯(lián)合檢測指導中晚期食管癌患者個體化治療的效果。方法 將108例中晚期食管癌患者隨機分為觀察組72例和對照組36例,對照組采用順鉑聯(lián)合5-氟尿嘧啶化療,觀察組先用分支DNA液相芯片技術檢測食管癌組織中的ERCC1、TUBB3、RRM1、TOP2A基因,根據檢測結果制定個體化治療策略。評價兩組臨床總有效率(RR),記錄疾病進展時間(TTP)、中位生存時間(OS),觀察不良反應。結果 觀察組和對照組RR分別為52.78%、30.56%,P<0.05;觀察組、對照組中位TTP分別為10.8、5.6個月,OS分別為10.0、12.7個,P均<0.05。觀察組嚴重惡心嘔吐、血紅蛋白減少發(fā)生率低于對照組 (P均<0.05)。結論 ERCC1、TUBB3、RRM1、TOP2A基因聯(lián)合檢測指導中晚期食管癌個體化治療,可顯著提高患者近期療效,改善預后,減輕不良反應。
食管癌;切除修復交叉互補基因1;β微管蛋白3;核苷酸還原酶亞基1;拓撲異構酶ⅡA;個體化治療
食管癌是我國常見惡性腫瘤之一,病死率居各類惡性腫瘤第4位。由于早期食管癌無特異性臨床癥狀,大多患者確診時已為中晚期,錯失最佳手術治療時機,預后較差,化療是其主要的姑息療法[1]。近年來研究[2]表明,腫瘤細胞DNA修復及其相關基因的表達是導致藥物反應個體化差異的主要因素。提示前瞻性地檢測腫瘤基因,并根據檢測結果制定個體化治療方案,可提高化療療效。2012年2月~2015年8月,我們在檢測中晚期食管癌患者癌組織切除修復交叉互補基因1(ERCC1)、β微管蛋白3(TUBB3)、核苷酸還原酶亞基1(RRM1)、拓撲異構酶ⅡA(TOP2A)基因表達水平的基礎上制定個體化治療策略,并評估其在提高療效和改善預后等方面的價值。現報告如下。
1 資料與方法
1.1 臨床資料 納入標準:①經病理確診為中晚期食管癌,均已錯失手術治療時機或術后復發(fā);②美國東部協(xié)作腫瘤組(ECOG)評分評價患者體力≤2分,預計生存期﹥3個月;③有臨床可測量的病灶;④輔助化療停止6個月或既往未行化療;⑤血常規(guī)、基礎骨髓功能及肝、腎功能均達到化療標準。排除標準:①合并精神疾病、潰瘍性結腸炎及嚴重心、肝、肺、腎等重要臟器疾病者;②妊娠期或哺乳期患者;③臨床、隨訪資料不完整者。選取同期鶴壁市人民醫(yī)院腫瘤科收治的中晚期食管癌患者108例,男65例、女43例,年齡(46.94±5.58)歲;腫瘤位于食管上段8例,中段53例,下段47例;TNM分期Ⅱ期18例,Ⅲ期53例,Ⅳ期27例;曾行放療72例。將患者隨機分為觀察組72例和對照組36例,兩組臨床資料具有可比性(P均>0.05)。本研究經院醫(yī)學倫理委員會審批,患者均知情同意。
1.2 化療方法 對照組采用順鉑(DDP)聯(lián)合5-氟尿嘧啶(5-FU)化療,DDP 20 mg/m2,5-FU 500 mg/m2,靜脈滴注,第1~5天,28 d為1個周期,至少化療4個周期。觀察組則先采用分支DNA液相芯片技術檢測食管癌組織中的ERCC1、TUBB3、RRM1、TOP2A基因,根據檢測結果制定個體化治療策略。ERCC1基因低表達選擇DDP,TUBB3基因低表達或中表達選擇多西他賽(DOC),RRM1基因低表達或中表達選擇吉西他濱(GEM),TOP2A基因低表達選擇依托泊苷(ETO)。用藥劑量:DDP 25 mg/m2,靜脈滴注,第1~3天,28 d為1個周期;DOC 75 mg/m2,靜脈滴注,21 d為1個周期;GEM 1 000 mg/m2,靜脈滴注,第1、8、15天,28 d為1個周期;ETO 100 mg/m2,靜脈滴注,第1天,21 d為1個周期,至少化療4個周期。一旦患者出現病情進展,則按照對照組治療方案進行后續(xù)化療,最多進行6個周期化療。
1.3 療效、預后及不良反應評價方法 參照實體瘤療效評價標準1.0版進行療效評價[3]。完全緩解(CR):腫瘤病灶全部消失,且至少維持4周;部分緩解(PR):腫瘤病灶總直徑縮小≥30%;進展(PD):腫瘤病灶總直徑增加≥20%或出現新發(fā)病灶;穩(wěn)定(SD):介于PR、PD之間。總有效率(RR)=(CR+PR)/(CR+PR+SD+PD)×100%。患者均獲得隨訪,隨訪終點為死亡或2016年2月29日,疾病進展時間(TTP)定義為從治療開始到確定腫瘤病灶客觀進展的時間,中位生存時間(OS)定義為從治療開始到患者死亡或者末次隨訪的時間。根據NCI常見毒性分級標準(CTC3.0版)對治療期間化療不良反應程度進行評價[4],分為0~Ⅳ度。
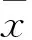
2 結果
2.1 兩組治療效果比較 觀察組CR 4例、PR 34例、SD 29例、PD 7例、RR 52.78%,對照組CR 1例、PR 10例、SD 18例、PD 7例、RR 30.56%;兩組RR比較,P<0.05。
2.2 兩組TTP、OS比較 觀察組、對照組中位TTP分別為10.8、5.6個月,OS分別為10.0、12.7個月;兩組TTP、OS比較,P均<0.05。
2.3 兩組化療不良反應發(fā)生率比較 觀察組嚴重惡心嘔吐、血紅蛋白減少發(fā)生率低于對照組 (P均<0.05)。見表1。
3 討論
化療是中晚期食管癌患者主要的姑息療法,以控制病情、提高生存質量、延長生存時間為主要治療目的[5]。含DDP的化療方案是目前治療中晚期食管癌的主要方案,化療有效率高,且價格低廉,但并非所有患者都可獲益[6]。
個體化選擇敏感藥物,是中晚期食管癌患者化療的關鍵所在。已有研究[7~10]報道,腫瘤對化療藥物的敏感性是由一系列相關基因共同調控的復雜過程,其中包括與鉑類藥物敏感性有關的ERCC1、與紫杉醇類藥物敏感性有關的TUBB3、與ETO敏感性有關的TOP2A、與GEM敏感性有關的RRM1等。既往對上述腫瘤基因與患者化療有效率和預后關系的回顧性研究較多,但臨床根據上述腫瘤基因制定中晚期食管癌患者個體化治療策略是否可行的研究尚不多見[11,12]。本研究采用分支DNA液相芯片技術對觀察組食管癌組織中的ERCC1、TUBB3、RRM1、TOP2A基因表達水平進行檢測,并根據檢測結果制定個體化治療策略,ERCC1基因低表達選擇DDP、TUBB3基因低表達或中表達選擇DOC、RRM1基因低表達或中表達選擇GEM、TOP2A基因低表達選擇ETO,對照組則接受DDP聯(lián)合5-FU化療。結果顯示,觀察組治療有效率為52.78%,明顯高于對照組(30.56%),差異具有統(tǒng)計學意義。此外,隨訪結果顯示,觀察組中位TTP、OS均較對照組有所延長,組間差異具有統(tǒng)計學意義。觀察組嚴重惡心嘔吐、血紅蛋白減少發(fā)生率低于對照組。表明ERCC1、TUBB3、RRM1、TOP2A基因聯(lián)合檢測指導制定中晚期食管癌患者個體化治療策略,可提高化療有效率,延長中位TTP、OS,并且患者部分化療不良反應嚴重程度明顯減輕。根據腫瘤基因檢測結果選擇敏感化療藥物進行治療可避免盲目的無效用藥,減少化療藥物累加的毒性,進而顯著減輕化療不良反應;另外,選擇敏感化療藥物治療的有效率明顯提高,患者的生存質量和化療耐受性均有所提高,使患者完成化療的積極性提高,并可能使患者一線治療失敗后可及時進行二線化療或后續(xù)其他治療,最終達到延長患者總生存時間的目的。
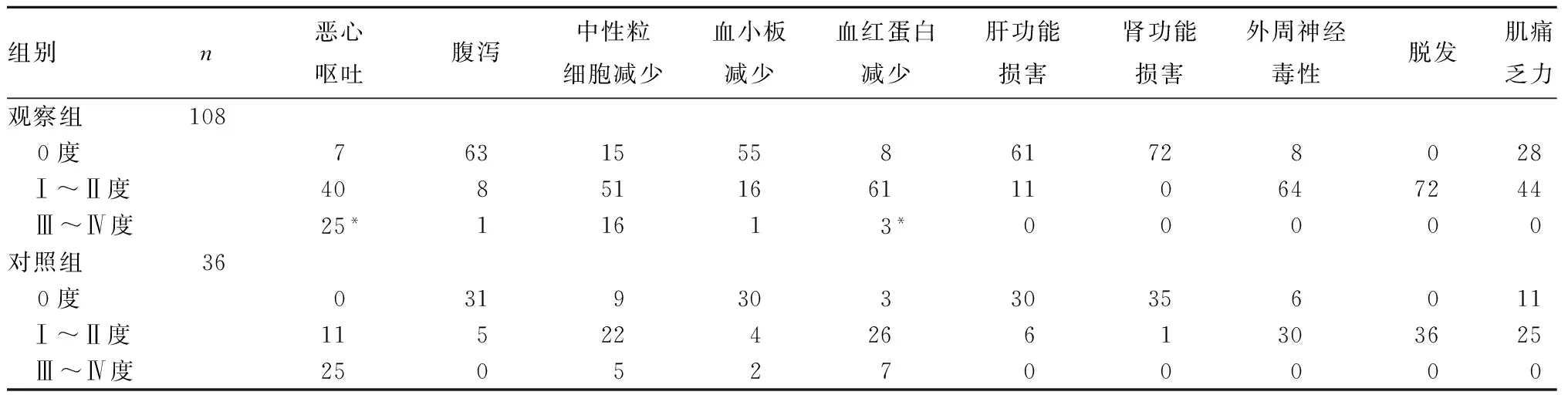
表1 兩組化療不良反應情況比較(例)
注:與對照組比較,*P<0.05。
綜上所述,基因檢測指導制定中晚期食管癌個體化治療策略,可顯著提高患者的近期治療效果,改善預后,且可顯著減輕化療不良反應,提高化療的耐受性,具有較高的臨床應用價值。
[1] 赫捷.中國食管癌流行病學現狀、診療現狀及未來對策[J].中國癌癥雜志,2011,21(7):501-504.
[2] Wang S, Pan H, Liu D, et al. Excision repair cross complementation group 1 is a chemotherapy-tolerating gene in cisplatin-based treatment for non-small cell lung cancer[J]. Int J Oncol, 2015,46(2):809-817.
[3] 任偉,閆婧.食管癌放化療后近期療效評價標準的研究進展[J].中華腫瘤雜志,2014,36(9):641-644.
[4] 李艦波,黃益波,鄭志范.替吉奧和順鉑方案同步調強放療治療胸中上段及胸上段食管癌的臨床研究[J].中國臨床藥理學雜志,2015,31(3):175-177.
[5] 林德榮,葉尚月,朱勝裕.調強放療同步化療治療中晚期食管癌的療效觀察[J].中國癌癥雜志,2014,24(2):157-160.
[6] Song T, Zhang X, Fang M, et al. Concurrent chemoradiotherapy using paclitaxel plus cisplatin in the treatment of elderly patients with esophageal cancer[J]. Onco Targets Ther, 2015,8:3087-3094.
[7] 劉萍.非小細胞肺癌組織中RRM1的表達與含吉西他濱方案耐藥的關系[J].鄭州大學學報:醫(yī)學版,2011,46(6):876-878.
[8] Ozcan MF, Dizdar O, Dincer N, et al. Low ERCC1 expression is associated with prolonged survival in patients with bladder cancer receiving platinum-based neoadjuvant chemotherapy[J]. Urol Oncol, 2013,31(8):1709-1715.
[9] 郭智興,林佳銳,陳智遠,等.TUBB3在體外化療藥物敏感試驗肝細胞癌標本中的表達及意義[J].廣東醫(yī)學,2012,33(18):2750-2753.
[10] Kaplan E, Gündüz U. Expression analysis of TOP2A, MSH2 and MLH1 genes in MCF7 cells at different levels of etoposide resistance[J]. Biomed Pharmacother, 2012,66(1):29-35.
[11] 丁龍龍.TOP2A基因預測蒽環(huán)類藥物治療乳腺癌療效研究進展[J].中國實用外科雜志,2014,34(5):456-458.
[12] Huang ZL, Cao X, Luo RZ, et al. Analysis of ERCC1, BRCA1, RRM1 and TUBB3 as predictors of prognosis in patients with non-small cell lung cancer who received cisplatin-based adjuvant chemotherapy: A prospective study[J]. Oncol Lett, 2016,11(1):299-305.
趙建亭(E-mail: zjt2052@163.com )
10.3969/j.issn.1002-266X.2016.42.026
R458.3
B
1002-266X(2016)42-0074-03
2016-07-23)

