異氟烷對發育期大腦的神經毒性及細胞周期的影響
丁 芳,羅 濤,王明玲,鄭利民
(北京大學深圳醫院,廣東 深圳 518036)
?
異氟烷對發育期大腦的神經毒性及細胞周期的影響
丁 芳,羅 濤,王明玲,鄭利民
(北京大學深圳醫院,廣東 深圳 518036)

目的 探討異氟烷對發育期大腦的神經元毒性和細胞周期的影響及其相關作用機制。方法 將32只7日齡C57BL/6J小鼠隨機分為4組:對照組自主吸入空氣,異氟烷2 h組吸入1.3%異氟烷2 h,異氟烷4 h組吸入1.3%異氟烷4 h,異氟烷6 h組吸入1.3%異氟烷6 h。實驗結束后6 h,取對照組和異氟烷6 h組小鼠腦組織,免疫組織化學方法檢測半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表達情況,FJB方法檢測神經元變性情況。另取4組小鼠新鮮海馬組織提取蛋白,利用Western blot免疫印跡方法檢測其細胞周期蛋白CyclinB1的表達情況。結果 異氟烷6 h組海馬區Caspase-3陽性細胞數及FJB陽性細胞數均明顯高于對照組(P均<0.05)。異氟烷4 h組、6 h組CyclinB1表達量均明顯高于對照組(P均<0.05)。結論 異氟烷可通過影響細胞周期蛋白CyclinB1表達進而引起發育期大腦海馬區神經元的凋亡,并且具有一定的時間依賴性。
異氟烷;發育期;神經毒性;CyclinB1;細胞周期
異氟烷是目前臨床常用的吸入麻醉藥之一,具有起效快、麻醉效能高及價格低廉等優點,在兒科麻醉中使用十分廣泛。但Jevtovic-Todorovic等[1]研究發現以異氟烷為代表的吸入麻醉藥可以引起發育期大腦神經元的過度凋亡,減少神經元密度,從而影響認知功能。近年來的基礎研究證實,吸入麻醉藥也可以引起非人類靈長類動物發育期大腦的神經退行性改變,甚至可以造成動物持續至成年后認知功能障礙[2-3]。另外在新生動物如新生大鼠腦發育高峰期,使用麻醉藥如七氟烷、異氟烷等作用一定時間后可能會導致神經毒性,表現為中樞神經系統組織病理學的改變,如神經細胞凋亡增多、抑制軸突發育等[4-5]。然而異氟烷引起神經毒性及神經元凋亡的具體機制尚未明確。本研究擬通過觀察發育期小鼠在吸入異氟烷后其大腦海馬區細胞周期蛋白CyclinB1的表達量及神經元凋亡情況,探討其可能機制。
1 實驗資料
1.1 實驗動物 7日齡C57BL/6J品系健康SPF 級小鼠購自廣東省醫學實驗動物中心(動物合格證號No:44007200018611),雌雄不限,體質量(4±1)g。
1.2 實驗儀器及試劑 異氟烷(百特公司);半胱氨酸天冬氨酸蛋白酶3(Caspase-3) 一抗(CST公司);FJB(南京科佰生物科技有限公司);Cyclin B1一抗(CST公司),羊抗兔二抗(Proteintech公司),磷酸鹽緩沖液(PBS)、正常羊血清、二氨基聯苯胺(DAB)、4%多聚甲醛等輔助試劑均購自碧云天公司,低溫恒冷凍切片機。
1.3 分組及麻醉模型建立 將上述小鼠隨機分為4組:對照組10只,異氟烷2 h組6只,異氟烷4 h組6只,異氟烷6 h組10只。對照組放置室溫環境,自主吸入空氣;異氟烷2 h、4 h、6 h組分別暴露于1.3%異氟烷中2 h、4 h、6 h。實驗方法:使用德國德爾格麻醉機將密閉麻醉箱中充滿麻醉氣體,使用氣體監護儀監測異氟烷的濃度為1.3%,等氣體濃度穩定后放入實驗小鼠,并保持溫度36~37 ℃。麻醉過程中, 觀察小鼠皮膚顏色和呼吸,直至麻醉結束。異氟烷2 h組麻醉過程中死亡1只。
1.4 免疫組化染色檢測海馬神經元Caspase-3表達情況 實驗結束后6 h,分別從對照組和異氟烷6 h組取4只小鼠,腹腔內注射10%水合氯醛深度麻醉后,迅速開胸,分離出心臟,用一次性頭皮靜脈針插管至左心室,同時剪開右心耳,經左心室先灌入4 ℃預冷0.9% NaCl溶液進行快速灌洗,待右心耳流出液慢慢變得透亮,肝臟及四肢顏色發白時改用4 ℃預冷4%多聚甲醛緩慢灌注約 30 min。斷頭后剪開頭皮去除周圍組織,打開小鼠顱骨,小心取出完整大腦置于4%多聚甲醛中固定24 h,再轉入20%蔗糖溶液中脫水至沉底。-80 ℃ OCT包埋劑速凍5 min后行冰凍切片,片厚25 μm。室溫下干燥大腦切片,0.1 mol/L PBS溶液洗3次,每次5 min。0.01 TritonX-100破膜30 min。PBS洗3次,每次5 min,羊血清封閉1 h后,Caspase-3一抗(1∶100)4 ℃孵育過夜。PBS洗3次,每次5 min,羊抗鼠二抗(1∶200)室溫下孵育1 h。PBS洗3次,每次5 min。DAB顯色5 min,晾干、脫水、透明,中性樹脂封片后拍照,用Image pro軟件進行分析。
1.5 Fluoro-Jade B(FJB)染色檢測神經元變性情況 取制作好的小鼠大腦海馬區冰凍切片室溫放置10 min,PBS洗3次,每次5 min。然后將載玻片放入染色盤,無水乙醇漂洗5 min,70%無水乙醇漂洗2 min,ddH2O漂洗2 min,0.06%高錳酸鉀漂洗10 min(此時取出FJB染液),ddH2O漂洗1 min,0.000 1% FJB漂洗10 min,反應時應盡量避免強光照射,ddH2O漂洗3次,每次1 min,吸水紙除去多余水分,用錫箔紙覆蓋載玻片,部分干燥8~10 min,二甲苯漂洗1 min,用DPX封片。熒光顯微鏡下采用藍色濾色片(激發光波長為450~490 nm)觀察并采集圖像。每只小鼠大腦海馬區隨機選取5個視野,對FJB 陽性細胞進行計數分析。
1.6 Western blot法檢測CyclinB1表達量 實驗結束后6 h,分別從4組中隨機選取6只小鼠,腹腔注射10 %水合氯醛深度麻醉后,斷頭剪開頭皮去除周圍組織,打開顱骨小心取出小鼠大腦。去除腦膜及血管后,取出大腦海馬區組織,于低溫條件下迅速提取蛋白質。蛋白變性后,經SDS-PAGE系統電泳分離,利用蛋白條帶轉至PVDF膜,5%脫脂奶粉(0.1% TBST稀釋)室溫下封閉1 h,TBST洗滌3次,5 min/次,兔抗鼠CyclinB1單克隆抗體(1∶500)4 ℃孵育過夜,第2天取出室溫放置30 min,TBST洗滌3次,5 min/次,孵育辣根過氧化物酶標記的二抗(1∶2 000)室溫1 h,TBST洗滌3次,10 min/次,滴加ECL發光試劑,顯影、攝片。然后用Image J程序進行條帶灰度分析。
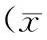
2 結 果
2.1 對照組和異氟烷6 h組Caspase-3表達情況 實驗結束6 h后,對照組大腦皮質、海馬區僅有極少量Caspase-3 陽性細胞表達,見圖1;異氟烷6 h組大腦皮質、海馬區有較多Caspase-3 陽性細胞(鏡下呈棕褐色),見圖2。對照組海馬區Caspase-3陽性細胞數為(5.500±1.323)個,異氟烷6 h組海馬區Caspase-3陽性細胞數為(27.250±3.198)個,2組比較差異有統計學意義(P<0.05)。

圖1 對照組海馬區及皮質Caspase-3表達情況

圖2 異氟烷6 h組海馬區及皮質Caspase-3表達情況
2.2 對照組和異氟烷6 h組FJB染色神經元變性情況 在熒光顯微鏡下,FJB陽性染色的神經元呈亮黃綠色,染色背景淺, FJB陽性染色的變性神經元主要分布在小鼠大腦皮質和海馬區,其中對照組有少量的陽性細胞,異氟烷6 h組陽性細胞明顯增多,見圖3及圖4。對照組海馬區FJB陽性細胞數為(5.000±0.912 9)個,異氟烷6 h組海馬區FJB陽性細胞數為(59.75±8.290)個,2組比較差異有統計學意義(P<0.05)。

圖3 對照組海馬區變性神經元FJB染色表現

圖4 異氟烷6 h組海馬區變性神經元FJB染色表現
2.3 各組CyclinB1表達情況 對照組CyclinB1表達量為100.00±17.54,異氟烷2 h組為105.3±15.78,異氟烷4 h組為148.2±23.80,異氟烷6 h組為164.9±15.35。異氟烷4 h組、6 h組CyclinB1表達量均明顯高于對照組(P均<0.05),而異氟烷2 h組CyclinB1表達量與對照組比較差異無統計學意義(P>0.05)。見圖5。
ctrl為對照組, Iso2h為異氟烷2 h組, Iso4h為異氟烷4 h組, Iso6h為異氟烷6 h組
3 討 論
從全麻藥開始應用于臨床到現在已經歷了將近160年,臨床上吸入麻醉藥因其安全、可靠、穩定、易于控制等特性而廣泛應用于產科及兒科。但研究發現吸入麻醉藥對發育期的哺乳動物大腦有潛在危害,對于幼齡動物而言,全麻藥的神經毒性作用在大腦發育激增期時最敏感[6]。在嚙齒類動物中,大腦發育激增期主要為動物出生后14 d之內,相當于人類孕晚期至出生后兩三年[7]。因此,本實驗以出生7 d的小鼠作為研究對象, 通過免疫組織化學方法檢測小鼠大腦海馬區Caspases-3的表達情況,使用FJB染色進行變性神經元的計數,從而觀察異氟烷是否可以引起小鼠海馬區神經元的凋亡;并通過Western blot方法檢測細胞周期蛋白CyclinB1表達情況,觀察異氟烷對神經元細胞周期的影響。
Caspase-3作為蛋白水解酶可誘導細胞凋亡,在正常情況下,胞質中的Caspases-3并無活性,是以Caspase-3前體形式存在,當收到凋亡信號后被激活從而誘導細胞凋亡的發生。由于Caspase-3的激活是細胞凋亡的關鍵步驟[8],不論在外源性凋亡途徑,還是在內源性凋亡途徑中,均需經過Caspases-3的激活才能誘導細胞的凋亡[9]。本研究發現,異氟烷6 h組新生小鼠海馬區Caspases-3陽性細胞數明顯多于對照組,說明1.3%異氟烷暴露6 h可以激活神經元細胞內Caspases-3,從而誘導凋亡的發生。
在神經科學的有關研究中,對于神經細胞變性壞死的檢測往往是一種必不可少的方法,在過去常使用鍍銀染色、TUNEL染色等方法檢測變性及凋亡的神經元。FJB染色與TUNEL染色有著良好的相關性,但是相較于TUNEL染色方法,FJB染色適用性更佳[10]。因此,FJB可用于標記變性的神經元,這為檢測神經細胞變性壞死提供了新的技術手段。本研究中FJB染色結果顯示異氟烷6 h組的新生小鼠海馬區變性神經元細胞數明顯多于對照組,說明1.3%異氟烷暴露6 h對新生小鼠海馬區神經元細胞具有明顯的損傷作用,證實了一定濃度的異氟烷暴露一定時間可以誘導發育期大腦海馬區神經元細胞的凋亡。
細胞周期是指能持續分裂的真核細胞從一次有絲分裂結束后再到下一次分裂結束的循環過程,包括分裂間期和分裂期2個階段。細胞周期的狀態直接反映了細胞所處的狀態,細胞周期的調控與DNA的損傷與修復關系十分密切,細胞周期蛋白主要包括周期蛋白(Cyclins)、周期蛋白依賴激酶(CDKs)、周期蛋白依賴激酶抑制劑(CKIs)。Cyclins與CDKs結合形成復合物,作用于特異的底物從而對細胞周期進行精密的調節與控制。目前已知的Cyclin家族有8個成員,即CyclinA~CyclinH。在正常情況下,細胞周期蛋白(如Cyclins、CDKs 以及CKIs)均有各自出現的時間點并且嚴格按照細胞周期的進程程序性表達。CyclinB表達于G2初期,在G2/M限制點達高峰,在M期末被泛素化分解去除[11]。CyclinB1是第1個被發現的細胞周期蛋白,是CyclinB家族中的成員之一,屬于高度保守的蛋白家族。在神經細胞中,活性CyclinB1/CDK1復合物是啟動有絲分裂的關鍵, 它們積累于分裂間期, 活化于分裂前期[12]。有研究證實神經元內的細胞周期蛋白的激活增多,不能引導細胞進行正常的有絲分裂,而是導致細胞周期的異常, 進而引起神經元凋亡[13]。目前已有大量研究表明,在阿爾茲海默病、腦缺血、癲癇等病理情況下,神經元的細胞周期能夠重新被激活,但是其結局不是分裂增殖而是凋亡[14]。大部分的神經元因為某種因素的作用下,從靜止強迫進入細胞周期的最終結局是凋亡。胚胎時期海馬區有絲分裂后神經元中CDKIs的表達,可能表明了神經元正處于細胞周期停滯或是細胞分裂被阻止的狀態[15],不同于正常的增殖細胞的程序性表達,神經元細胞中細胞周期蛋白表達或激活不是規律和必要的,它們的表達和激活的過程是紊亂的。如神經元細胞和星形膠質細胞(AST),在應對損傷性刺激時,細胞周期蛋白的激活引起神經元的細胞周期紊亂可以啟動自身凋亡程序,但是對于星形膠質細胞來說,細胞周期蛋白的激活卻介導了其細胞分裂增殖。以上說明細胞周期正常情況下能引起有絲分裂細胞增殖,但在神經元的細胞中則會出現截然相反的結局。目前關于其具體機制并不清楚。本研究發現,在吸入1.3%異氟烷2 h時CyclinB1的表達量與對照組比較差異無統計學意義,而在吸入1.3%異氟烷4 h、6 h時CyclinB1的表達量均明顯增高,提示異氟烷促進CyclinB1的表達具有時間依賴性。與前面細胞凋亡的檢測結果相呼應,提示在一定程度上發育期小鼠海馬區神經元凋亡與異氟烷引起細胞周期的異常有關。
綜上所述,異氟烷通過激活細胞周期蛋白造成細胞周期的異常運行,從而導致神經元的凋亡,且隨著作用時間的延長凋亡越明顯。但是由于神經元凋亡的復雜性,細胞周期異常引起凋亡具體機制并未十分明確。從預防的角度來看,及時干預細胞周期蛋白的表達可能會降低神經元凋亡的風險,這也為后續防治異氟烷等吸入麻醉藥引起發育期大腦神經元凋亡的研究提供了新思路。
[1] Jevtovic-Todorovic V,Hartman RE,Izumi Y,et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits[J]. J Neurosci,2003,23(3):876-882
[2] Brambrink AM,Evers AS,Avidan MS,et al. Isoflurane-induced neuroapoptosis in the neonatal rhesus macaque brain[J]. Anesthesiology,2010,112(4):834-841
[3] Creeley CE,Dikranian KT,Dissen GA,et al. Isoflurane-induced apoptosis of neurons and oligodendrocytes in the fetal rhesus macaque brain[J]. Anesthesiology,2014,120(3):626-638
[4] Sanchez V,Feinstein SD,Lunardi N,et al. General anesthesia causes long-term impairment of mitochondrial morphogenesis and synaptic transmission in developing rat brain[J]. Anesthesiology,2011,115(5):992-1002
[5] Liang G,Ward C,Peng J,et al. Isoflurane causes greater neurodegeneration than an equivalent exposure of sevoflurane in the developing brain of neonatal mice[J]. Anesthesiology,2010,112(6):1325-1334
[6] 徐琳,唐淑新,趙為祿,等. 孕早期異氟醚麻醉對子代大鼠認知功能的影響[J]. 中華麻醉學雜志,2012,32(1):45-47
[7] 夏淑軒,李玉娟,張靜,等. 異氟醚和七氟醚對新生大鼠海馬細胞增殖及細胞外信號調節激酶1/2表達的影響[J]. 中華行為醫學與腦科學雜志,2013,22(4):299-302
[8] D’Amelio M,Cavallucci V,Cecconi F. Neuronal caspase-3 signaling: not only cell death[J]. Cell Death Differ,2010,17(7):1104-1114
[9] 李穎,白波,黃宏興,等. 補腎健脾方干預去勢大鼠骨骼肌ca-spase-3和caspase-8的表達[J]. 中國組織工程研究與臨床康復,2011,15(46):8702-8705
[10] Schmued LC,Albertson C,Slikker WJ. Fluoro-Jade:a novel fluorochrome for the sensitive and reliable histochemical localization of neuronal degeneration[J]. Brain Res,1997,751(1):37-46
[11] Hulleman E,Boonstra J. Regulation of G1 phase progression by growth factors and the extracellular matrix[J]. Cell Mol Life Sci,2001,58(1):80-93
[12] Jackman M,Lindon C,Nigg EA,et al. Active cyclin B1-Cdk1 first appears on centrosomes in prophase[J]. Nat Cell Biol,2003,5(2):143-148
[13] Di Giovanni S,Movsesyan V,Ahmed F,et al. Cell cycle inhibition provides neuroprotection and reduces glial proliferation and scar formation after traumatic brain injury[J]. Proc Natl Acad Sci USA,2005,102(23):8333-8338
[14] Lee SS,Kim YM,Junn E,et al. Cell cycle aberrations by alpha-synuclein over-expression and cyclin B immunoreactivity in Lewy bodies[J]. Neurobiol Aging,2003,24(5):687-696
[15] Schmetsdorf S,Gartner U,Arendt T. Expression of cell cycle-related proteins in developing and adult mouse hippocampus[J]. Int J Dev Neurosci,2005,23(1):101-112
Effects of Isoflurane on neurotoxicity and cell cycle in developing brain
DING Fang, LUO Tao, WANG Mingling, ZHENG Limin
(Shenzhen Hospital of Peking University, Beijing 518036, China)
Objective It is to investigate the effects and mechanisms of isoflurane on neurotoxicity and cell cycle in developing brain. Methods 34 seven-day-old C57BL/6J mice were randomly divided into C, A1, A2, A3 four groups:The control group (group C) inhaled air independent, Exposure to 1.3% (volume fraction) of isoflurane 2 h (group A1);Exposure to 1.3% (volume fraction) of isoflurane 4 h (groupA2); Exposure to 1.3% (volume fraction) of isoflurane 6 h (groupA3). After the end of anesthesia for 6 hours,five mice taken respectively from the control group and experimental group. The brain tissue after cardiac perfusion with 4% paraformaldehyde were gotten to detect the hippocampus of mouse cysteine aspartic proteinase 3 (Caspase-3) expression by immunohistochemistry. Detecting the degeneration of neurons in hippocampus by using the method of Fluoro-Jade B staining. 6 mice from each groups respectively were selected and killed to get rapid extraction of hippocampal protein. Using Western blot immunoblotting method to detect the cell cycle protein B1 (CyclinB1) expression in the hippocampus of mice. Results Compared with the control group, the number of Caspase-3 positive cells and the number of degenerated neurons of the hippocampus in hippocampus of group A3 mice increased obviously (P<0.05); Compared with the control group, the expression of Cyclin B1 in group A2 and group A3 increased obviously (P<0.05), while in group A1 there was no significant difference(P>0.05). Conclusion The study found that exposure to 1.3% isoflurane for a period can increase the expression of Cyclin B1 in hippocampal neurons, then caused the changes of neuronal cell cycle and lead to apoptosis.
Isoflurane; development; neurotoxicity; CyclinB1; cell cycle
丁芳,女,碩士,研究方向為麻醉學。
羅濤,E-mail:luotao_wh@163.com
國家自然科學基金項目(81271205);深圳市衛計委臨床技術研究及轉化項目(201501025)
10.3969/j.issn.1008-8849.2016.31.003
R683.2
A
1008-8849(2016)31-3427-04
2016-04-10

