高脂狀態下Exendin-4對胰島βTc6細胞內胰-十二指腸同源盒-1表達、細胞增殖功能及胰島素分泌能力的干預作用
黃林晶 侯毅翰 楊立勇 嚴孫杰 沈喜妹
(福建醫科大學附屬第一醫院內分泌科 福建醫科大學代謝病研究所,福建 福州 350005)
?
高脂狀態下Exendin-4對胰島βTc6細胞內胰-十二指腸同源盒-1表達、細胞增殖功能及胰島素分泌能力的干預作用
黃林晶 侯毅翰 楊立勇 嚴孫杰 沈喜妹
(福建醫科大學附屬第一醫院內分泌科 福建醫科大學代謝病研究所,福建 福州 350005)
目的 探討Exendin-4在高脂狀態下是否具有抗脂毒性及其相關機制是否涉及胰-十二指腸同源盒(PDX)-1。方法 不同濃度的Exendin-4培育βTc6細胞不同時間,再應用1 mmol/L游離脂肪酸(FFA)干預24 h,檢測細胞內PDX-1表達及增殖能力和胰島素分泌功能。結果 ①Exendin-4干預6 h,各組細胞PDX-1表達、細胞增殖能力和胰島素分泌功能均未見明顯改善;②當Exendin-4干預延長至12~24 h,隨著干預濃度增高,細胞內PDX-1逐漸升高,細胞增殖能力和胰島素分泌功能明顯好轉。結論 高脂狀態下適宜濃度的Exendin-4干預一定時限可上調β細胞內PDX-1的表達,并改善細胞增殖功能及胰島素分泌能力。
Exendin-4;胰-十二指腸同源盒-1;胰島素;游離脂肪酸;βTc6細胞
肥胖,尤其是中心型肥胖與2型糖尿病(T2DM)密切相關。大量證據表明血游離脂肪酸(FFA)是T2DM發病重要的危險因素〔1〕。Exendin-4是長效的胰升血糖素樣肽(GLP)-1受體激動劑,而胰-十二指腸同源盒(PDX)-1是胰腺發生與發育相關的關鍵轉錄因子之一,其在調節胰腺的發育、分化及胰島素分泌中起著至關的重要作用〔2〕。本研究對高脂狀態下的βTc6細胞進行不同濃度和不同時限的Exendin-4干預,并觀察細胞內PDX-1、增殖能力和的胰島素分泌表達情況,旨在探討Exendin-4在高脂狀態下是否能保護胰島β細胞及其抗脂毒性作用的相關機制。
1 資料與方法
1.1 一般資料 βTc6細胞購自美國,通過DMEM培養基培養,接種于6孔板中培養,實驗分組為空白對照組(NC組)、1.0 mmol/L FFA干預組(1 mmol/L組)、5 nmol/L Exendin-4 +FFA干預組(5 nmol/L組)、10 nmol/L Exendin-4+FFA干預組(10 nmol/L組)、50 nmol/L Exendin-4+FFA干預組(50 nmol/L組)。各組分別加入含有不同濃度的Exendin-4或不含Exendin-4的DMEM培養基培育不同時間(6、12、24 h),再加入1.0 mmol/L FFA繼續培養24 h。
1.2 MTT細胞活力分析 收集數生長期的βTc6細胞,計數按5×103/孔接種于96孔板中,培養使其貼壁。加入FFA、Exendin-4等各種實驗因素作用后,每孔加入5 g/L四甲基偶氮唑鹽(MTT)溶液孵育4 h,吸走培養液,每孔加150 μl的二甲基亞砜(DMSO),置于搖床上低速振蕩約10 min,振搖10 min,使結晶溶解后用酶標儀于490 nm波長處測量吸光值(OD值)。細胞增殖抑制率=(對照組OD值-干預組OD值)/對照組OD值。
1.3 放射免疫法檢測胰島素 將βTc6細胞制成4×105/ml 單細胞懸液,接種于6孔板,加入FFA、Exendin-4等各種實驗因素作用后,通過用磷酸鹽緩沖液(PBS)洗滌后加入含25 mmol/L葡萄糖的DMEM培養基培育60 min,收集上清液,按照胰島素放射免疫分析試劑盒說明書測定其濃度。
1.4 RT-PCR檢測PDX-1 mRNA表達 按照Trizol試劑盒說明進行細胞mRNA總提取,在TaqDNA聚合酶催化下行聚合酶鏈反應。PDX-1擴增片段長度317 bp:上游:5'CAAGATTGTGCGGTGACCT3',下游:5'CGGCTATACCCAACTGGCT3';β-肌動蛋白(β-actin)擴增片段長度462 bp;按照2-△△Ct計算各組PDX-1相對表達量。實驗重復3次,取平均值。
1.5 統計學方法 應用SPSS17.0統計軟件進行單因素方差分析。
2 結 果
2.1 高脂狀態下Exendin-4干預對βTc6細胞PDX-1 mRNA表達的影響 不同濃度的Exendin-4作用βTc6細胞6 h后,再予FFA 1 mmol/L干預24 h,細胞內PDX-1 mRNA表達與1 mmol/L組差異無統計學意義(P>0.05),各濃度組表達量均明顯低于NC組(P<0.05)。當Exendin-4作用時間延長至12 h,5 nmol/L組PDX-1 mRNA表達量與1 mmol/L組差異無統計學意義(P>0.05);干預濃度為10 nmol/L時PDX-1 mRNA表達較5 nmol/L組增加(P<0.05);當濃度進一步升到50 nmol/L時,PDX-1 mRNA表達量繼續上升(P<0.05),但與NC組相比仍較低(P<0.05)。干預24 h,5 nmol/L組PDX-1 mRNA表達與1 mmol/L組差異無統計學意義(P>0.05);10 nmol/L組PDX-1 mRNA的表達量較5 nmol/L組升高(P<0.05),但50 nmol/L組PDX-1 mRNA的表達未較10 nmol/L組進一步升高(P>0.05),這兩組表達量均低于NC組(P<0.05)。見圖1。
2.2 高脂狀態下Exendin-4干預對βTc6細胞增殖活性的影響 當Exendin-4干預時間設定為6或12 h,5 nmol/L組βTc6細胞的增殖能力明顯下降,與1 mmol/L組差異無統計學意義(P>0.05);10 nmol/L組細胞增殖活性較前改善,與1 mmol/L組相比OD值明顯改善(P<0.05);50 nmol/L組OD值未較10 nmol/L組進一步升高。當Exendin-4干預時間增加到24 h,5 nmol/L組βTc6細胞的增殖活性較1 mmol/L組有所恢復(P<0.05);10 nmol/L組和50 nmol/L組βTc6細胞的增殖活性明顯改善,兩組OD值均較5 nmol/L組進一步升高(P<0.05)。在脂毒性狀態下,當Exendin-4干預濃度固定時,在6、12 h干預組中βTc6細胞的增殖活性差異無統計學意義(P>0.05),但在24 h干預組其細胞增殖活性明顯較前兩組改善(P<0.05),見表1。
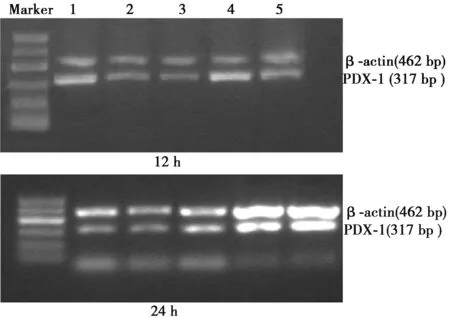
1~5分別為:NC,1 mmol/L,5 nmol/L,10 nmol/L,50 nmol/L組圖1 Exendin-4干預12、24 h βTc6細胞PDX-1 mRNA的表達
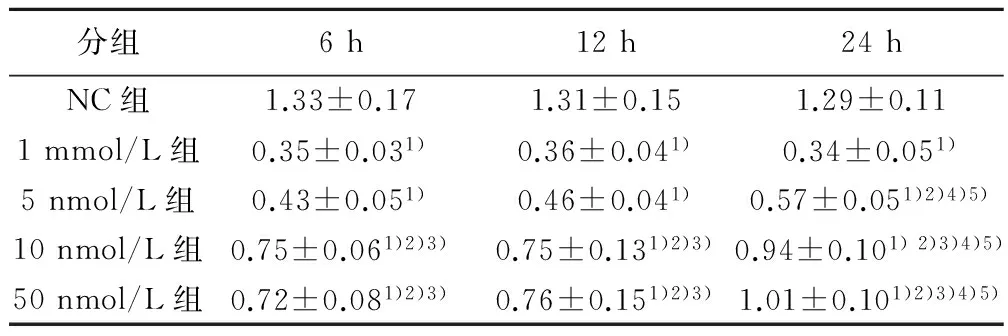
分組6h12h24hNC組1.33±0.171.31±0.151.29±0.111mmol/L組0.35±0.031)0.36±0.041)0.34±0.051)5nmol/L組0.43±0.051)0.46±0.041)0.57±0.051)2)4)5)10nmol/L組0.75±0.061)2)3)0.75±0.131)2)3)0.94±0.101)2)3)4)5)50nmol/L組0.72±0.081)2)3)0.76±0.151)2)3)1.01±0.101)2)3)4)5)
與NC組相比:1)P<0.05;與1 mmol/L組相比:2)P<0.05;與5 nmol/L組相比:3)P<0.05;與6 h組相比:4)P<0.05;與12 h組相比:5)P<0.05;下表同
2.3 高脂狀態下Exendin-4干預對βTc6細胞胰島素分泌功能的影響 當Exendin-4干預時間設定為6或12 h,5 nmol/L干預組βTc6細胞的胰島素分泌(GSIS)與1 mmol/L組無明顯差異(P>0.05);10 nmol/L組的GSIS有所恢復,其雖然低于對照組(P<0.05),但較1 mmol/L組明顯改善(P<0.05);50 nmol/L組的GSIS未較10 nmol/L組進一步升高(P>0.05)。當干預時間設定為24 h,5 nmol/L組的GSIS高于1 mmol/L組(P<0.05),而10、50 nmol/L組的GSIS較5 nmol/L組明顯改善(P<0.05)。當Exendin-4干預濃度穩定時,隨著干預時限的延長,細胞內GSIS逐漸改善。另經析因設計的方差分析表明,在高脂狀態下,隨著Exendin-4干預時限的延長及干預濃度的增加,βTc6細胞內GSIS得到更加明顯改善,見表2。
表2 高脂狀態下Exendin-4干預βTc6細胞的GSIS功能改變
3 討 論
長期高FFA血癥可導致胰島β細胞脂質過載,誘導細胞凋亡和壞死,從而使胰島β細胞數目減少;也可使胰島β細胞分泌功能損傷,胰島素分泌減少〔3〕。既往研究表明,1 mmol/L FFA干預24 h對胰島βTc6細胞的功能產生明顯的抑制作用,細胞呈現出明顯的凋亡趨勢,細胞增殖能力和胰島功能均受到明顯抑制,細胞內轉錄因子PDX-1表達明顯減少〔4,5〕。
本研究發現,高脂狀態下βTc6細胞PDX-1 mRNA的表達、細胞增殖能力及胰島分泌功能與Exendin-4存在明顯的濃度及時間依賴性。不同濃度Exendin-4干預6 h不能有效拮抗高濃度FFA對細胞的脂毒性作用,且PDX-1基因表達未見好轉,但10、50 nmol/L Exendin-4干預組內的細胞增殖能力和胰島素分泌功能已較1 mmol/L高FFA組有一定程度提高,表明細胞增殖能力和胰島分泌功能有所改善。這種PDX-1細胞轉錄因子的基因表達并未改善但β細胞相關功能卻出現適當的恢復,考慮與Exendin-4干預時間較短不能激活PDX-1及其相關調控基因表達有關,但可能通過調控其他信號轉導途徑使β細胞的功能微弱改善〔6〕。但當干預時間延長至12~24 h,βTc6細胞PDX-1 基因表達明顯改善,其增殖能力和胰島素分泌功能也得到明顯修復。本研究也顯示低濃度Exendin-4干預12 h雖然PDX-1基因表達改善,但細胞增殖活性和分泌功能并未出現好轉,考慮PDX-1作為胰島β細胞內重要的轉錄調控因子,其發揮生物學效應須轉位至細胞核內,雖然PDX-1表達改善,但胰島β細胞內仍有大量脂質堆積,神經酰胺合成增加,致使另一個轉錄因子探討叉頭狀轉錄因子(Fox)01與其競爭轉位,從而使PDX-1轉位至細胞核內受限無法完全發揮其生物學效應有關〔7〕。本研究也發現了50 nmol/L Exendin-4干預24 h PDX-1表達和胰島細胞相關功能并未比10 nmol/L組得到改善,考慮可能與β細胞膜表面的GLP-1受體飽和性有關〔8〕。
Exendin-4在β細胞中發揮生物學效應與PDX-1密切相關。研究顯示,Exendin-4要發揮其生物學效應必須與細胞膜上GLP-1受體相結合,而PDX-1是其發揮生物學作用所必需的重要轉錄因子〔9〕。Wang等〔10〕認為Exendin-4與GLP-1受體結合后通過cAMP/PKA這條信號轉導通路上調β細胞內PDX-1的表達與核定位,從而發揮其生物學功能,并且腺苷酸環化酶激活劑Forskolin及8-溴-cAMP可以模擬GLP-1對PDX-1的正性作用〔11〕。
1 Slagter SN,van Vliet-Ostaptchouk JV,van Beek AP,etal.Health-related quality of life in relation to obesity grade,type 2 diabetes,metabolic syndrome and inflammation〔J〕.PLoS One,2015;10(10):e0140599.
2 Hwang SL,Kwon O,Kim SG,etal.B-cell translocation gene 2 positively regulates GLP-1-stimulated insulin secretion via induction of PDX-1 in pancreatic β-cells〔J〕.Exp Mol Med,2013;45:e25.
3 Giacca A,Xiao C,Oprescu AI,etal.Lipid-induced pancreatic beta cell dysfunction:focus on in vivo studies〔J〕.Am J Physiol Endocrinol Metab,2011;300:E255-62.
4 楊立勇,侯毅翰,沈喜妹,等.游離脂肪酸對βTc6細胞PDX-1表達及胰島素分泌能力的影響〔J〕.國際內分泌代謝雜志,2009;29(6):381-4.
5 黃林晶,楊立勇,嚴孫杰,等.Exendin-4對游離脂肪酸介導的βTc6細胞GK和GLUT2表達改變的干預作用〔J〕.中國糖尿病雜志,2013;21(9):832-5.
6 Tews D,Lehr S,Hartwig S,etal.Anti-apoptotic action of exendin-4 in INS-1 beta cells:comparative protein pattern analysis of isolated mitochondria〔J〕.Horm Metab Res,2009;41(4):294-301.
7 Poitout V,Hagman D,Stein R,etal.Regulation of the insulin gene by glucose and fatty acids〔J〕.J Nutr,2006;136(4):873-6.
8 Kim MJ,Kang JH,Park YG,etal.Exendin-4 induction of cyclin D1 expression in INS-1 β-cells:involvement of cAMP-responsive element〔J〕.J Endocrinol,2006;188:623-33.
9 Li Y,Cao X,Li LX,etal.β-Cell Pdx1 expression is essential for the glucoregulatory,proliferative,and cytoprotective actions of glucagon-like peptide-1〔J〕.Diabetes,2005;54(2):482-91.
10 Wang X,Zhou J,Doyle ME,etal.Glucagon-like peptide-1 causes pancreatic duodenal homeobox-1 protein translocation from the cytoplasm to the nucleus of pancreatic beta-cells by a cyclic adenosine monophosphate/protein kinase A-dependent mechanism〔J〕.Endocrinology,2001;142(5):1820-7.
11 Kwon G,Pappan KL,Marshall CA,etal.cAMP dose-dependently prevents palmitate-induced apoptosis by both protein kinase A-and cAMP-Guanine nucleotide exchange factor-dependent pathways in β-cells〔J〕.J Biol Chem,2004;279(10):8938-45.
〔2015-02-19修回〕
(編輯 苑云杰)
國家自然科學基金(81500632);福建省青年科研基金(2015-1-48)
楊立勇(1957-),男,博士生導師,教授,主任醫師,主要從事糖尿病研究。
黃林晶(1982-),男,碩士,主治醫師,主要從事糖尿病研究。
R341.6;R977.6
A
1005-9202(2016)20-4945-03;
10.3969/j.issn.1005-9202.2016.20.003

