脂肪因子Chemerin體外表達與妊娠期糖尿病胰島素抵抗研究
潘寶龍,馬潤玫
(昆明醫科大學研究生部 650031)
?
脂肪因子Chemerin體外表達與妊娠期糖尿病胰島素抵抗研究
潘寶龍,馬潤玫△
(昆明醫科大學研究生部 650031)
[摘 要] 目的 探討脂肪因子Chemerin與妊娠期糖尿病(GDM)胰島素抵抗(IR)的內在聯系。方法 復蘇、傳代及誘導分化GDM前脂肪細胞,構建 Chemerin過表達載體,進行載體轉化、培養和提取;以3個過表達梯度(1.0 μg、2.5 μg、5.0 μg)轉染傳代脂肪細胞,以無轉染組為對照;Q-PCR檢測Chemerin 、胰島素受體底物-1(IRS-1)、IRS-2磷脂酰肌醇-3激酶[PI3K(P85a)] mRNA表達,Western blot檢測Chemerin、IRS-1、IRS-2、PI3K蛋白表達及IRS-1、IRS-2酪氨酸磷酸化水平,[3H]-2-脫氧-D-葡萄糖攝取測定法檢測不同濃度轉染組細胞葡萄糖攝取率的變化。結果 (1)Chemerin mRNA及蛋白表達隨轉染濃度梯度升高而表達量增加,所構建Chemerin過表達載體有效;(2)隨Chemerin表達增加,IRS-1/2、PI3K mRNA及蛋白表達未出現明顯變化,但存在IRS-1磷酸化程度稍有增加,IRS-2磷酸化程度變化不明顯;(3)脂肪細胞葡萄糖攝取率與Chemerin過表達濃度變化無明顯關系。結論 Chemerin在GDM血清及網膜脂肪組織中的高表達與GDM胰島素抵抗的發生無必然聯系。
妊娠;Chemerin;胰島素抗藥性;動力傳導,細胞
妊娠期糖尿病(gestational diabetes mellitus,GDM)是在妊娠期首次發生或發現的糖尿病,嚴重威脅孕婦及其子代健康。至今為止GDM的病因尚不清楚,眾多研究一致認為GDM是多種因素引起的一種代謝性疾病[1-2]。胰島素抵抗(insulin resistance,IR)及由其帶來的糖脂代謝紊亂是目前公認的GDM發病的病理生理基礎之一,被認為是GDM的始發因素,而胰島素信號通路的異常是發生IR的主要原因[3-4]。近年來,來源于脂肪組織的脂肪因子(adipokines)與GDM的關系備受關注,已成為新的研究熱點[5]。課題組前期研究中,發現脂肪因子Chemerin在GDM患者血清及體內網膜脂肪組織中明顯高表達[6],為進一步探討這種高表達的現象與GDM IR之間是否存在必然的因果關系,課題組在前期研究基礎上,以體外培養GDM脂肪細胞為載體,檢測Chemerin不同程度過表達狀態下,脂肪細胞中胰島素受體下游信號分子胰島素受體底物-1(insulin receptor substrate,IRS-1)、IRS-2、磷脂酰肌醇-3激酶(phosphatidy inositol-3 kinase,PI3K)mRNA及蛋白表達,IRS-1、IRS-2酪氨酸磷酸化水平的變化,以及細胞葡萄糖攝取率的變化,從胰島素經典信號傳導通路(IRS-1、IRS-2、PI3K)探討Chemerin與GDM IR的內在聯系,為研究GDM發病機理和治療策略提供線索。
1 材料與方法
1.1 材料 高糖杜爾液體培養基(HG-DMEM)及6孔細胞培養板(美國Hyclone公司)),蛋白酶抑制劑(美國MerckmI Lipore公司),蛋白上樣緩沖液(上海Beyotime公司)),聚偏二氟乙烯(PVDF,0.45 μm,德國Millipore公司))膜,人源Chemerin過表達載體(廣州復能基因公司)。Thermo CO2培養箱,AIRTECH超凈工作臺,上海菁華紫外分光光度計(752),美國ABI RT-PCR儀,ABI 96孔定量PCR板,Bio-RAD電泳儀(164-5050)。
1.2 人前脂肪細胞的復蘇及傳代培養 將之前凍存細胞進行復蘇和傳代,具體操作方法見課題組報道文獻[6]。GDM大網膜前脂肪細胞的獲取,符合人體試驗倫理學標準,經昆明醫科大學倫理委員會批準,獲得患者的知情同意。
1.3 人源Chemerin過表達載體構建 由廣州復能基因公司協助構建,制作感受態細胞,Chemerin質粒轉染大腸桿菌,篩選陽性克隆及擴大培養,抽提無內毒素級別質粒,最終得到Chemerin質粒濃度為:0.573 μg/μL。
1.4 Chemerin過表達載體轉染體外培養的脂肪細胞 將Chemerin過表達載體分別按照0、1.0、2.5、5.0 μg 4個濃度梯度轉染GDM人源第3代傳代脂肪細胞(分組為0 μg組、1.0 μg組、2.5 μg組、5.0 μg組),每個濃度轉染6孔,文中所有檢測均為6孔同時檢測,以均值表示結果。
1.5 Q-PCR 檢測細胞中Chemerin、IRS-1、IRS-2、PI3K mRNA 表達 轉染48 h 后,提取細胞總蛋白和總RNA,Q-PCR檢測Chemerin,IRS-1,IRS-2,PI3K的mRNA表達。各引物信息為:Chemerin上游5′-CTG ATT GTA AGC CAT GAA G-3′,下游5′-AGA ATT GGC CAG TGG ACT A-3′;GAPDH上游5′-CGA CAG TCA GCC GCA TCT-3′,下游5′-ATG AGT CCT CCA CGA TAC CAA-3′;PI3K上游5′-GGC TGC TAG CCT GCT CTG-3′,下游5′-CTT CCT IAA GTC ACG CAC GAT-3′;IRS-2上游5′-AAA ACG ACC ACA GTC CTA CCT C-3′,下游5′-CAC CTC CCA CAC CCA ATA CA-3′;IRS-1上游5′-AAT GTC TGT TGT AAA GAG TGG AGC-3′,下游5′-GAA CTC AGC TCA ACA TCA GGT AT-3′。結果判讀:2(-△△ct)計算各樣本相對拷貝值。
1.6 Western blot檢測細胞中蛋白表達 用BCA蛋白定量試劑盒測定樣品中蛋白含量,進行電泳、轉膜、孵育抗體及顯影。檢測細胞中Chemerin,IRS-1,IRS-2,PI3K的蛋白表達。文中所有Western blot檢測圖中上為待測條帶,下為β-actin。Western blot檢測不同濃度Chemerin過表達組中IRS-1、IRS-2酪氨酸磷酸化水平。
1.7 [3H]-2-脫氧-D-葡萄糖攝取測定法檢測Chemerin不同濃度質粒轉染細胞后葡萄糖的攝取率 [3H]-2-脫氧-D-葡萄糖攝取率=計數分鐘衰變數×2/蛋白濃度
2 結 果
2.1 不同濃度Chemerin過表達組細胞中Chemerin mRNA及蛋白表達 Chemerin mRNA及蛋白表達均隨過表達濃度升高而升高,所構建Chemerin過表達載體有效,見圖1~2。

圖1 不同組別Chemerin mRNA表達分析圖
2.2 不同濃度Chemerin過表達組IRS-1、IRS-2、PI3K mRNA表達情況 隨Chemerin表達增加,IRS-1、IRS-2及PI3K mRNA均未見明顯變化,見表1及圖3~5。
2.3 不同濃度Chemerin過表達組IRS-1、IRS-2、PI3K蛋白表達 隨Chemerin表達增加,IRS-1、IRS-2、PI3K蛋白表達無明顯變化,見表2及圖6。

圖2 不同組別Chemerin蛋白表達分析圖

項目0μg組1.0μg組2.5μg組5.0μg組IRS?11.000.93±0.070.98±0.040.96±0.08IRS?21.000.90±0.040.97±0.030.97±0.04PI3K1.000.93±0.090.85±0.050.94±0.11

圖3 不同組別IRS-1 mRNA表達分析圖

圖4 不同組別IRS-2 mRNA表達分析圖

圖5 不同組雖PI3K mRNA表達分析圖
2.4 不同濃度Chemerin過表達組IRS-1、IRS-2酪氨酸磷酸化水平 隨Chemerin表達增加,IRS-1酪氨酸磷酸化程度有所增加,5.0 μg組IRS-1 磷酸化程度達0 μg組的120%;IRS-2磷酸化程度變化不明顯。見表3、圖7。
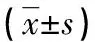
表2 不同濃度Chemerin過表達組IRS-1、IRS-2、PI3K蛋白表達

圖6 不同濃度Chemerin過表達組IRS-1、IRS-2及PI3K蛋白表達圖

項目0μg組1.0μg組2.5μg組5.0μg組IRS?11.28±0.161.31±0.171.40±0.211.55±0.24IRS?20.62±0.090.56±0.070.51±0.080.57±0.06

圖7 不同濃度Chemerin過表達組IRS-1/2磷酸化水平
2.5 [3H]-2-脫氧-D-葡萄糖攝取測定檢測不同濃度Chemerin過表達組脂肪細胞的葡萄糖攝取率 隨Chemerin表達增加,脂肪細胞葡萄糖攝取率變化不明顯,各組與0 μg組比值分別為:1.0 μg組0.97,2.5 μg組0.97,5.0 μg組1.01,見圖8。

圖8 不同濃度Chenerin過表達組細胞葡萄糖攝取率分析圖
3 討 論
GDM被認為是早期的2型糖尿病(T2DM),其短期影響往往是孕婦羊水過多、新生兒低血糖、巨大兒、產后大出血、難產等的危險性增加,其長期影響則表現為GDM孕婦首診之后10~15年內患T2DM的概率高達50%~60%,尤其集中于產后前5年,是中老年女性T2DM患者的主要來源,其子代極易出現生長速度過快、青春期肥胖、糖耐量受損或糖尿病等,嚴重威脅孕婦及其子代健康[7]。近年來,全球GDM發病率持續升高,包括我國在內的發展中國家形勢更為嚴峻,我國已經成為世界第一糖尿病大國,患病人數已達1.5億,GDM發病率已上升至妊娠婦女的17.5%[8]。且隨著我國“全面二孩”政策的放開,高齡孕婦的增加,預計GDM的發病率將進一步上升,GDM對母體和子代帶來的短期和長期影響及不斷上升的GDM患病率,將會成為困擾中國女性健康及優生優育的嚴重問題之一。探索GDM發病機制,從病因學上尋找GDM防治的關鍵靶點,為GDM治療策略提供依據,具有極其重要的價值和意義。
課題組前期研究中發現Chemerin在GDM患者血清及體內網膜脂肪組織中都出現了明顯的高表達,血清Chemerin水平與GDM患者血脂類指標(TC:r=0.402,P<0.05;TG:r=0.400,P<0.05)及炎癥指標(hs-CRP:r=0.325,P<0.05)呈正相關,說明GDM與Chemerin之間存在一定的聯系。血清Chemerin水平可以反映和提示患者的高脂血癥(脂肪蓄積、肥胖)和慢性炎癥狀態,血清Chemerin值越高,這表明高脂血癥和慢性炎癥程度就越重。提示臨床可將Chemerin血清學水平檢測作為一種常規檢測,來判斷患者糖脂代謝紊亂程度及慢性炎癥程度,而這二者均為GDM發生的高危因素,及早預防和治療將大大降低孕婦的GDM患病風險。
前期局限于血清和人體內組織學的研究,只是揭示了Chemerin與GDM之間存在的這種表象,同時,帶來了新的問題,即Chemerin與GDM的IR是否存在因果關系,如果存在,那么是Chemerin的升高導致了GDM IR的發生,還是GDM IR的發生導致了Chemerin的升高?為進一步研究其內在聯系,課題組采用了體外表達實驗研究。因涉及醫學倫理學問題,目前對于基因表達與疾病的關系研究多以體外實驗方式進行,常見的是細胞培養和動物模型。學術界針對脂肪展開的生物學研究,多數實驗樣本均采用嚙齒類動物脂肪細胞[9-10]。尤其對于人脂肪細胞的研究,更多是采用了小鼠3T3-L1前脂肪細胞。不可忽視的一個影響因素是,嚙齒類動物與人類存在明顯的遺傳學差異,且兩者之間的代謝途徑也迥然不同,因而,將其作為實驗樣本往往難以避免潛在的實驗缺陷問題,從而影響數據和結論的科學性。相對而言,作為一種特異化的前體細胞,人體中的前脂肪細胞具有增殖和向脂肪細胞定向分化的能力,在人的一生中均存在并持續作用,且與糖尿病、肥胖、動脈硬化等代謝類疾病的關系較為密切[11]。本課題在前期工作中,成功建立了GDM網膜脂肪細胞原代培養及增殖分化模型,以人源細胞作為研究載體,進行后續有關GDM方面的研究,更具科學性。并且,以取自GDM網膜組織而培養傳代的前脂肪細胞,可能更多地保留了GDM其他的一些基因信息,更真實地模擬地GDM基因環境,使結果更具有說服力。這也是本課題得以順利進行的基礎條件和特點之一。
本研究中,課題組采用了大腸桿菌表達系統,將所構建Chemerin過表達載體轉化大腸桿菌,篩選陽性克隆及擴大培養后,抽提無內毒素級別質粒,對得到的過表達載體直接以Q-PCR 驗證相應mRNA表達,分別以低(1.0 μg),中(2.5 μg)、高(5.0 μg)3個過表達載體濃度梯度轉染GDM脂肪細胞,發現mRNA水平隨著過表達載體濃度增加而增加,充分說明:(1)所構建GDM網膜脂肪細胞原代培養及增殖分化模型真實有效,具有正常生理功能和表達能力;(2)所構建Chemerin過表達載體有效,隨梯度增加而表達增加。
目前眾多研究理論認為,IR主要由受體后信號傳導的異常引起。胰島素受體的信號傳導主要經過兩個途徑,即PI3K途徑和Ras-絲分裂原激活的蛋白激酶(Ras-MAPK)途徑。PI3K途徑是胰島素受體信號傳導的經典途徑,也是胰島素對代謝調節的主要途徑,主要作用于葡萄糖攝取,糖原合成和降解的調節;Ras-MAPK途徑主要與基因轉錄的調控有關,主要作用于細胞生長和分化的調節[12]。兩條途徑相互獨立,在一定條件下,也能相互激活。其中,IRS是胰島素信號通路的關鍵物質。目前已發現的IRS家族成員有4個(IRS-1、IRS-2、IRS-3、IRS-4)。IRS-1是胰島素信號傳導的“船塢”蛋白,目前研究認為ISR-1的表達可能與具有T2DM家族史的患者密切相關,ISR-1表達不足或者磷酸化異常可導致IR、而IRS-2在IR、T2DM的發生中起著極其重要的作用,一旦IRS-2的表達出現異常,機體將很快出現糖尿病樣癥狀[13]。
基于上述理論,本次研究選取的是Chemerin與GDM胰島素PI3K信號傳導途徑的關系研究,通過對Chemerin不同過表達濃度梯度在體外培養GDM脂肪細胞中胰島素信號傳導通路IRS-1、IRS-2、PI3K mRNA及蛋白表達檢測,Chemerin不同過表達濃度梯度IRS-1、IRS-2磷酸化水平檢測,發現在所培養的脂肪細胞內:(1)隨Chemerin表達增加,IRS-1 mRNA及蛋白表達未出現明顯變化,但存在IRS-1磷酸化程度有所增加,5 μg組IRS-1 磷酸化程度達0 μg組的120%;(2)隨Chemerin表達增加,IRS-2 mRNA、蛋白表達及酪氨酸磷酸化程度變化不明顯;(3)PI3K mRNA及蛋白表達隨Chemerin過表達濃度增加無明顯變化。結果提示,Chemerin與IRS-1、IRS-2、PI3K并不存在明顯關聯,Chemerin的表達增強,并不會導致胰島素受體下游信號分子IRS-1、IRS-2、PI3K的變化,即Chemerin與GDM IR PI3K經典途徑基本不存在關系,Chemerin的升高不會導致GDM的IR,不存在因果關系。課題組隨后的不同過表達組脂肪細胞葡萄糖攝取率實驗發現,隨著Chemerin過表達載體濃度增加,脂肪細胞的葡萄糖攝取率無明顯變化,說明Chemerin對脂肪細胞不具有胰島素增敏作用,也證實了這一觀點。
有理論認為脂肪的蓄積及脂肪細胞體積的增大可使脂肪細胞Chemerin的合成及分泌增多,Chemerin可促進脂肪細胞的分化成熟及脂代謝,如此反復可引起更高水平Chemerin的表達,肥胖及Chemerin的高表達促進系統性炎癥的發生,加劇肥胖及脂代謝紊亂的發生,高TG則可促進脂肪組織分泌更高水平Chemerin[14]。體外實驗發現,胰島素可促進離體脂肪組織Chemerin的分泌,生理胰島素水平卻對脂肪組織Chemerin的分泌無影響,長期高胰島素血癥可促進機體脂肪組織Chemerin的分泌并使血清Chemerin顯著升高[15]。課題組先前研究發現Chemerin與GDM脂代謝紊亂及慢性炎癥狀態有關,結合本次研究結果,筆者認為Chemerin在GDM血清及網膜脂肪組織中的高表達,很可能僅是一種肥胖、GDM慢性炎癥狀態及IR的補償機制,是GDM機體存在的脂肪蓄積、高脂血癥及慢性炎癥狀態與Chemerin的一種交互影響的結果,臨床上可以此作為一種衡量孕婦脂代謝紊亂程度和是否存在慢性炎癥狀態的“生物學標志”,但與GDM的IR的發生無必然的聯系。
盡管如此,Chemerin與GDM之間是否存在其他途徑的內在聯系?本研究中發現的隨Chemerin表達增加,IRS-1 mRNA及蛋白表達基本未見變化,但IRS-1磷酸化程度有所增加如何解釋?如果Chemerin在GDM血清及網膜脂肪組織中的高表達僅是一種肥胖、GDM慢性炎癥狀態及IR的補償機制,那么這種補償機制更深層次的內在機制是什么?抑制GDM中Chemerin的表達,會不會是GDM治療的一種新的思路?這些問題都有待于學術界的共同努力和進一步深入探討。
[1]Murphy A,Shamshirsaz A,Markovic D,et al.Urinary excretion of myo-Inositol and D-chiro- inositol in early pregnancy is enhanced in gravidas with gestational diabetes Mellitus[J].Reprod Sci,2016,23(3):365-371.
[2]杜明鈺,尹蓉,馬潤玫,等.昆明地區妊娠期糖尿病發生的民族差異[J].重慶醫學,2015,44(27):3824-3826.
[3]Perez-Perez A,Guadix P,Maymo J,et al.Insulin and leptin signaling in placenta from gestational diabetic subjects[J].Horm Metab Res,2016,48(1):62-69.
[4]Ren C,Zhang Y,Cui W,et al.A polysaccharide extract of mulberry leaf ameliorates hepatic glucose metabolism and insulin signaling in rats with type 2 diabetes induced by high fat-diet and streptozotocin[J].Int J Biol Macromol,2015,72(4):951-959.
[5]Ma Q,Fan J,Wang J,et al.High levels of chorionic gonadotrophin attenuate insulin sensitivity and promote inflammation in adipocytes[J].J Mol Endocrinol,2015,54(2):161-170.
[6]李曉紅.脂肪組織Omentin,Vaspin,Chemerin與GDM胰島素抵抗的研究[D].昆明:昆明醫科大學,2014.
[7]Liu H,Zhang S,Wang L,et al.Fasting and 2-hour plasma glucose,and HbA1c in pregnancy and the postpartum risk of diabetes among Chinese women with gestational diabetes[J].Diabetes Res Clin Pract,2016,112(1):30-36.
[8]Wei YM,Yan J,Yang HX,et al.Identification of severe gestational diabetes mellitus after new criteria used in China[J].J Perinatol,2016,36(2):90-94.
[9]聶緒強,楊建文,史海霞,等.IR-3T3-L1脂肪胰島素抵抗細胞的建立[J].南方醫科大學學報,2015,35(1):103-108.
[10]Wang C,Wang L,Li W,et al.Irisin has no effect on lipolysis in 3T3-L1 adipocytes or fatty acid metabolism in HepG2 hepatocytes[J].Endocrine,2015,49(1):90-96.
[11]Kitahara A,Takahashi K,Moriya R,et al.Ghrelin augments the expressions and secretions of proinflammatory adipokines,VEGF120 and MCP-1,in differentiated 3T3-L1 adipocytes[J].J Cell Physiol,2015,230(1):199-209.
[12]Inoue H.Central insulin- mediated regulation of hepatic glucose production[J].Endocr J,2016,63(1):1-7.
[13]Patel TP,Rawal K,Bagchi AK,et al.Insulin resistance:an additional risk factor in the pathogenesis of cardiovascular disease in type 2 diabetes[J].Heart Fail Rev,2016,21(1):11-23.
[14]Van Poppel MN,Zeck W,Ulrich D,et al.Cord blood Chemerin:differential effects of gestational diabetes mellitus and maternal obesity[J].Clin Endocrinol(Oxf),2014,80(3):65-72.
[15]Cabia B,Andrade S,Carreira MC,et al.A role for novel adipose tissue-secreted factors in obesity-related carcinogenesis[J].Obes Rev,2016,17(4):361-376.
Study on the relationship between expression of Chemerin in vitro and GDM insulin resistance*
PanBaolong,MaRunmei△
(GraduateSchool,KunmingMedicalUniversity,Kunming,Yunnan650031,China)
[Abstract] Objective To investigate inner relationship between Chemerin and gestational diabetes mellitus(GDM)insulin resistance.Methods Recoveried,extended and differentiated the GDM preadipocyte cells,built Chemerin overexpression carrier,transformed,cultivated and extracted the plasmid,using 3 overexpression levels(1.0,2.5,5.0 μg)to transfect and extend the fat cells,with no transfection group as contrast;the mRNA expression of Chemerin,insulin receptor substrate-1/2(IRS-1/2),phosphatidy inositol 3 kinase(PI3K)were detected by Q-PCR,protein expression of Chemerin,IRS-1/2,PI3K and IRS-1/2 phosphorylation levels were detected by Western blot,with [3H]-2- deoxidation-D-glucose uptake assay to detect glucose uptake rates in different concentration of plasmid transfection.Results (1)The expression of mRNA Chemerin and protein increased with the increase of the concentration gradient,which was effective to construct the Chemerin vector.(2)With the Chemerin expression increased,the mRNA and protein expression of IRS-1/2 and PI3K had no significant changes,IRS-2 tyrosine phosphorylation level had no obvious change but the IRS-1 phosphorylation was slightly increased.(3)Glucose uptake rate of fat cells haD no obvious correlation with Chemerin.Conclusion High expression of Chemerin in GDM serum and omental adipose tissue has no obvious link with the insulin resistance of GDM.
gestational;Chemerin;insulin resistance;mechanotransduction,cellular
? 著·
10.3969/j.issn.1671-8348.2016.28.001
國家自然科學基金資助項目(81160082)。 作者簡介:潘寶龍(1973-),副主任技師,在讀博士,主要從事臨床圍產醫學研究。△
R714.24
A
1671-8348(2016)28-3889-04
2016-06-19
2016-07-07)

