手性三氟甲基胺類化合物的合成與應用
劉小華,徐國明,翁建新,劉景偉,張天明
(捷馬化工股份有限公司,浙江龍游324400)
手性三氟甲基胺類化合物的合成與應用
劉小華,徐國明,翁建新,劉景偉,張天明
(捷馬化工股份有限公司,浙江龍游324400)
手性三氟甲基胺類化合物是重要的醫藥、農藥中間體。從不同三氟甲基化試劑的角度出發概括了手性三氟甲基胺類化合物的合成,以及指出了其在藥物領域的應用。
手性;三氟甲基胺;不對稱合成;進展
手性三氟甲基胺類化合物在氟化學領域以及有機化學領域越來越受到化學家們的關注。胡金波[1]和Soloshonok[2]分別概括了不對稱合成含氟的胺類化合物的方法,采用N-叔丁基-亞磺酰亞胺為底物,用手性的亞磺酰基團調節的方法。馬軍安[3-4]總結了不對稱構建三氟甲基基團的手性碳原子的方法,以前手性的三氟甲基化合物為底物,如三氟乙醛、3,3,3-三氟丙酮酸酯、4,4,4-三氟乙酰乙酸乙酯、三氟甲基酮、三氟甲基烯烴及其衍生物。程桂林[5]等總結了以三氟甲基亞胺為底物手性三氟甲基胺類化合物的合成。本文從不同三氟甲基化試劑的角度概括了手性三氟甲基胺類化合物的合成。
1 手性三氟甲基胺類化合物的合成
1.1以三氟甲基-三甲基硅烷(TMSCF3)為三氟甲基化試劑
Prakash G K S等[6-7]采用三氟甲基-三甲基硅烷(TMSCF3)為三氟甲基化試劑,對映立體選擇性合成一系列的三氟甲基取代的胺類化合物,提供了一種三氟甲基化試劑親核加成,有效合成手性的三氟甲基胺類化合物及其衍生物的重要途徑。Prakash G K S等[6-7]分別以N-叔丁基-亞磺酰亞胺和α,β-不飽和N-叔丁基-亞磺酰酮亞胺為底物,以四丁基銨二氟三苯基硅酸鹽(TBAT)為可溶解的非金屬的氟引發劑,進行三氟甲基化反應。采用此方法,三氟甲基化試劑TMSCF3與TBAT,或者以四甲基氟化銨(TMAF)為氟源,原位生成三氟甲基陰離子,立體選擇性地加成到亞胺底物,分別合成一系列的手性三氟甲基胺類化合物[6]和烯丙基胺類化合物[6-7]。Prakash G K S等[8]同樣以TMSCF3作為有效的三氟甲基親核試劑,通過非對映立體選擇性親核加成α-氨基N-叔丁基-亞磺酰亞胺,合成手性的三氟甲基取代的鄰二胺化合物。Prakash G K S等[8]選擇了立體位阻較小的TMAF作為氟引發劑,Reetz氨基醛與Ellman(R)-N-叔丁基-亞磺酰胺進行縮合反應,生成中間體α-氨基N-叔丁基-亞磺酰亞胺,然后與三氟甲基化試劑進行親核加成反應,得到光學活性的三氟甲基取代的鄰二胺化合物。三氟甲基化試劑TMSCF3還被應用于對映立體選擇性催化偶氮甲堿亞胺的三氟甲基化反應。Kawai H等[9]提出從反應活性和立體選擇性的角度來看,傳統的亞胺如N-磺酰亞胺都是比較差的底物選擇,其立體選擇性較差主要歸因于N-磺酰亞胺的體積大小和構型易變性,轉化率較低主要原因在于所生成的磺酰胺中間體對三氟甲基化試劑的親核性較差。所以,Kawai H等[9]采用偶氮甲堿亞胺作為一種立體空間需要的亞胺等價物,在手性相轉移催化劑(PTC)存在下,偶氮甲堿亞胺的構型是被限定的。在堿性(KOH)條件下,金雞納生物堿的溴化物作為手性催化劑,催化三氟甲基化試劑TMSCF3對一系列偶氮甲堿亞胺化合物進行親核加成反應,高效地合成手性的三氟甲基胺類化合物,具有很高的對映立體選擇性[9]。
Khiar等[10]報導了一種方便有效地對映立體選擇性合成鈣敏感受體調節劑NPSR-568的三氟甲基取代的同類物,并可以得到兩種構型的對映異構體。由于異丙基亞磺酰基具有很高的反應活性,且空間立體位阻較大,易控制立體選擇性,所以三氟甲基化試劑對N-異丙基-亞磺酰亞胺進行親核加成反應,異丙基亞磺酰基能有效平衡反應活性和非對映立體選擇性,獲得較為滿意的結果。三氟甲基化試劑TMSCF3的親核加成反應,一般都是以三氟甲基陰離子的形式,但也可以以三氟甲基自由基的形式進行三氟甲基化反應。通常情況下,使用等當量的過渡金屬復合物如銀鹽[11-13]或者銅鹽[14]作為引發劑,催化Me3SiCF3的單電子氧化反應,產生所需的三氟甲基自由基。最近,Wang Y F等[15]發展了一種不需要過渡金屬復合物引發,直接采用Ph I(OAc)2催化三氟甲基化試劑Me3SiCF3釋放出三氟甲基自由基,與乙烯基疊氮化合物作用,生成α-三氟甲基取代的連氮化合物,可作為底物合成一系列有價值的醫藥農藥中間體。
1.2以4-溴-1,1,1-三氟-2-丁烯為三氟甲基化試劑
除了Ruppert-Prakash三氟甲基化試劑(TMSCF3)以外,還可以采用其它的三氟甲基化試劑。卿鳳翎等[16]以4-溴-1,1,1-三氟-2-丁烯為三氟甲基化試劑,對(R)-N-芐基-2,3-O-異亞丙基甘油醛亞胺進行三氟甲基烯丙基化,得到三氟甲基胺類化合物。從同一個三氟甲基衍生化的中間體出發,選擇不同的合成路線,可分別生成Cbz保護的(2R,3S)-4,4,4-三氟異亮氨酸和Boc保護的(2R,3S)-4,4,4-三氟纈氨酸78,提供了一種有效合成手性的三氟甲基氨基酸的方法。
1.3以三氟甲基炔基鋰為三氟甲基化試劑
卿鳳翎等[17]采用三氟甲基炔基鋰為三氟甲基化試劑,對各種取代的N-叔丁基-亞磺酰亞胺進行親核加成反應,得到一系列的三氟甲基取代的炔丙基亞磺酰胺化合物。以醛亞胺為底物,可以通過選擇不同極性的溶劑,調節產物的非對映立體選擇性。對于N-叔丁基-亞磺酰酮亞胺底物,在親核加成反應中加入三甲基鋁試劑,可顯著提高合成產率和非對映立體選擇性。
2 手性三氟甲基胺類化合物的應用
藥物分子中引入三氟甲基基團提高其生物活性的主要原因在于三氟甲基具有龐大的體積,是強吸電子基團(電負性為3.5 Pauling單位),可強烈影響相鄰官能團的反應活性。α-三氟甲基胺在新藥和新型材料的設計中可作為重要的手性合成子[19]。例如,含三氟甲基基團的多肽能緩解蛋白質降解,并可通過形成生物屏障提高蛋白質的吸收和滲透。三氟乙胺官能團[CH(CF3)NH]在多肽類似化合物中可取代肽鍵[CONH]。Zanda課題組提出手性的2,2,2-三氟乙胺可以取代平面的酰胺鍵,主要原因在于三氟甲基的特性可降低胺基的堿性,從而可以保持強的氫鍵作用,并與蛋白質水解的四面體過渡態結構類似。
目前,手性三氟甲基胺類化合物及其衍生物的研究處于有機氟化學研究和發展的最前沿,吸引越來越多的研究者在不同的化合物分子中同時引入三氟甲基和胺基基團,使其具有高的生物活性。圖1中列舉了一系列這類高生物活性的藥物及其中間體:α-胺基羰基合成酶的不可逆抑制劑[20-21];苯乙醇胺N-甲基轉移酶(PNMT)的抑制劑[22-23];中性肽鏈內切酶抑制劑[24];酪氨酸(TrK)激酶抑制劑,在治療疼痛、癌癥、炎癥、神經病變及某些傳染性疾病中起到重要作用[25];治療風濕的制劑[26];γ-氨基丁酸(GABA)調節劑,其對GABA Aα5受體具有親和性與選擇性[27];抗癌制劑[28];酪氨酸蛋白激酶抑制劑,主要用于治療骨髓增殖性疾病和乳腺癌[29-30];糖(腎上腺)皮質激素類似物或配體,調節糖皮質激素受體的功能,用于治療其受體功能受限引發的各種疾病[31]。
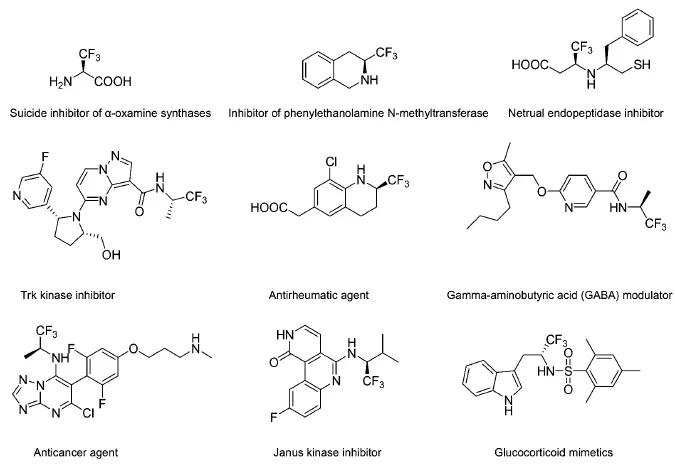
圖1 具有三氟甲基胺基基團的高生物活性的手性化合物Fig.1 Biologically active compoundswith chiralα-trifluoromethylated aminemotif
3 總結與展望
盡管近年三氟甲基化反應取得重要進展,三氟甲基化反應仍將是有機氟化學的重要研究方向,特別是發展無金屬存在下的三氟甲基化反應.三氟甲氧基化反應(CF3O)和三氟甲硫基化反應(CF3S)將會引起更多的關注。
[1]Liu J,Hu JB.Synthesis of fluorinated chiral amines using N-tert-butylsulfinyl imines[J].Future Med.Chem.,2009,1:875-888.
[2]Sorochinsky A E,Soloshonok V A.Asymmetric synthesis of fluorine-containing amines,amino alcohols,α-andβam ino acidsmediated by chiral sulfinyl group[J].J.Fluorine Chem.,2010,131:127-139.
[3]Ma J A,Cahard D.Asymmetric fluorination,trifluoromethylation,and perfluoroalkylation reactions[J].Chem. Rev.,2004,104:6119-6146.
[4]Nie J,Guo H C,Cahard D,et al.Asymmetric construction of stereogenic carbon centers featuring a trifluoromethyl group from prochiraltrifluoromethylated substrates[J]. Chem.Rev.,2011,111:455-529.
[5]程桂林.酶/金屬催化合成手性α-三氟甲基胺的方法研究[D].杭州:浙江大學,2015.
[6]Prakash G K S,Mandal M,Olah G A.Stereoselective nucleophilic trifluoromethylation of N-(tert-butylsulfinyl)-im ines by using trimethyl(trifluoromethyl)-silane[J].Angew. Chem.Int.Ed.,2001,40:589-590.
[7]Prakash G K S,Mandal M,Olah G A.Asymmetric synthesis of trifluoromethylated allylic amines usingα,β-unsaturated N-tert-butanesulfinimines[J].Org.Lett.,2001,3: 2847-2850.
[8]Prakash G K S,Mandal M.Stereoselective synthesis of trifluoromethylated vicinal ethylenediamines withα-Amino N-tert-butanesulfinimines and TMSCF3[J].J.Am.Chem. Soc.,2002,124:6538-6539.
[9]KawaiH,Kusuda A,Nakamura S,etal.Catalytic enantioselective trifluoromethylation of azomethine im ines with trimethyl(trifluoromethyl)silane[J].Angew.Chem.Int.Ed.,2009,48,6324-6327.
[10]Fernández I,Valdivia V,Alcudia A,et al.Enantiodivergent approach to trifluoromethylated am ines:A concise route to both enantiomeric analogues of calcimimetic NPS R-568[J].Eur.,J.Org.Chem.,2010:1502-1509.
[11]Wang X,Xu Y,Mo F Y,et al.Silver-mediated trifluoromethylation of aryldiazonium salts:Conversion of amino group into trifluoromethyl group[J].J.Am.Chem.Soc.,2013,135:10330-10333.
[12]Hafner A,Br?se S.Ortho-trifluoromethylation of functionalized aromatic triazenes[J].Angew.Chem.Int.Ed.,2012,51:3713-3715.
[13]Ye Y D,Lee S H,Sanford M S.Silver-mediated trifluoromethylation of arenes using TMSCF3[J].Org.Lett.,2011,13:5464-5467.
[14]Danoun G,Bayarmagnai B,Grünberg M F,et al.Sandmeyertrifluoromethylation of arenediazoniumtetrafluoroborates[J].Angew.Chem.Int.Ed.,2013,52:7972-7975.
[15]Wang Y F,Lonca G H,Chiba S.PhI(OAc)2-Mediated radical trifluoromethylation of vinyl azides with Me3SiCF3[J]. Angew.Chem.Int.Ed.,2014,53:1067-1071.
[16]Chen Q,Qiu X L,Qing F L.Indium-mediated diastereoselectiveallylation of D-and L-glyceraldimineswith 4-bromo-1,1,1-trifluoro-2-butene:highly stereoselective synthesis of 4,4,4-trifluoroisoleucines and 4,4,4-trifluorovaline[J].J.Org.Chem.,2006,71:3762-3767.
[17]Chen X Y,Qiu X L,Qing F L.Asymmetric synthesis of trifluoromethylatedpropargylam ines via 1,2-additions of trifluoromethylacetylide to N-tert-butanesulfinyl imines[J].Tetrahedron,2008,64:2301-2306.
[18]Shibata N,Mizuta S,Kawai H.Recent advances in enantioselective trifluoromethylation reactions[J].Tetrahedron: Asymmetr.,2001,19:2633-2644.
[19]Howard JA K,Hoy V J,O'Hagan D,et al.How good is fluorine as a hydrogen bond acceptor[J].Tetrahedron,1996,52:12613-12622.
[20]Alexeev D,Baxter R L,Campopiano D J,et al.Suicide inhibition of a-oxamine synthases:structures of the covalent adducts of 8-amino-7-oxononanoate synthase with trifluoroalanine[J].Org.Biomol.Chem.,2006,4:1209-1212.
[21]Smits R,Cadicamo C D,Burger K,et al.Synthetic strategies to alpha-trifluoromethyl and alpha-difluoromethyl substituted alpha-amino acids[J].Chem.Soc.Rev.,2008,37:1727-1739.
[22]Grunewald G L,Galdwell TM,LiQ F,et al.Synthesis and evaluation of 3-trifluoromethyl-7-substituted-1,2,3,4-tetrahydroisoquinolines as selective inhibitors of phenylethanolamine N-methyltransferase versus theα2-adrenoceptor[J].J.Med.Chem.,1999,42:3315-3323.
[23]Grunewald G L,Lu J,Criscione K R,et al.Inhibitors of phenylethanolamine N-methyltransferase devoid ofα2-adrenoceptor affinity[J].Bioorg.Med.Chem.Lett.,2005,15: 5319-5323.
[24]MolteniM,Volonterio A,FossatiG,etal.Conjugated additions of amines and beta-amino alcohols to trifluorocrotonic acid derivatives:synthesis of psi[NHCH(CF3)]-retro-thiorphan[J].Tetrahedron Lett.,2007,48:589-593.
[25]Allen S,Andrews S S,Condroski K R,et al.Substituted pyrazolo[1,5-a]pyrimidine compounds as Trk kinase inhibitors:WO,2011006074A1[P].2011-01-13.
[26]Kohno Y,Awano K,Miyashita M,et al.Synthesis and antirheumatic activity of novel tetrahydro-6-quinolineacetic acid derivatives[J].Bioorg.Med.Chem.Lett.,1997,7: 1519-1524.
[27]Buettelmann B,Jakob-roetne R,Knust H,et al.Isoxazolepyridine derivatives as GABA modulators:WO,2010127978A1[P].2010-11-11.
[28]Zhang N,Ayral-Kaloustian S,Nguyen T,et al.Synthesis and SAR of[1,2,4]Triazolo[1,5-a]pyrimidines,a class of anticancer agentswith a uniquemechanism of tubulin inhibition[J].J.Med.Chem.,2007,50,319-327.
[29]Kozina E,Dinsmore C,Young J,et al.Inhibitors of janus kinases and/or 3-phosphoinositide-dependent protein kinase-1:WO,2008112217A1[P].2008-09-18.
[30]Siu T,Young J,Altman M,et al.Inhibitors of janus kinases:WO,2009035575 A1[P].2009-03-19
[31]Kuzmich D,DiSalvo D,Regan JR,et al.Glucocorticoid mimetics,methods ofmaking them,pharmaceutical compositions,and uses thereof:US,20060154925A1[P].2006-07-13.
Synthesis and App lication of Chiral Trifluoromethyl Am ines Com pounds
LIU Xiao-hua,XU Guo-m ing,WENG Jian-xin,LIU Jing-wei,ZHANG Tian-ming
(Jingma Chemical Co.,Ltd.,Longyou,Zhejiang 324400,China)
Chiral trifluoromethyl amine compounds are important intermediates in medicine and pesticide.The synthesis of chiral trifluoromethyl amineswas summarized from the point of view of different trifluoromethylating agents,and their applications in the field of pharmaceuticalswere pointed out.
chirality;trifluoromethyl amines;asymmetric synthesis;progress
1006-4184(2016)10-0001-04
2016-04-09
劉小華(1975-),男,浙江龍游人,工程師,主要從事農藥和精細化工產品的研發與技術管理工作。E-mail:lxh75925@163. com。

