一株葡萄藻的分離、鑒定及產烴性能評價
陳傳紅 吳 洪 尹順吉 馬建源 李 青
( 新奧科技發展有限公司,煤基低碳能源國家重點實驗室,廊坊 065001)
一株葡萄藻的分離、鑒定及產烴性能評價
陳傳紅吳洪尹順吉馬建源李青
( 新奧科技發展有限公司,煤基低碳能源國家重點實驗室,廊坊 065001)
研究從我國海南博鰲海邊的淡水池塘水樣分離獲得一株綠藻ENN41。顯微形態觀察表明,ENN41的形態特征屬于葡萄藻。進一步克隆ENN41的核糖體小亞基18S rRNA片段,利用分子生物學軟件進行比對分析,結果表明ENN41的18S rRNA基因序列與布朗葡萄藻(Botryococcus braunii)同源性最高,說明ENN41為一株布朗葡萄藻(B. braunii)。ENN41在柱式反應器中培養16d,單位體積產率為0.483 g/(L·d),粗烴占干重的含量為56.6%; 主要脂肪酸為油酸(C18:1)、十八碳四烯酸(C18:4)和棕櫚酸(C16:0),三者之和占總脂肪酸的72.6%; 利用尼羅紅染色,清晰可見大量的油脂分布在細胞內和胞外基質中。ENN41在板式反應器中培養16d,單位體積產率為0.234 g/(L·d),粗烴占干重的含量為20.0%。上述研究表明,ENN41是具有較高的生長速度和粗烴積累能力的布朗葡萄藻(B. braunii)藻株,具有產業化應用潛力。
ENN41;18S rRNA;布朗葡萄藻;單位體積產率;粗烴含量
隨著全球化石能源的短缺和化石能源使用帶來的環境問題,尋找新型可替代能源勢在必行,微藻具有生物量大、生長周期短及含油脂類物質高等特點,在CO2減排和生物燃料利用上都有廣闊的開發前景[1—3]。
目前利用微藻生產生物柴油主要有兩種研發思路,一種是利用微藻合成的脂肪酸酯化來生產生物柴油,大多數的微藻通過脂肪酸合成途徑能夠積累大量油脂,目前大多數從事微藻能源研究的團體均采用此類研發思路來開發微藻生物柴油[4,5]; 另一種是利用微藻合成的烴類物質來生產生物柴油,因烴類物質與石油性質相似,故可代替石油成為新的可再生能源。迄今所發現的具有產烴能力的藻類有葡萄藻(B. braunii)[6—8]、鹽藻(Dunaliena salina)[9]、小球藻(Chlorella vugaris)[10]、網翼藻(Dictyopteris aerostichoides)[11]等,但葡萄藻因其含烴量高、烴類的組成和結構與石油極為相似之故,對葡萄藻的研究受到世界的廣泛關注。
葡萄藻又名叢粒藻,屬綠藻門(Chlorophyta)、四胞藻綱(Trebouxiophyceae)、葡萄藻科(Botryo coccaceae)、葡萄藻屬(Botryococcus),是一種世界性分布的淡水或微咸水綠藻[12]。葡萄藻烴含量為細胞干重的25%—86%,烴的性質因藻株有所區別[13]。葡萄藻的含烴量明顯高于其它微生物,但葡萄藻生長緩慢,室外養殖容易污染,很難得到大規模的推廣應用,因此,優良葡萄藻藻種是實現葡萄藻推廣應用的關鍵。
本研究以作者分離自海南的綠藻ENN41為實驗材料,通過顯微形態觀察,并結合18S rRNA序列特征,對ENN41進行了形態分類和分子鑒定。同時利用不同光反應器研究了ENN41的生長及烴積累情況,為藻株的下一步開發利用提供了依據。
1 材料與方法
1.1材料
藻株的分離本研究于2010年12月在海南博鰲海邊淡水池塘采集水樣,取無菌水稀釋水樣后,吸取一定量的樣品滴在載玻片上,用40倍或100倍顯微鏡觀察,將藻體移入視野中間,用毛細管直接吸取藻細胞,接種于48孔裝有BG11培養基的培養板中,在25℃、光照強度為50 μmol/(m2·s)條件下培養2—3周,后期進行顯微鏡觀察,選擇只有單藻株的孔,鋪平板及平板劃線進一步分離純化目的藻株,得到純藻種。經顯微鏡形態學觀察初步鑒定為葡萄藻屬的種類,命名為ENN41。
1.2方法
藻種培養藻種的培養采用BG11培養基,反應器為內徑50 mm、長度600 mm的柱式反應器,光照強度100 μmol/(m2·s),24h光照,培養溫度25—28℃,在培養過程中通過向培養液中通入1%—2%的二氧化碳和空氣的混合氣體,將培養基的pH控制在7—9。
藻種分子鑒定基因組的提取:采用液氮研磨和試劑提取的方法獲得,DNA溶于試劑盒所帶Elution Buffer。具體如下:將ENN41藻株用350目濾網先將藻液濃縮,然后再離心收集,盡量除去細胞沉淀中的多余水分,凍存于-20℃。用液氮研磨凍存的藻細胞,研磨的同時,加入適量玻璃砂。使用Biospin Genomic DNA Extraction Kit試劑盒提取待鑒定的ENN41藻株的基因組DNA,使用試劑盒附帶的Elution Buffer洗脫,1%瓊脂糖凝膠電泳檢測其濃度和純度。
18S rRNA 序列的擴增:采用真核生物18S擴增通用引物(引物合成由上海生工生物工程公司合成)擴增微藻基因組18S基因片段。(上游引物18SF:5′-CCTGGTTGATCCTGCCAG-3′; 下游引物18SR:5′-TTGATCCTTCTGCAGGTTCA-3′)。取1 μL總DNA為模板,PCR反應條件為:95℃預變性5min,然后94℃變性50s,56℃退火50s,72℃延伸90s,反應30個循環,最后72℃延伸10min。1.0%的瓊脂糖凝膠電泳檢測其擴增產物,回收純化目標DNA片段,并將目標片段連接到pMD18-T載體上(TAKARA,Japan) ,轉入E. coli感受態細胞,使用引物對18SF/R檢驗出陽性克隆送至上海生工公司測序。
序列分析與系統進化樹的構建用BLAST軟件對編輯后的基因序列的同源性進行分析。采用Clustal W軟件進行多序列比對,MEGA6.0進行Clustal W同源比對,然后采用Neighbor-Joining算法,Bootstrap值為1000,構建系統進化樹,所用藻株信息如表1所示。
實驗方法將對數生長期藻細胞接種到實驗用的光生物反應器中(分別為內徑30 mm、長度600 mm的柱式反應器和50 cm×5 cm×50 cm板式反應器),光強約為200 μmol/(m2·s),24h光照,溫度28—30℃,通入含1%—2%CO2的壓縮空氣將pH值控制在7—9,定時取適量藻液,進行相應的指標檢測。
分析方法生物量的測定:將Ф47 mm的Whatman(GF/C)濾膜于105℃烘干至恒重后稱重(W1),于設定的取樣時間移取一定體積(V)的藻液真空抽濾,在105℃的烘箱中烘干過夜,于干燥器中冷卻后稱重(W2)。生物量濃度用單位體積藻體的干重(Dry cell weight,DCW)表示。
生物量(DCW,g/L)=(W2-W1)/V
尼羅紅染色:取培養16d的藻液0.5 mL于4000 r/ min離心5min,去上清,并用去離子水洗滌2次,后用20% DMSO水溶液重新懸浮至0.5 mL,加入尼羅紅使其濃度為1 μg/L,35℃水浴10min,后用去離子水洗滌一次,此時將染色的藻細胞置于熒光顯微鏡下觀察。
粗烴的測定:將培養16d的藻液于4000 r/min離心5min,藻泥經真空冷凍干燥獲得凍干藻粉。取5.00 g凍干藻粉放置在圓底燒瓶中,加入200 mL氯仿,45℃水浴抽提8h,期間定時搖動燒瓶,使其充分混勻,抽提完后用定性濾紙過濾去除藻渣,用氯仿溶劑洗滌藻渣2次以上。收集氯仿相于旋轉蒸發儀40℃水浴中去除氯仿,剩余物即為粗烴。

表1 構建18S系統樹所用藻株信息Tab. 1 Strain information for construction of 18S phylogenetic tree
脂肪酸組成及含量的測定:(1)脂肪酸提取:取100 mg凍干藻粉放置在具Telfnon螺口瓶蓋的體積為15—20 mL的小玻璃瓶中,再放置一小磁力棒,加入2—4 mL 10% DMSO-Methanol 溶液,40℃砂浴(盛砂的燒杯放置恒溫加熱磁力攪拌器上)5min; 然后在4℃下磁力攪拌抽提30min,3500 r/min離心,轉移上清液到另一小瓶中。剩下藻渣再加入1 :1的乙醚、正己烷4—8 mL 4℃下磁力攪拌抽提1h,3500 r/min離心,轉移上清液到上述一小瓶中。可重復上述過程直到藻渣變白。在上述合并抽提液中加入純水使四者(水、DMSO-Methanol、乙醚、正己烷)體積比例為 1 :1 :1 :1,震蕩分相,移取有機相轉移到另一小玻璃瓶中,在通風櫥中用氮氣吹至成濃縮液,然后轉移到事先稱重過的1.5 mL塑料離心管中,再用氮氣吹干至恒重。(2)脂肪酸分析:照上面方法進行提取后,用正己烷溶解,使用Agilent 6820氣相色譜儀進行氣相色譜分析(色譜條件為載氣:氮氣流量1 mL/min、氫氣流量30 mL/ min、空氣流量300 mL/min,進樣口溫度:280℃,檢測器溫度:280℃,檢測器類型:Agilent FID,色譜柱:Agilent DB-5毛細管色譜柱(30 m × 0.25 mm,0.25 μm),分流比:4 :1。分析方法:內標法GB/T 17377-1998(氣相色譜用氮氣作載氣,相當于液相色譜的流動相)。
2 結果
2.1ENN41的形態學特征
在顯微鏡下觀察到ENN41的藻細胞形狀為橢圓形或楔形(圖1),幾個或上百個細胞通過不規則且長短不同的繩索狀透明膠質相連,組成大小不一的集結體; 細胞大小:長6—8 μm,寬5—7 μm,聚集群體一般在50 μm以上,大的可達數百μm至肉眼可見; 細胞顏色為深綠色或黃褐色,穩定期的細胞呈黃褐色; 細胞包被在不規則分枝或分葉的、半透明的膠群體膠被里,細胞頂部通常裸露在外; 穩定期的群體細胞經在擠壓后有明顯的油滴從膠被里滲出; 有時觀察可見細胞分裂,以似親孢子生殖,大的群體比較易于斷裂為小群體。
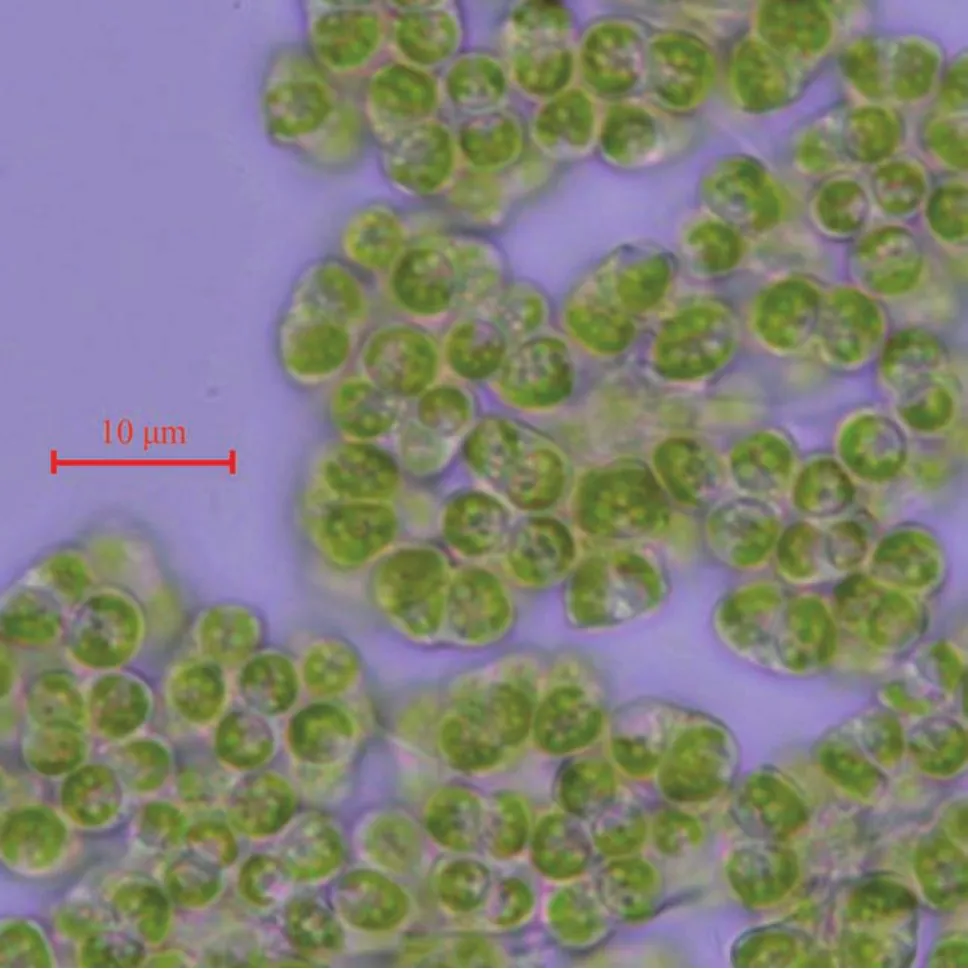
圖1 ENN41在正常生長下顯微照片Fig. 1 Micrograph of ENN41 under normal growth condition
2.2ENN41 18S rRNA基因序列分析
用真核生物18S rRNA擴增通用引物對18SF/R獲得的ENN41的18S rRNA序列,登錄GenBank數據庫進行BLAST比對,結果顯示與索引號為KC438297.1的布朗葡萄藻B. braunii strain 3005 的18S rRNA基因序列最為相似,匹配度為99%,覆蓋率為100%。
根據上述18S rRNA序列Blast結果,選取葡萄藻和其他綠藻相關基因序列信息繪制了ENN41的18S rRNA基因系統進化樹(圖2)。從圖2中可以看出,ENN41與布朗葡萄藻B. braunii strain 3005和B. braunii strain AGB-Bb02較近,與B. braunii isolate Songkla Nakarin和B. terribilis strain AICB 418較遠。
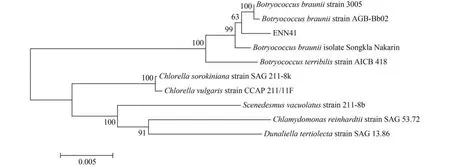
圖2 根據18S Blast基因序列構建布朗葡萄藻ENN41系統進化樹Fig. 2 Phylogenetic tree of Botryococcus braunii ENN41 based on the results of 18S Blast
2.3光反應器中ENN41的生長特性
柱式反應器ENN41在柱式反應器中持續培養16d,分別于4、7、10、13和16d取樣測定OD值和生物量。ENN41在16d的培養中一直呈現快速生長趨勢,OD750從接種時的0.300增加到2.705,平均每天增加0.150(圖3a); 生物量終濃度為8.710 g/L,單位體積產率為0.483 g/(L·d)(圖3b)。
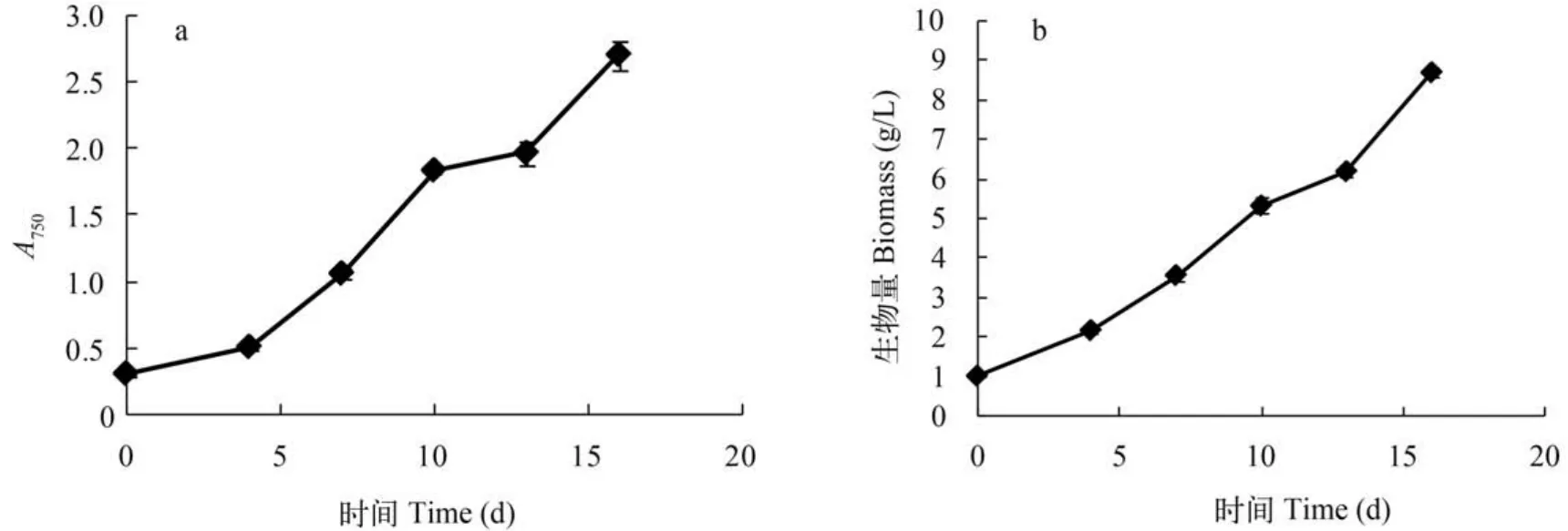
圖3 ENN41在柱式反應器中OD值(a)和生物質濃度(b)的變化Fig. 3 The OD750(a) and biomass concentration(b) of ENN41 in the column reactor
如表2所示,ENN41的粗烴占干重的含量在16d時為56.6%。從表觀上看,粗烴提取前藻粉呈褐綠色,提取后變為綠色,而提取出的粗烴在正己烷溶劑中呈褐色,說明在培養后期藻粉中積累了一定量的類胡蘿卜素,使后期藻粉和粗烴溶液帶有一定的褐色。

表2 ENN41在柱式反應器中培養16d時的粗烴含量Tab. 2 The crude hydrocarbon of ENN41 at the end of the 16d culture in column reactor
如表3所示,培養16d時ENN41的脂肪酸占干重的含量僅為5%,其中主要脂肪酸為油酸(C18:1)、十八碳四烯酸(C18:4)和棕櫚酸(C16:0),三者之和占總脂肪酸組成的72.6%。

圖4 粗烴提取前(a)、后(b)的ENN41藻粉及正己烷溶解的粗烴(c)Fig. 4 The extraction of crude hydrocarbon of ENN41. Algal power before(a) and after(b) extraction of ENN41,crude hydrocarbons dissolved in hexane(c)
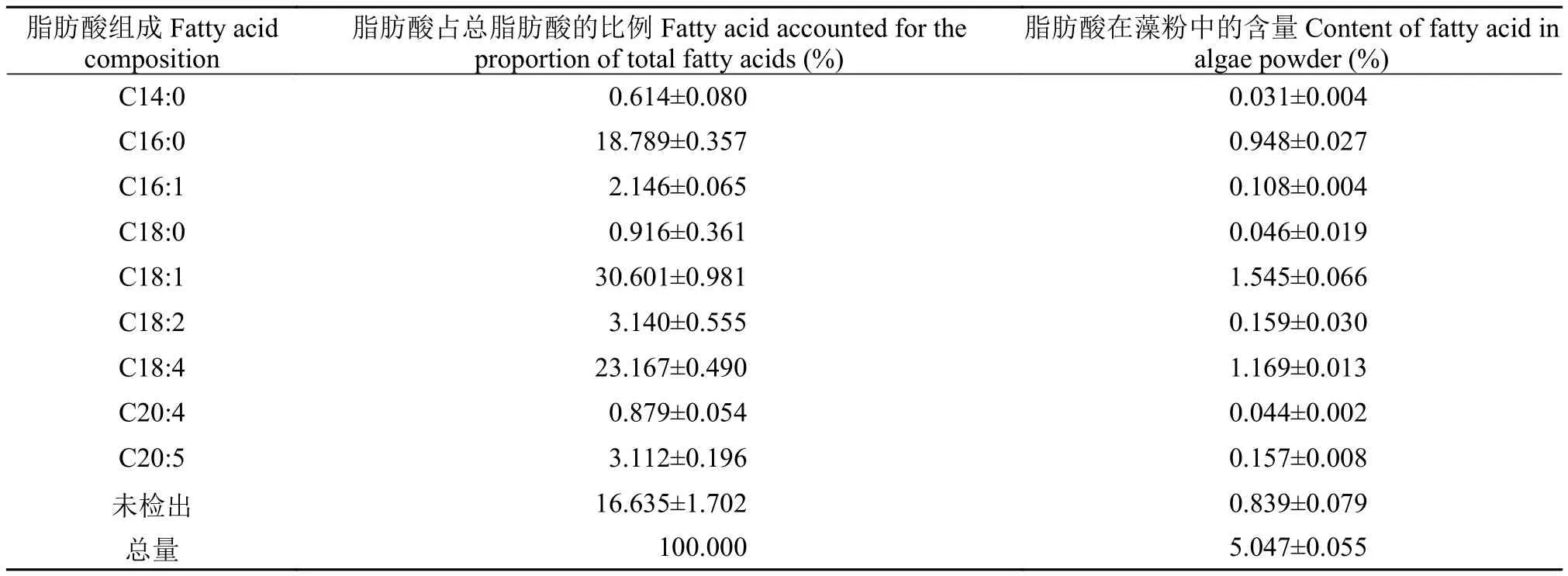
表3 ENN41在柱式反應器中培養16 d時的脂肪酸組成及含量Tab. 3 Fatty acid composition and content of ENN41 at day 16
收集在柱式反應器中培養了16d的ENN41藻體,用尼羅紅染色。如圖5所示,可以清楚的看見大量的油脂分布在胞外基質中,少部分分布在細胞內。
板式反應器ENN41在光徑5 cm的板式反應器中持續培養16d,每隔1天取樣測定生物量濃度,于培養結束時測定粗烴含量。ENN41在整個培養過程中生物量一直呈逐漸增加趨勢,16d時的生物量為4.584 g/L,單位體積產率為0.234 g/(L·d),粗烴占干重的含量為20%。ENN41在放大的光生物反應器中,雖然與窄光徑、小體積的柱式反應器相比,產量降低了許多,但仍然保持了相對較快的生長速度。這說明ENN41在放大的培養體系中,仍然保持了較好的生長性能,另外,本次放大實驗未使用營養鹽脅迫誘導條件,仍然獲得了較高的烴含量。
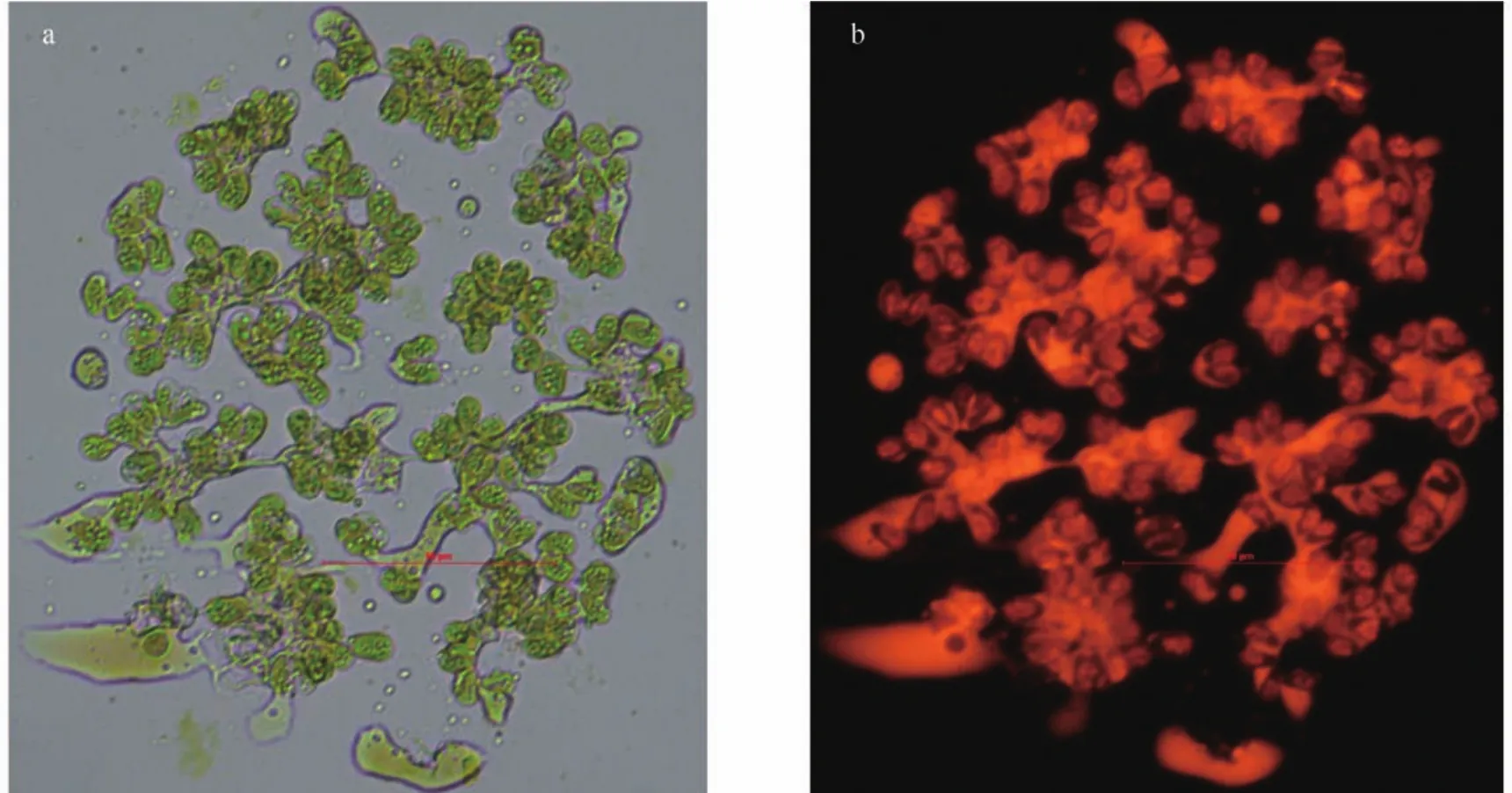
圖5 布朗葡萄藻ENN41的尼羅紅染色圖Fig. 5 The Nile red staining of Botryococcus braunii ENN41
3 討論
微藻形態分類需要較長周期的觀察,并要求研究者有豐富的藻類學知識,部分微藻常因培養條件的改變而發生形態的變化,從而影響微藻的形態學分類。利用基因序列分析可克服在形態上變化和形態難以區別的藻株,對微藻的分類提供依據,結果的準確性也更高,同時有利于厘清同源性較高的藻株間的進化距離。本研究使用的ENN41在培養過程中也會發生細胞大小和集落大小的改變,但總體生物學形態特征與剛分離時相差不大。本研究利用18S rRNA基因序列對ENN41分類作了進一步的鑒定,系統進化樹證明分離自海南的藻株ENN41與布朗葡萄藻B. braunii strain 3005和云南撫仙湖的AGB-Bb02進化距離最短,與另外幾株葡萄藻藻株之間的進化距離要遠一些,說明相似生境來源的藻株的同源性也會較高,而不同生境來源的藻株之間存在遺傳多樣性。這與王朋云等[14]報道的不同地理來源的葡萄藻藻株的形態和遺傳多樣性結果一致。
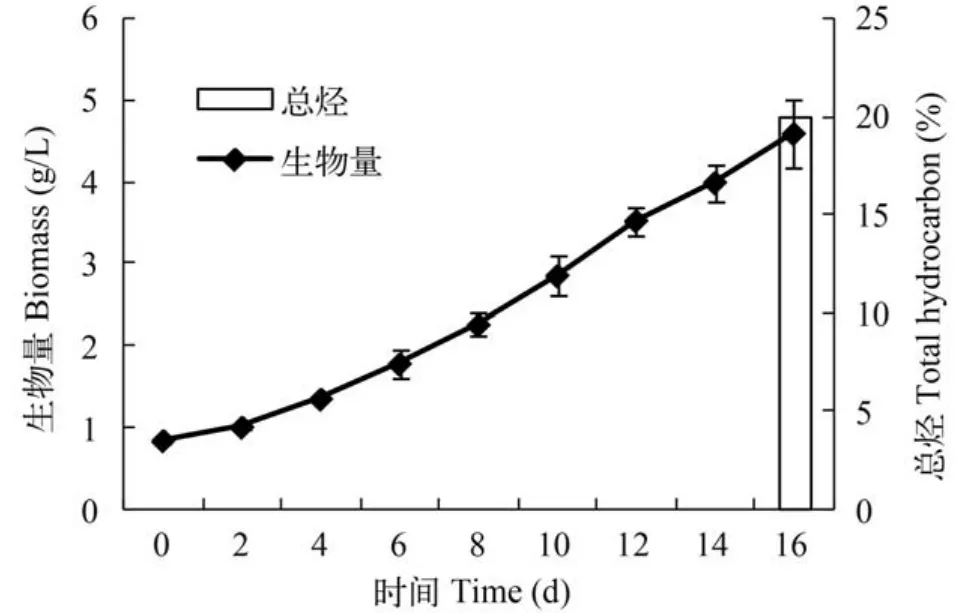
圖6 ENN41在板式反應器中的生長曲線和16d時的粗烴含量Fig. 6 The growth curve of ENN41 in plate reactor and the crude hydrocarbon content over 16 days
關于葡萄藻培養方面,各國研究者已經開展了許多工作,主要集中在培養基和營養元素及環境條件的研究上。可用于培養葡萄藻的培養基主要有:Chu10、Chu13、Prat、BBM、BG11等,這些培養基主要在大量元素含量上差別較大,本文采用了營養成分較充分且淡水藻常用的BG11培養基。另外,在葡萄藻培養中,光照、溫度、鹽度、pH等環境因子對其生長和產烴量有很大影響。光強大小不僅影響微藻的色素比例,而且影響了葡萄藻的生長速度和產烴量。Zhang等[15]在較高光強[約140 μmol/(m2·s)]下培養布朗葡萄藻,生物量和產烴量均高于低光強下的數值,Oyama等[16]在中等光強[140—400 μmol/(m2·s)]下更有利于布朗葡萄藻的生長和產烴。溫度對布朗葡萄藻的影響具有種屬特異性[17],通常最適生長溫度是23—25℃。pH是對微藻生具有重要影響的因素之一,pH主要影響無機碳在水中的溶解形式,而影響藻細胞的生長。本研究培養布朗葡萄藻所用的培養條件為光強200 μmol/(m2·s),溫度25℃左右,pH控制在7—9,與上述文獻描述的布朗葡萄藻生長條件基本吻合,有效提高了ENN41藻株的生長和產烴量。一直以來,許多研究者認為葡萄藻生長速度較慢,是限制其產業化應用的主要原因。其中Banerjee等[18]認為,葡萄藻生長速度慢的主要原因是因為藻細胞合成高熱值的碳氫化合物,而不是由于營養物的缺乏。本研究利用柱式反應器培養ENN41藻株,16d時生物量達到了8.710 g/L,單位體積產率達到0.483 g/(L·d),同時,粗烴占干重的含量也達到了56.6%,表明合成高熱值碳氫化合物的ENN41同時具有較高的生長速度。布朗葡萄藻ENN41具有的高生長速度、生物量積累能力和產烴能力在國內布朗葡萄藻的研究中還是首次報道,并且,這樣的結果與利用相似培養條件和柱式反應器的王元麗等[19],高保燕等[20]報道的真眼點藻、柵藻產量相似,也就是說,布朗葡萄藻ENN41的生長速度和生物量積累能力能夠趕上以生長快速、生物量積累能力高著稱的真眼點藻和柵藻了。日本的研究者Kojima等[21]報道利用柱式光反應器(內徑為7 cm,8.5 cm高的圓錐形底部)培養布朗葡萄藻,在反應器內壁光強約為140 μmol/(m2·s),培養25d,其生物量達到了7 g/L,烴含量為干重的50%。另有文獻報道在鼓泡塔反應器中用豬舍廢水培養布朗葡萄藻,可以有效的去除水中的氮磷,且藻細胞的干重達到了8.5 g/L,產烴量為0.95 g/L[22]。上述國外報道和作者關于布朗葡萄藻ENN41的研究結果表明,優良的布朗葡萄藻藻株在合適的培養條件下,也具有高速生長、積累高生物量的潛力和高產烴能力。
徐玲等[23]報道不同培養基對布朗葡萄藻脂肪酸組成沒有影響,其主要脂肪酸組成為棕櫚酸(C18:1)、油酸(C18:1)和亞麻酸(C18:3)。而Rao等[24]報道在Chu13培養基中主要脂肪酸為硬脂酸(C18:0)和亞油酸(C18:2),在培養基中添加一定濃度的NaCl后主要脂肪酸變為棕櫚酸(C16:0)和油酸(C18:1)。而本研究中布朗葡萄藻ENN41培養后期主要脂肪酸為油酸(C18:1)、十八碳四烯酸(C18:4)和棕櫚酸(C16:0)。由此可見,不同株系的布朗葡萄藻其主要脂肪酸可能不同,且同一株布朗葡萄藻在不同培養條件或不同培養基下,主要脂肪酸可發生改變,但布朗葡萄藻的主要脂肪酸都是由C18和C16組成。
本研究中的布朗葡萄藻ENN41利用尼羅紅染色發現,大量的油脂分布在胞外基質中,少部分分布在細胞內。有文獻報道利用尼羅紅對烴類進行染色觀察,發現有大量油滴主要分布在胞外基質中,細胞內也清晰可見少量油滴的分布[25,26]。這與本研究染色基本結果一致,說明胞外基質是布朗葡萄藻ENN41儲藏烴類物質的主要場所。Largeau C等[27]通過電子顯微鏡觀察進一步表明,烴類在胞外基質中積累量可達到95%,此時細胞內積累的烴類僅為5%左右。
4 結論
從海南博鰲海邊的淡水池塘中分離獲得的ENN41是一株布朗葡萄藻藻株。顯微形態觀察表明,ENN41的形態特征屬于葡萄藻; ENN41的18S rRNA基因序列與布朗葡萄藻的18S rRNA基因序列同源性最高。ENN41在柱式反應器中培養16d,生物量為8.710 g/L,單位體積產率為0.483 g/(L·d),粗烴占干重的含量為56.6%; 主要脂肪酸為油酸(C18:1)、十八碳四烯酸(C18:4)和棕櫚酸(C16:0),三者只和占總脂肪酸組成的72.6%; 利用尼羅紅染色,可以清晰看見大量的油脂分布在細胞內和胞外基質中。ENN41在放大的板式反應器中培養16d的單位體積產率、生物量和粗烴含量也達到了較高水平。本研究結果表明,ENN41是具有較高的生長速度和粗烴積累能力的布朗葡萄藻藻株,具有產業化應用潛力。
[1]Williams P,Laurens L. Microalgae as biodiesel and biomass feedstocks:review and analysis of the biochemistry and economics [J]. Energy & Environmental Science,2010,3(5):554—590
[2]Chisti Y. Biodiesel from microalgae [J]. Biotechnology Advances,2007,25(3):294—306
[3]Singh J,Gu S. Commercialization potential of microalgae for biofuels production [J]. Renewable & Sustainable Energy Reviews,2010,14(9):2596—2610
[4]Miao X L,Wu Q Y. Study on preparation of biodiesel from microalgal oil [J]. Acta Energiae Solaris Sinica,2007,28(2):219—222 [繆曉玲,吳慶余. 微藻油脂制備生物柴油的研究. 太陽能學報,2007,28(2):219—222]
[5]Li L,Zheng L,Zheng M G,et al. Effect on lipid accumulation of marine oleaginous microalgae under CO2enrichment cultivation [J]. Acta Hydrobiologica Sinica,2013,37(6):1013—1019 [李林,鄭立,鄭明剛,等. 富碳培養對海洋富油微藻油脂積累特性的影響. 水生生物學報,2013,37(6):1013—1019]
[6]Templier J,Largeau C,Casadevall E. Variations in external and in ternal lipids associated with inhibition of the resistant biopolymer from the a race of Botryococcus braunii [J]. Phytochemistry,1993,33(5):1079—1086
[7]Metzger P,Largeau C. Botryococcus braunii:a rich source for hydrocarbons and related ether lipids [J]. Applied Microbiology and Biotechnology,2005,66(5):486—496
[8]Motohide I,Masahiro O,Nobuyoshi N,et al. Isolation of herbicide-resistant mutants of Botryococcus braunii [J]. Bioresource Technology,2012,109:300—303
[9]Tornabene T G,Holzer G,Peterson S L. Lipid profile of the halophilic alga Dunaliella salina [J]. Biochemical and Biophysical Research Communications,1980,96:1349—1356
[10]Wu Q Y,Yin S,Sheng G Y,et al. New discovery for hererotrophic etiolation algae to study on producing hydrocarbon [J]. Science in China(Series B),1993,23(4):423—429 [吳慶余,殷實,盛國英,等. 異養黃化藻類產烴研究新發現. 中國科學B輯,1993,23(4):423—429]
[11]Wirth D,Fischer-Lui I,Boland W,et al. Absolute configuration and synthesis of dextro caudoxirene the gametereleasing and gamete-attracting pheromone of the brown alga Peritha liacaudata Phaeophyceae [J]. Helvetica Chimica Acta,1992,75:751—758
[12]Banerjee A,Sharma R,Chisti Y,et al. Botryococcus braunii:a renewable source of hydrocarbons and other chemicals [J]. Critical Reviews in Biotechnology,2002,22(3):245—279
[13]Senousy H H,Beakes G W,Hack E. Phylogenetic Placement of Botryococcus braunii(Trebouxiophyceae) and Botryococcus sudeticus isolate UTEX 2629(Chlorophyceae) [J]. Journal of Phycology,2004,40(2):412—423
[14]Wang P Y,Mao Y X,Kong F N,et al. Morphological and genetic diversity of Botryococcus braunii [J]. Periodical of Ocean University of China,2011,41(5):63—70 [王朋云,茅云翔,孔凡娜,等. 叢粒藻形態多樣性與遺傳多樣性研究. 中國海洋大學學報,2011,41(5):63—70]
[15]Zhang K,Eiichi K. Effect of light intensity on colony size of microalga Botryococcus braunii in bubble column photobioreactors [J]. Fermentation and Bioengineering,1998,86(6):573—576
[16]Oyama H,Kim S,Park E R. Effects of light intensity and nutrients on the growth of Botryococcus sp. [J]. Misaengmul Hakhoechi,1997,25(3):339—343
[17]Wang X Y,Xie S H. Effects of several factors on Botryococcus braunii [J]. Microbiology,1996,23(5):275—277[王修垣,謝樹華. 幾種因子對從粒藻株A的效應. 微生物學通報,1996,23(5):275—277]
[18]Banerjee A,Sharma R,Chisti Y. Botryococcus braunii:a renewable source of hydrocarbon and other chemicals [J]. Critical Reviews in Biotechnology,2002,22(3):245—279
[19]Wang Y L,Li Q Y,Li A F,et al. Growth and photosynthetic physiological characteristics of four Eustigmatophycean species [J]. Biotechnology,2014,24(2):91—95[王元麗,李其雨,李愛芬,等. 4株真眼點藻的生長及光合生理特性. 生物技術,2014,24(2):91—95]
[20]Gao B Y,Shen D D,He S S,et al. Integrated the biomassproduction of oleaginous microalga Scenedesmus acuminatus and dairy wastewater treatment [J]. Renewable Energy Resources,2014,32(5):673—679 [高保燕,沈丹丹,何思思,等. 富油微藻——尖狀柵藻生物質生產與奶牛場廢水處理相結合的效果研究. 可再生能源,2014,32(5):673—679]
[21]Kojima E,Zhang K. Growth and hydrocarbon production by microalga Botryococcus braunii in bubble column photobioreactor [J]. Journal of Bioscience and Bioengineering,1999,87:811—815
[22]An J Y,Sim S J,Lee J S,et al. Hydrocarbon production from secondarily treated piggery wastewater by the green alga Botryococcus braunii [J]. Journal of Applied Phycology,2003,15(2—3):185—191
[23]Xu L,Liu C Z,Li H Z. Medium selection of Botryococcus braunii and its metabolic mechanism [J]. Chinese Journal of Bioprocess Engineering,2010,8(6):40—45[徐玲,劉春朝,李華鐘. 布朗葡萄藻的培養基選擇及其產物代謝規律. 生物加工過程,2010,8(6):40—45]
[24]Rao A R,Dayananda C,Sarada R,et al. Effect of salinity on growth of green alga Botryococcus braunii and its constituents [J]. Bioresource Technology,2007,98(3):560—564
[25]Tanoi T,Kawachi M,Watanabe M M.Effects of carbon source on growth and morphology of Botryococcus braunii [J]. Journal of Applied Phycology,2011,23:25—33
[26]Tanoi T,Kawachi M,Watanabe M M. Iron and glucose effects on the morphology of Botryococcus braunii with assumption on the colony formation variability [J]. Journal of Applied Phycology,2014,26:1—8
[27]Largeau C,Casadevall E,Berkaloff C,et al. Sites of accumulation and composition of hydrocarbons in Botryococcus braunii [J]. Phytochemistry,1980,19(6):1043—1051
ISOLATION,IDENTIFICATION AND EVALUATION OF HYDROCARBON PRODUCING PERFORMANCE OF ONE BOTRYOCOCCUS STRAIN
CHEN Chuan-Hong,WU Hong,YIN Shun-Ji,MA Jian-Yuan and LI Qing
(State Key Laboratory of Coal-Based Low-Carbon Energy,Xinao Scientific & Technological Developmental Co.,Ltd.,Langfang 065001,China)
ENN41 is a freshwater strain isolated from Bo'Ao coast of Hainan Province. Microscopic observation showed that ENN41 has the unique morphological character of genus Botryococcus. The 18S rRNA gene of ENN41 was cloned for further species confirmation at molecular level. The homologous analysis showed that the 18S rDNA gene of ENN41 was highly homologous to the species of Botryococcus braunii in GenBank. ENN41 achieved a biomass productivity of 0.483 g/(L·d) and crude hydrocarbon content of 56.6% for 16 days culture in column reactor. The main fatty acids were oleic acid(C18:1),octadecatetraenoic acid(C18:4) and palmitic aid(C16:0),accounting for 72.6% of the total fatty acid. Large amount of lipid stained with Nile red in the extracellular matrix. ENN41 reached a high productivity after 16 days culture in plate bioreactor [0.234 g/(L·d)] with 20% crude hydrocarbon. All the results showed that ENN41 is a natural Botryococcus braunii strain with high productivity of biomass and lipids and high potential for industrial application.
ENN41; 18S rRNA; Botryococcus braunii; Biomass productivity; Crude hydrocarbon
Q949.2
A
1000-3207(2016)05-1012-08
10.7541/2016.131
2015-08-21;
2016-01-05
國家“973”項目(2012CB723606); 國家重大科學儀器設備開發專項(2012YQ15008715)資助 [Supported by the National Basic Research Program of China(973 Program)(2012CB723606); the National Key Scientific Instrument and Equipment Development Project(2012YQ15008715)]
陳傳紅(1982—),女,山東人; 碩士; 研究方向為藻類生物技術及應用。E-mail:chench@enn.cn
吳洪,博士; E-mail:wuhong@enn.cn

