中藥生地黃對柵藻生物光子輻射的影響*
賈寒,龐靖祥,楊美娜,張玉風,韓金祥△
(1.濟南大學 山東省醫學科學院醫學與生命科學學院,山東濟南250020;2.山東省醫學科學院醫藥生物技術研究中心,山東濟南250062)
1 引 言
任何有生命的物質都會自發的向外輻射光子,這種現象稱為生物光子輻射,其波長范圍在200~800 nm,強度很弱,大約幾到幾百個光子/s·cm2,但是它攜帶著豐富的生命信息,能提供有機體代謝及功能轉化的重要信息[1]。大量實驗結果表明,生物光子輻射存在于所有的生物系統之中,是一種普遍的生命現象。生物光子輻射對生物系統內部及外界環境的變化具有高度靈敏性,所以,可以通過對生命系統的生物光子輻射的檢測和研究,來獲得豐富的生命信息,從而了解生命系統內外界環境的微弱變化。
水體中的藻類對污染毒物非常敏感.而且種類繁多.可以生存在不同類型的水體以及水體的不同生境之中,所以其可作為監測水質變化的測試生物[2]。柵藻是淡水中常見的浮游藻類,在水質評價中可作為指示生物,且斜生柵藻等又極易進行大量人工培養,故柵藻常常作為研究水體污染的一種很好的實驗材料[3-4]。綜上所述,柵藻對其所處的環境非常敏感,在不同的水環境中其生物學行為會有所不同,因而,其生物光子輻射行為也會存在差異。本研究以柵藻為實驗對象,利用YPMS-2生物光子測量儀對加入中藥生地黃后的柵藻生物光子輻射行為進行探索研究。
2 材料和方法
2.1 材料
2.1.1 主要儀器設備 光電倍增管(9558QB),樣品室,光源裝置,高壓電源,制冷系統,光子計數器,數據采集卡,UV-2802型紫外可見分光光度計,恒溫光照培養箱,滅菌鍋,電陶爐,砂鍋。
2.1.2 供試生物 柵藻(Scenedesmus sp.)自中國科學院武漢水生生物研究所采購(編號FACHB-933),使用BG11培養基進行培養。
2.2 方法
2.2.1 柵藻的培養 選取生長狀態良好且處于對數生長期的柵藻,將其接入滅菌的玻璃三角瓶(500 ml)中,加入BG11培養基,放入恒溫培養箱中培養,設定溫度為25℃,光照強度為4 000 Lux,光暗比為12∶12 h,每天手工搖瓶2~3次,培養20天,然后進行轉接,轉接比例為 1∶5(藻液:BG11培養基)[5-6]。按上述方法培養一段時間,選擇長勢良好的柵藻進行實驗。
2.2.2 柵藻濃度的測定 測定藻類生物量的方法一般有光密度測量法、顯微直接計數法、葉綠素a含量測定法等,相較之下,光密度法易于操作,測量過程方便快捷,重復性較高,因此本研究選用光密度法測定柵藻濃度。
混勻藻液,用移液槍吸取3 ml置于4 cm×1 cm×1 cm的石英比色杯中,使用紫外可見分光光度計在波長680 nm處測量藻液的吸光度值。通過藻液的吸光度A與細胞密度Y的線性回歸方程:C=(A*11.995+0.1502)*106個/ml(R2=0.9766)[7],根據測得的藻液吸光度值,計算出藻液的濃度。
2.2.3 中藥湯劑的制備 頭煎:取10 g生地黃,加200 ml水,浸泡半小時,先用武火煎煮,煮沸后改用文火,共煎煮15 min。濾出藥渣用于二煎,保留藥液。二煎:將頭煎的藥渣加水200 ml,煎煮20 min,濾出藥渣,保留藥液。將兩次煎煮的藥液合并,用濾紙再次過濾并放涼至室溫,最終得到生地黃湯劑50 ml。
2.2.4 實驗準備 提前2 h打開溫濕度控制系統,設定室溫為20℃,室內濕度50%。打開YPMS-2生物光子測量儀,設置儀器的工作電壓為1252 V,待制冷系統將溫度降至-23℃,測量儀器的本底噪聲。
2.2.5 測量生地黃湯劑的生物光子輻射 用移液槍吸取3 ml生地黃湯劑置于4 cm×1 cm×1 cm的石英比色杯中,混勻,然后迅速放入樣品室,測量其自發發光、延遲發光。
2.2.6 測量BG11培養基與柵藻的生物光子輻射 取3 mlBG11培養基置于石英比色杯中,放入樣品室,測量其自發發光及延遲發光。取3 ml藻液置于石英比色杯中,用紫外可見分光光度計測其吸光度,放入樣品室中暗適應15 min,測量其自發發光及延遲發光。
2.2.7 測量加入不同體積生地黃的柵藻自發發光 選取長勢良好的柵藻,測其吸光度,從中取樣11份置于石英比色杯中,每份3 ml,分別加入11個不同體積(0、50、110、170、230、290、350、410、470、530、590 ul)的生地黃湯劑于藻液中,并將其混勻放入樣品室中,暗適應15 min,測量其自發發光。
2.2.8 測量加入不同體積生地黃的柵藻延遲發光延遲發光是生物系統受光照射后發生的長時間超微弱發光弛豫的現象,是生物超微弱發的重要組成部分,被認為是反映生物系統內部狀態的一種指標[7-8]。選取一瓶長勢良好的柵藻,測其吸光度,在該瓶柵藻中取樣11次,每次3 ml,分別置于10個石英比色杯中,向每個樣品里依次加入生地黃湯劑 0、50、110、170、230、290、350、410、470、530、590 ul,并將其混勻放入樣品室中,暗適應15 min,測量其延遲發光。
2.2.9 數據處理分析 將得到的數據輸入originpro 2015軟件中,分別對以上的實驗結果進行分析處理。
3 結果與討論
3.1 生地黃湯劑與柵藻液的生物光子輻射比較
為了排除生地黃湯劑自身發光對實驗結果的影響,因而對生地黃湯劑的生物光子輻射進行測量。依次檢測儀器本底噪聲、湯劑的自發發光、延遲發光以及藻液的自發發光、延遲發光,由于白光包含全波段光譜,激發對象后產生的延遲發光將包含生物系統的全面信息,因此激發光源選擇白光,激發時間為10 s。如圖1所示,儀器噪聲的平均光子數為11.07個/s,生地黃湯劑自發發光平均光子數為13.22個/s,柵藻自發發光平均光子數為22.9個/s。從圖中可以看出,柵藻的自發發光光子數明顯高于儀器噪聲和生地黃湯劑,而生地黃湯劑的自發發光光子數與噪聲相近,因此與柵藻的自發發光相比,生地黃湯劑的自發發光可以忽略不計。
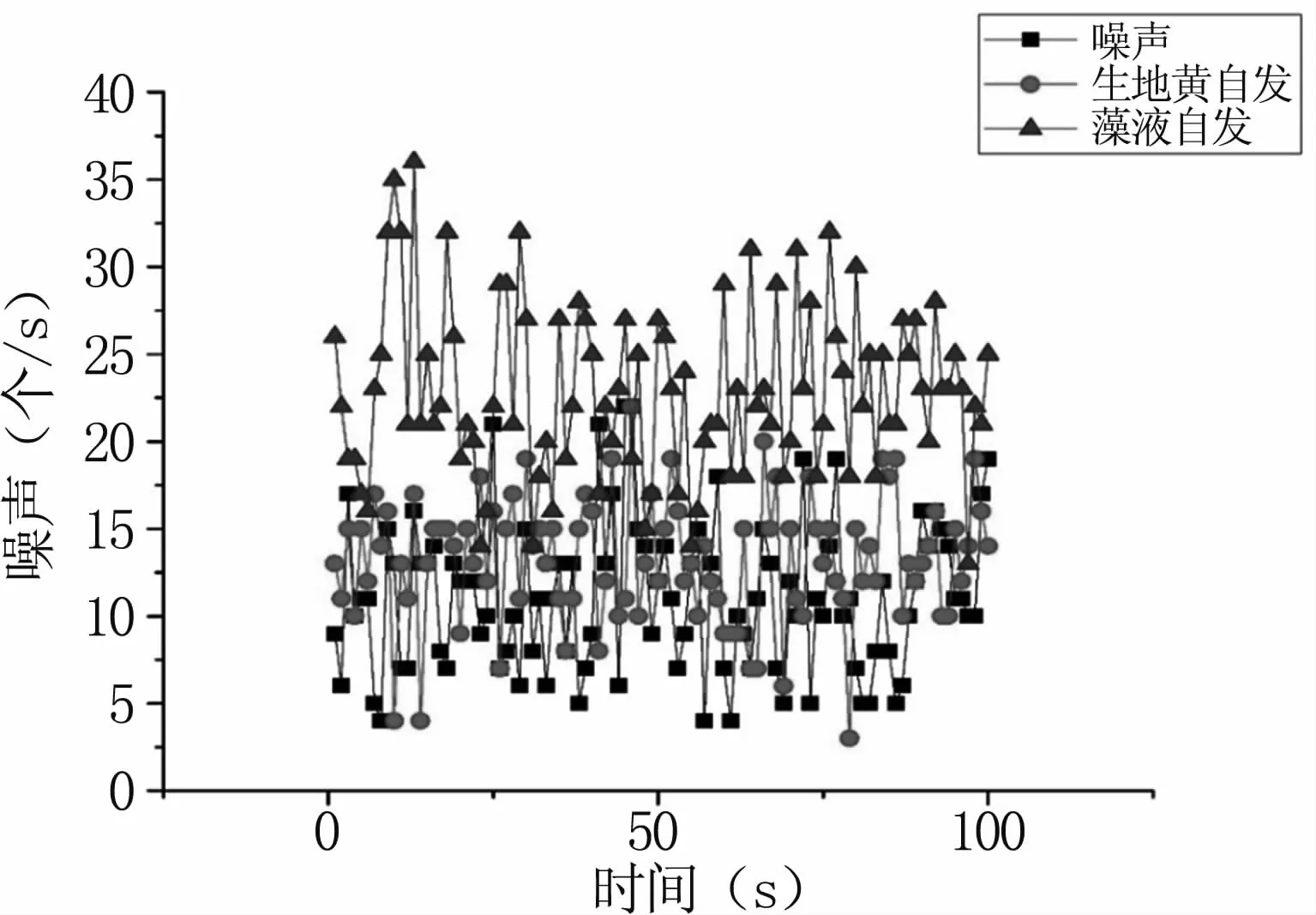
圖1 生地黃湯劑與柵藻的自發發光對比Fig 1 Comparison of Radix Rehmannia Decoction and the spontaneous luminescence of Scenedesmus
圖2為生地黃湯劑的延遲發光衰減曲線,可以看出其第1 s的延遲發光光子數為59個/s,隨后則直接衰減至自發狀態(平均光子數為13個/s),呈指數衰減。圖3是生地黃與柵藻延遲發光的衰減曲線,通過對比可以發現,與柵藻的延遲發光相比較而言,生地黃的延遲發光幾乎可以忽略不計,綜上所述,可以排除實驗過程中生地黃湯劑自身的生物光子輻射對結果的影響,加入生地黃湯劑的柵藻的生物光子輻射即為其自身的發光。

圖2 生地黃湯劑的延遲發光曲線Fig 2 The delayed luminescence curve of Radix Rehmanniae Decoction
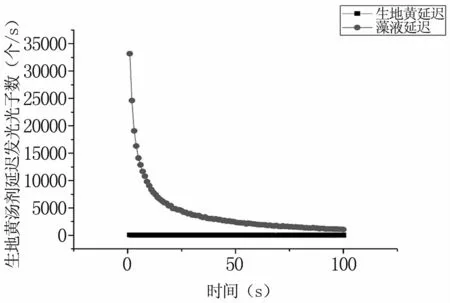
圖3 生地黃湯劑與柵藻的延遲發光對比Fig 3 Comparison of delayed luminescence of Radix Rehmannia Decoction and Scenedesmus
3.2 BG11培養基與柵藻液的生物光子輻射比較
BG11培養基是一種無菌水溶液,主要由無機鹽NaNO3、K2HPO4、MgSO4、CaCl2、ZnSO4等組成,為了排除培養基自身發光對實驗結果的影響,分別測量了BG11培養基的自發發光及柵藻的自發發光,結果見圖4。由圖中可以看出,BG11培養基的自發發光光子數與噪聲的光子數非常相近,而藻液的自發發光光子數明顯高于前二者。通過計算,儀器噪聲的平均光子數為11.07,BG11培養基的自發發光平均光子數為11.91,藻液的自發發光平均光子數為22.9,前二者的光子數近似相等,因此培養基的自發發光可以忽略不計,藻液的自發發光即為柵藻本身的自發發光。

圖4 BG11培養基與柵藻的自發發光對比Fig 4 Comparison of spontaneous emission of BG11 medium and Scenedesmus
圖5為BG11培養基的延遲發光衰減曲線,其光子數由50多個在1 s后直接衰減至自發狀態,延遲發光曲線呈指數衰減。通過培養基與藻液延遲發光曲線的對比(見圖6),可以發現與柵藻的延遲發光相比,培養基的延遲發光幾乎可以忽略不計,綜上所述,可以排除實驗過程中BG11培養基自身的生物光子輻射對柵藻的影響,認為藻液的生物光子輻射即為柵藻本身的生物光子輻射。
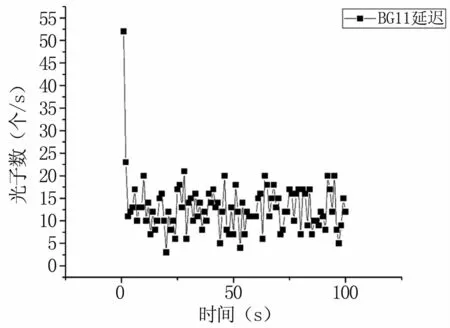
圖5 BG11培養基的延遲發光曲線Fig 5 Delayed luminescence curve of BG11 medium
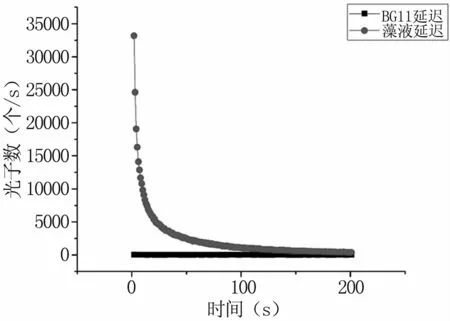
圖6 BG11培養基與柵藻的延遲發光對比Fig 6 Comparison of delayed luminescence between BG11 medium and Scenedesmus
3.3 加入不同體積生地黃湯劑對柵藻自發發光的影響
選取對數生長期的柵藻,測其吸光度A=1.27,根據公式 C=(A×11.995+0.1502)×106個/ml(R2=0.9766)算出藻液的濃度為1.5×107個/ml,然后取11個樣,每個3 ml,分別向其中加入不同體積的生地黃湯劑,依次測量柵藻的自發發光,計算其平均光子數,結果見表1。儀器噪聲10.9,藻液的自發平均光子數為22.9,隨著加入生地黃體積的增加,其自發平均光子數的變化趨勢是先增大后減小,最高值在350 ul處,光子數為42.5個/s,見圖7。當加入湯劑的體積小于350 ul時,湯劑的加入體積與柵藻的自發光子數的關系呈正相關,將公式y=a+b×x(1)輸入originpro軟件中,把測得的柵藻自發發光數據與理論表達式(1)進行最佳線性擬合,得到方程 y=27.35714+0.76113×x,R2=0.971,擬合的兩個參數a=27.35714,b=0.76113,擬合關聯度高達97.1%,見圖8。所以說在一定范圍內,生地黃的加入體積與柵藻自發發光平均強度呈較好的線性關系。生地黃為一種常用中藥,性味甘寒,歸心、肝、腎三經,功效:清熱涼血,養陰生津。根據以上數據分析可得,中藥生地黃可以使柵藻的自發發光呈現一種規律性的變化,并且在一定范圍內二者會表現出較好的線性關系。
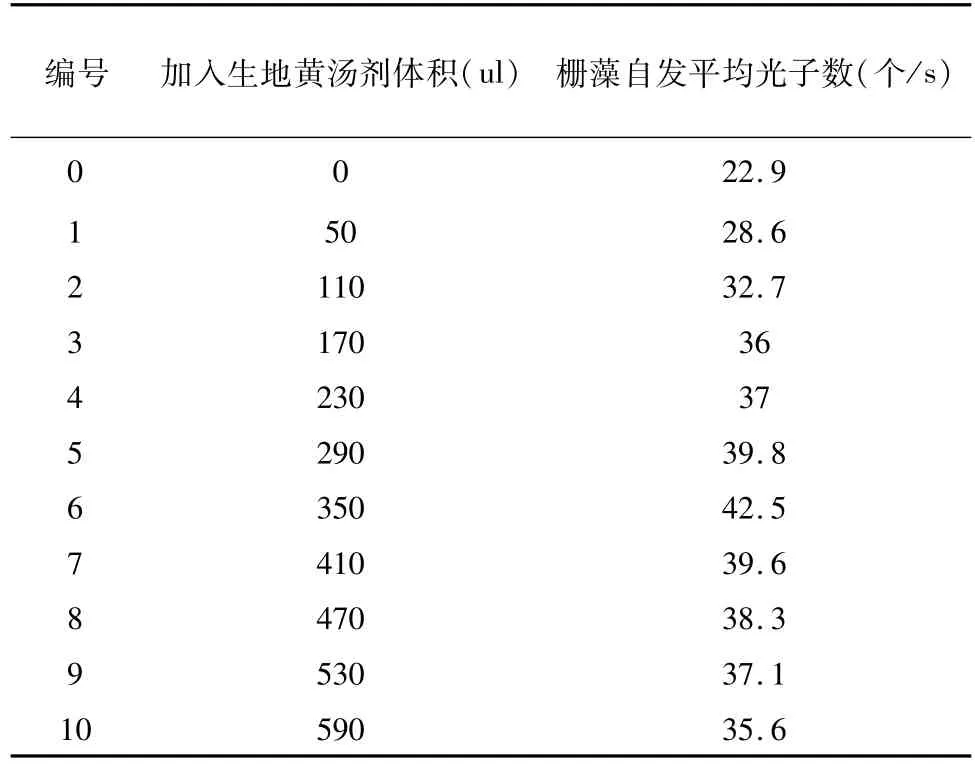
表1 不同體積的生地黃湯劑對應的柵藻的自發發光平均光子數Table 1 The average photon of spontaneous emission in different volume of the Radix Rehmannia Decoction corresponding Scenedesmus
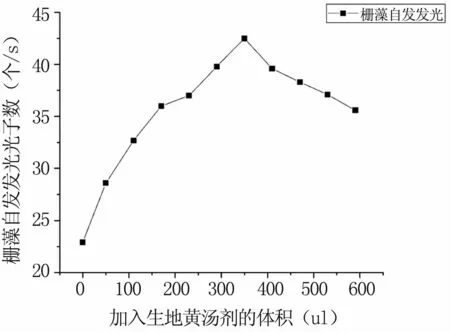
圖7 隨著生地黃湯劑體積增大的柵藻的自發發光平均強度Fig 7 With the volume increase of Radix Rehmannia Decoction,the average intensity of spontaneous luminescence of Scenedesmus

圖8 加入的生地黃體積(<=350ul)與柵藻自發發光平均強度的線性擬合Fig 8 Linear fitting between the volume(<=350ul)of Radix Rehmannia Decoction and the average intensity of spontaneous luminescence of Scenedesmus
3.4 加入不同體積生地黃湯劑對柵藻延遲發光的影響
圖9為柵藻延遲發光曲線的擬合,本文運用“顧參數”模型對柵藻的延遲發光進行分析,該參數的函數表達式為:I(t)=——(1),利用公式(1)對柵藻延遲發光曲線進行擬合,可以得出A、B、C三個參數,即顧參數,然后再根據公式 I(0)=A×csch2C——(2)算出柵藻延遲發光的初始強度,結果見表2(藻液自身的延遲發光實測/計算初始強度分別為33165,30965)。隨著生地黃湯劑體積的增加,實測初始強度和計算初始強度均是先增大后減小,最高值在350 ul處,說明中藥生地黃對柵藻的延遲發光具有明顯的影響。柵藻延遲發光呈雙曲線衰減規律,說明生物系統內的各個激發態分子之間是相互偶聯的,它們可能通過生物系統內存在的電磁場互相聯系,而這正是相干場的重要特征[9-10]。電磁輻射相干性:一部分自發的和光誘導的生物超弱發光的光子(量子),起源于生物系統內一個高度相干的電磁場,這種相干電磁場很可能是活組織內通訊聯絡的基礎[11-13],而恰恰可能是生物光子扮演著生物體內一種新型通訊信使的角色[14]。

圖9 柵藻的延遲發光曲線Fig 9 The Delay luminescence curve of the Scenedesmus
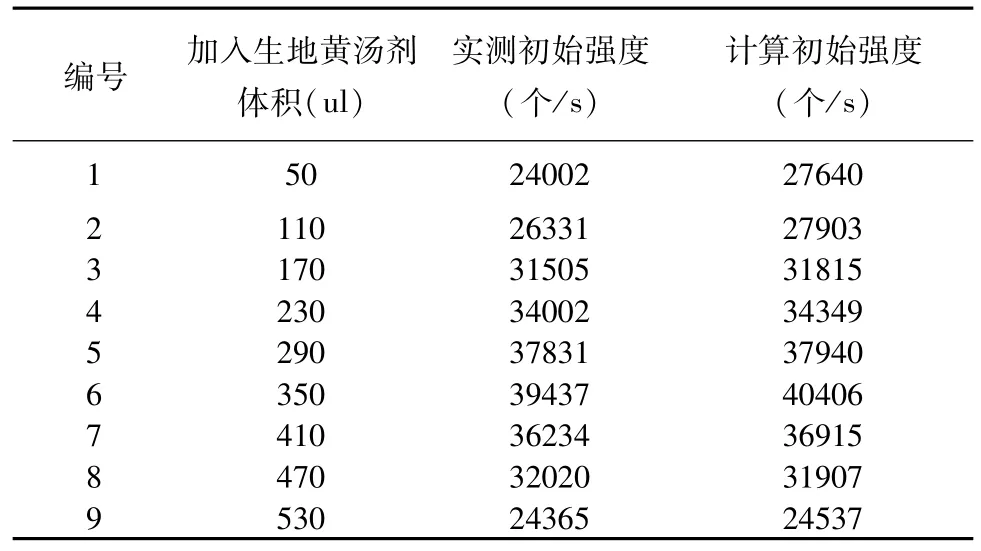
表2 不同體積的生地黃對應的柵藻的延遲發光初始強度Table 2 The initial intensity of delayed luminescence of Scenedesmus corresponding to different volumes of Radix Rehmannia Decoction
4 結論
(1)通過對儀器噪聲、生地黃湯劑與柵藻液生物光子輻射的對比分析,可以得出結論,生地黃湯劑自身并無生物光子輻射,這就排除了湯劑發光對實驗結果的影響。
(2)由BG11培養基與柵藻液的生物光子輻射的比較分析可知,培養基幾乎無發光,柵藻的生物光子輻射能力較強,其延遲發光的雙曲線規律為生物光子輻射的相干性理論提供了有力證據,這說明以柵藻作為指示劑具有可行性。
(3)根據實驗結果可以看出生地黃湯劑會對柵藻的生物光子輻射行為產生明顯的影響,其對柵藻自發發光平均強度與延遲發光初始強度的影響趨勢均表現為先增大后減小,發光強度的最高值在350 ul處。這說明中藥生地黃本身的固有性質(即藥性)會改變柵藻的生物學行為,從而表現為柵藻生物光子輻射行為的變化。前期本課題組基于生物光子相干理論提出中藥藥性量子假說[15],并認為利用生物光子檢測技術,通過檢測不同藥性中藥生物光子輻射行為的差異,可從整體上獲得表征中藥藥性的生物光子量化指標。柵藻作為一種常用的水質指示生物,它可以對其周圍液體環境所發生的變化做出靈敏的反應,本實驗研究結果顯示不同體積的中藥生地黃湯劑對柵藻生物發光行為影響不同,具體反映在柵藻生物光子輻射行為自發強度和延遲發光初始強度的變化上,這為后續利用柵藻生物光子輻射行為的差異來區分中藥藥性提供了實驗支持。
綜上所述,可以發現利用柵藻的生物光子輻射來區分中藥藥性具有較好的可行性。為柵藻作為中藥藥性的指示劑奠定了基礎。同時,也為將來相關課題的研究提供了依據。

