多模式鎮痛復合不同濃度羅哌卡因切口浸潤在加速康復外科術后鎮痛的效果
聶晗笑,張瑞芹
?
多模式鎮痛復合不同濃度羅哌卡因切口浸潤在加速康復外科術后鎮痛的效果
聶晗笑,張瑞芹*
目的探討在多模式鎮痛中復合不同濃度羅哌卡因切口浸潤在加速康復外科(ERAS)行開腹結直腸手術術后鎮痛的效果。方法選擇擇期加速康復外科開腹結直腸手術患者62例,隨機分為2組,每組31例。R1組:0.5%羅哌卡因20 mL術畢切口局部浸潤;R2組:0.375%羅哌卡因20 mL術畢切口局部浸潤。術后均行舒芬太尼靜脈自控鎮痛(PCIA)。分別觀察并記錄手術結束0、2、4、6、24、48 h各組靜息視覺模擬評分(VAS)、Prince-Henry疼痛評分;記錄術后首次追加舒芬太尼時間,術后6、24、48 h舒芬太尼消耗量及患者實際按壓PCIA泵次數;記錄患者術后首次排氣排便、離床活動時間及術后住院時長;記錄患者術后48 h內不良反應的發生情況。結果兩組患者的一般情況、手術時間、切口長度、手術方式及術中補液量比較,差異均無統計學意義。兩組術后各時間點VAS、Prince-Henry評分及不良反應發生情況比較,差異無統計學意義。R1組與R2組比較,首次追加舒芬太尼時間延長[(60.97±20.79)min vs.(37.74±33.14)min],6 h舒芬太尼消耗量減少[(16.80±1.74)μg vs.(21.62±2.62)μg],6 h鎮痛泵按壓次數減少[2(1~3)次vs.12(10~14)次];術后首次排氣排便時間提前[(21.47±2.45)h vs.(27.47±3.10)h],差異均有統計學意義(P<0.05)。結論在多模式鎮痛中復合0.5%羅哌卡因20 mL術畢切口局部浸潤,可為開腹行結直腸手術患者提供早期良好的術后鎮痛,同時減少術后早期PCIA舒芬太尼使用量,加速胃腸功能恢復。
加速康復外科;結直腸手術;羅哌卡因;切口浸潤;術后鎮痛
0 引言
優化術后鎮痛是加速康復外科(Enhanced recovery after surgery,ERAS)的必要組成部分,其可以促進早期離床活動及早期經口進食,以縮短住院時間,加速康復[1]。以阿片類藥物為基礎的鎮痛方式普遍用于緩解術后疼痛,但其會延遲術后胃腸道功能的恢復并增加術后惡心嘔吐等不良反應的發生。近年來,以非阿片類藥物為基礎的鎮痛方式逐漸被應用于加強術后鎮痛,減少阿片類藥物相關的不良反應[2]。切口局部浸潤即為一種有效的術后多模式鎮痛的補充方法[2-3]。本研究擬通過隨機、雙盲、對照的研究,比較不同濃度羅哌卡因切口浸潤對ERAS下行開腹結直腸手術患者術后疼痛的影響。
1 資料與方法
1.1一般資料經醫院倫理委員會同意,選擇擬行ERAS下開腹結直腸手術患者64例,ASA 分級Ⅰ~Ⅲ級,年齡20~70歲,體重50~75 kg,男39例,女25例,隨機分為2組。排除標準:對局麻藥物、阿片類藥物和NSAIDs過敏者;長期或術前24 h接受阿片類藥物、NSAIDs或已知鎮痛藥患者;肥胖患者(BMI>30 kg/m2);圍術期認知功能障礙者;精神疾病患者;慢性疼痛患者。所有手術和麻醉均由同一組外科醫師和麻醉醫師完成。所有患者術前熟悉VAS評分標準,了解PCIA鎮痛泵的使用方法。手術所執行的ERAS策略包括:術前宣傳教育;術前無常規機械性腸道準備;縮短術前禁食水時間及術前3 h補充富含碳水化合物的清亮液體;術前應用低分子量肝素;術前30 min應用抗菌藥物;標準化的麻醉及鎮痛方案;不使用鼻飼管;限制術中補液;術后早期下床活動及進食等。
1.2麻醉方法所有患者入手術室后,開放靜脈,常規監測SpO2、ECG、PETCO2、BP。麻醉誘導:咪達唑侖0.05 mg/kg,舒芬太尼0.3 μg/kg,利多卡因1~1.5 mg/kg,丙泊酚1.5~2 mg/kg,維庫溴銨0.1 mg/kg,依次靜脈注射,誘導后行氣管內插管。插管后追加舒芬太尼0.2 μg/kg。麻醉維持:瑞芬太尼10 μg/(kg·h)靜脈持續泵注;七氟烷,呼氣末肺泡濃度0.7 MAC;潮氣量6~8 mL/kg;新鮮氣流量2 L/min(O2∶Air=1∶1)。按血流動力學指標應用七氟烷和瑞芬太尼調整麻醉深度。術中管理:按晶體∶膠體=1∶1的比例補充液體,按4~6 mL/(kg·h)速度輸入,液體總量不超過1 000 mL。若因手術需要而補液量超過1 000 mL,則將該患者排除本研究。當收縮壓<90 mmHg或低于入室基礎血壓的20%時,靜脈注射麻黃堿6 mg。通過調節潮氣量及呼吸頻率維持PETCO2在30~35 mmHg。所有患者術畢清醒后拔除氣管內導管,送入麻醉恢復室觀察。
1.3鎮痛方法包括舒芬太尼患者靜脈自控鎮痛(Patient controlled intravenous analgesia,PCIA),羅哌卡因切口浸潤,氟比洛芬酯及曲馬多在內的術后多模式鎮痛:R1組患者于術畢0.5%羅哌卡因(100 mg/mL,AstraZeneca AB,瑞典,進口藥品注冊證號:H20100104)20 mL切口局部浸潤;R2組患者于術畢0.375%羅哌卡因20 mL切口局部浸潤。本研究為了達到隨機雙盲的目的,患者分組及藥品配置均由不參與研究設計及術后隨訪的麻醉醫生完成。
手術開始1 h后,兩組患者均靜脈給予氟比洛芬酯注射液100 mg(50 mg/5 mL,北京泰德制藥有限公司,國藥準字:H20041508),曲馬多注射液100 mg(100 mg/2 mL,進口藥品注冊證號:H20091073,德國格蘭泰有限公司)。兩組患者在術后均行舒芬太尼0.04 μg/(kg·h) (50 μg/mL,國藥準字:H20054171,宜昌人福藥業有限公司)容量150 mL靜脈自控鎮痛。PCIA泵標稱容量200 mL,標稱流量2 mL/h,標稱自控給液量0.5 mL,標稱自控給液再充裝時間15 min(型號:CB1+PCA,河南駝人醫療器械集團有限公司)。
主要的觀察指標包括手術結束即時、2、4、6、24、48 h各組VAS評分和Prince-Henry疼痛評分;患者術后首次追加舒芬太尼時間;患者在術后0、2、4、6、24、48 h舒芬太尼消耗量及患者實際按壓PCIA泵次數;患者術后首次排氣排便時間,首次離床活動時間及術后住院時間;記錄患者術后48 h內嗜睡、惡心嘔吐、尿潴留、呼吸抑制、皮膚瘙癢等不良反應的發生情況。
當患者VAS評分達到5分及5分以上時,患者自行按壓鎮痛泵。VAS評分:0分為完全不痛;1~2分偶有輕微疼痛;3~4分常有輕微疼痛;5~6分偶有明顯疼痛;7~8分常有明顯疼痛尚可忍受;9~10分疼痛難以忍受。Prince-Henry疼痛評分:0分為咳嗽時沒有痛感;1分為深呼吸時無痛感,但咳嗽時有痛感;2分為安靜時無痛感,但深呼吸時有痛感;3分為安靜時有輕微痛感;4分為安靜時有較強痛感。
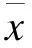
2 結果
64例結直腸手術患者符合本研究納入標準,R1組和R2組各有1例患者退出本研究。1例因術后1 d拒絕繼續應用鎮痛泵,1例因術畢即時腹腔內出血再次手術,因此,共有62例患者完成本研究。
2.1兩組患者一般資料和術中情況比較兩組患者性別比、年齡、ASA分級、體重、身高、手術時間、切口長度、手術方式比較差異無統計學意義(P>0.05)。見表1。

表1 兩組患者一般資料和術中情況比較(n=31)
2.2兩組患者術后VAS評分、Prince-Henry評分比較兩組患者各時間點VAS及Prince-Henry評分比較差異無統計學意義(P>0.05)。見表2。

表2 兩組患者術后VAS、Prince-Henry評分比較(n=31)
2.3兩組患者術后48 h內鎮痛泵使用情況比較兩組患者術后首次追加舒芬太尼時間,6 h舒芬太尼消耗量,6、24、48 h鎮痛泵累計按壓次數比較差異有統計學意義(P<0.05)。見表3。

表3 兩組患者術后鎮痛泵使用情況比較(n=31)
2.4兩組患者術后恢復情況比較兩組患者術后首次排氣排便時間比較差異有統計學意義(P<0.05)。見表4。
2.5兩組患者術后不良反應發生情況比較兩組患者術后不良反應的發生情況比較差異無統計學意義(P>0.05)。見表5。

表4 兩組患者術后恢復情況比較

表5 兩組患者術后不良反應發生情況比較(例)
4 討論
在大手術中最佳的術后鎮痛應滿足以下條件:良好的疼痛緩解;允許早期下床活動,早期腸功能恢復和進食;不引起并發癥[4]。術后鎮痛通過減輕機體對于應激的生理反應,減少術后發病率來提高術后恢復效果[5]。為特定的手術方式制定不同的多模式鎮痛方案應成為疼痛管理的標準規范,旨在以最小的不良反應獲得最佳的術后鎮痛效果,并且促進達到加速康復外科的重要目標,如術后早期活動和經口進食[6]。使用阿片類藥物可以有效緩解術后疼痛,因其不良反應呈劑量依賴性,多種以非阿片類藥物為基礎的鎮痛方式可用于減少阿片類藥物的使用量,減少阿片類藥物相關不良反應的發生,以此達到加速康復的目的。
就鎮痛效果而言,胸段硬膜外鎮痛被認為是開腹手術術后疼痛管理的金標準[7],但關于其是否能夠提高術后康復效果仍不明確。一項多中心隨機對照研究沒能證明其對患者術后發病率及死亡率方面有益[8],而一項近期的薈萃分析則表明,與全身麻醉相比,硬膜外鎮痛與術后死亡率減少有關[9]。與腸外應用阿片類藥物相比,硬膜外阻滯可以在術后72 h內提供有效的靜態及動態鎮痛[10],加速胃腸功能恢復[11-12]。但是,低血壓、尿潴留、瘙癢和運動阻滯是其常見的不良反應。蛛網膜下腔嗎啡鎮痛能提高早期術后鎮痛[13]并促進術后恢復[14],但其增加了瘙癢及呼吸抑制的發生率,使術后尿潴留更加頻繁[13]。由于利多卡因鎮痛與抗炎的特性,利多卡因靜脈持續注射可作為阿片類全身給藥的輔助鎮痛,能提高術后鎮痛效果,減少阿片類藥物的消耗,促進康復[15-16]。但在腹腔鏡結腸手術中,與胸段硬膜外鎮痛相比,其效果并不明顯[17]。在開腹手術中,局麻藥物切口持續浸潤同樣可以加強鎮痛,減少阿片類藥物消耗,但其對于腸道功能的恢復是否有益處仍無確切結論[18],并且仍然需要阿片類全身給藥來緩解內臟疼痛。經超聲引導的腹橫肌平面阻滯單次給藥,可以顯著減少術后疼痛強度及阿片類藥物消耗量,但其作用僅限于術后24 h內[19]。通過在腹橫肌平面放置的帶孔導管持續或間斷給藥可延長其鎮痛效果至24~48 h,但其鎮痛效果仍然缺乏證據支持[20-21]。
以非甾體類抗炎藥為基礎的多模式術后鎮痛應在腹部手術中常規應用,旨在減少阿片類藥物消耗及其劑量依賴性影響術后恢復的不良反應[22]。本研究使用的鎮痛方式為包含舒芬太尼PCIA、羅哌卡因切口浸潤、氟比洛芬酯及曲馬多在內的多模式鎮痛。本研究術后各時間點的VAS及Prince-Henry評分差異無統計學意義,且鎮痛效果達到了預期目標,而術后6 h內R1組的舒芬太尼消耗量顯著少于R2組,說明上述鎮痛方法可以達到滿意的鎮痛效果;相比于低濃度羅哌卡因,高濃度羅哌卡因切口局部浸潤可以減少術后6 h內舒芬太尼使用量。羅哌卡因是單一對映結構體長效酰胺類局麻藥,其作用機制與其他局部麻醉藥物相同,通過阻滯神經細胞膜上的Na+內流發揮局部麻醉作用;其心臟毒性弱于布比卡因[23-25]。羅哌卡因區域阻滯的起效時間為1~15 min,持續時間為2~6 h,因此,本研究中術后6 h舒芬太尼消耗量顯著不同,而其他時間點的舒芬太尼消耗量差異無統計學意義。另外,本研究中6 h內PCIA累計按壓次數R1組顯著小于R2組,而6~24 h、24~48 h兩時間段的按壓次數差異無統計學意義,表明高濃度羅哌卡因局部浸潤能夠減少早期術后PCIA舒芬太尼消耗量,起到了舒芬太尼的節儉作用。另外,R1組的術后首次排氣時間顯著短于R2組,可能是高濃度羅哌卡因浸潤通過減少術后舒芬太尼的使用,加速術后腸道功能的恢復。但是兩組之間與阿片類藥物呈劑量相關的不良反應發生率沒有顯著區別,可能與高濃度羅哌卡因局部浸潤的舒芬太尼節儉作用所減少舒芬太尼消耗量仍不足以對阿片類藥物劑量相關不良反應產生影響有關。
本研究的不足之處在于,由于羅哌卡因切口浸潤確實能提供良好的術后鎮痛[26],出于人文關懷,本研究沒有設置空白對照組;麻醉誘導時,所有患者均靜脈注射利多卡因用于減少丙泊酚注射痛,預防惡性心律失常的發生,而靜脈注射利多卡因有一定的術后鎮痛作用,其與羅哌卡因同為酰胺類局麻藥物,本研究沒能排除其可能對研究結果產生的影響。
綜上所述,在多模式鎮痛中復合0.5%羅哌卡因20 mL術畢切口局部浸潤,可為開腹行結直腸手術患者提供早期良好的術后鎮痛,同時減少術后早期PCIA舒芬太尼使用量,加速胃腸功能恢復。
[1]White PF,Kehlet H,Neal JM,et al.The role of the anesthesiologist in fast-track surgery:from multimodal analgesia to perioperative medical care[J].Anesth Analg,2007,104(6):1380-1396.
[2]Kehlet H,Dahl J.Anaesthesia,surgery,and challenges in postoperative recovery[J].Lancet,2003,362(9399):1921-1928.
[3]White P.The changing role of non-opioid analgesic techniques in the management of postoperative pain[J].Anesth Analg,2005,101(5 Suppl):S5-S22.
[4]Veenhof AA,Vlug MS,Van der Pas MH,et al.Surgical stress response and postoperative immune function after laparoscopy or open surgery with fast track or standard perioperative care:a randomized trial[J].Ann Surg,2012,255(2):216-221.
[5]Kehlet H,Holte K.Effect of postoperative analgesia on surgical outcome[J].Br J Anaesth,2001,87(1):62-72.
[6]Feldheiser A,Aziz O,Baldini G,et al.Enhanced Recovery After Surgery (ERAS) for gastrointestinal surgery,part 2:consensus statement for anaesthesia practice[J].Acta Anaesthesiol Scand,2016,60(3):289-334.
[7]Wu CL,Cohen SR,Richman JM,et al.Efficacy of postoperative patient-controlled and continuous infusion epidural analgesia versus intravenous patient-controlled analgesia with opioids:a meta-analysis[J].Anesthesiology,2005,103(5):1079-1088,quiz 109-110.
[8]Rigg JR,Jamrozik K,Myles PS,et al.Epidural anaesthesia and analgesia and outcome of major surgery:a randomised trial[J].Lancet,2002,359(9314):1276-1282.
[9]Popping DM,Elia N,Van Aken HK,et al.Impact of epidural analgesia on mortality and morbidity after surgery:systematic review and meta-analysis of randomized controlled trials[J].Ann Surg,2014,259(6):1056-1067.
[10]Werawatganon T,Charuluxanun S.Patient controlled intravenous opioid analgesia versus continuous epidural analgesia for pain after intra-abdominal surgery[J].Cochrane Database Syst Rev,2005,(1):CD004088.
[11]Khan SA,Khokhar HA,Nasr AR,et al.Effect of epidural analgesia on bowel function in laparoscopic colorectal surgery:a systematic review and meta-analysis[J].Surg Endosc,2013,27(7):2581-2591.
[12]Shi WZ,Miao YL,Yakoob MY,et al.Recovery of gastrointestinal function with thoracic epidural vs.systemic analgesia following gastrointestinal surgery[J].Acta Anaesthesiol Scand,2014,58(8):923-932.
[13]Meylan N,Elia N,Lysakowski C,et al.Benefit and risk of intrathecal morphine without local anaesthetic in patients undergoing major surgery:meta-analysis of randomized trials[J].Br J Anaesth,2009,102(2):156-167.
[14]Levy BF,Scott MJ,Fawcett WJ,et al.Optimizing patient outcomes in laparoscopic surgery[J].Colorectal Dis,2011,13(Suppl 7):8-11.
[15]Marret E,Rolin M,Beaussier M,et al.Meta-analysis of intravenous lidocaine and postoperative recovery after abdominal surgery[J].Br J Surg,2008,95(11):1331-1338.
[16]Vigneault L,Turgeon AF,Cote D,et al.Perioperative intravenous lidocaine infusion for postoperative pain control:a metaanalysis of randomized controlled trials[J].Can J Anaesth,2011,58(1):22-37.
[17]Wongyingsinn M,Baldini G,Charlebois P,et al.Intravenous lidocaine versus thoracic epidural analgesia:a randomized controlled trial in patients undergoing laparoscopic colorectal surgery using an enhanced recovery program[J].Reg Anesth Pain Med,2011,36(3):241-248.
[18]Karthikesalingam A,Walsh SR,Markar SR,et al.Continuous wound infusion of local anaesthetic agents following colorectal surgery:systematic review and meta-analysis[J].World J Gastroenterol,2008,14(34):5301-5305.
[19]Siddiqui MR,Sajid MS,Uncles DR,et al.A meta-analysis on the clinical effectiveness of transversus abdominis plane block[J].J Clin Anesth,2011,23(1):7-14.
[20]Kadam RV,Field JB.Ultrasound-guided continuous transverse abdominis plane block for abdominal surgery[J].J Anaesthesiol Clin Pharmacol,2011,27(3):333-336.
[21]Bjerregaard N,Nikolajsen L,Bendtsen TF,et al.Transversus abdominis plane catheter bolus analgesia after major abdominal surgery[J].Anesthesiol Res Pract,2012:596536.
[22]Wu CL,Rowlingson AJ,Partin AW,et al.Correlation of postoperative pain to quality of recovery in the immediate postoperative period[J].Reg Anesth Pain Med,2005,30(6):516-622.
[23]趙忠瑋,羅哌卡因、亞甲藍及地塞米松混合液用于混合痔術后鎮痛的療效觀察[J].沈陽醫學院學報,2015,17(4):220-221.
[24]戴體俊,喻田.麻醉藥理學[M].第3版.北京:人民衛生出版社,2011:96-104.
[25]曹建平,朱靜.芬太尼對利多卡因聯合甲磺酸羅哌卡因在腋路臂叢神經阻滯起效中的作用[J].沈陽醫學院學報,2014,16(2):91-92.
[26]Huntington CR,Wormer BA,Cox TC,et al.Local anesthesia in open inguinal hernia repair improves postoperative quality of life compared to general anesthesia:a prospective,international study[J].Am Surg,2015,81(7):704-709.
Effect of postoperative analgesia with different concentration of ropivacaine used in wound infiltration in a multimodal analgesia regimen in enhanced recovery after surgery
NIE Han-xiao,ZHANG Rui-qin*
(Department of Anesthesiology,the Second Affiliated Hospital of Harbin Medical University,Harbin 150086,China)
ObjectiveTo explore the analgesic efficacy of different concentration of ropivacaine used in wound infiltration in open colorectal surgery in the context of enhanced recovery after surgery (ERAS).MethodsTotally 62 patients underwent open colorectal surgery in the context of ERAS were randomly divided into 2 groups,31 patients in each group.Group R1
wound infiltration of 0.5% ropivacaine 20 mL at the end of the surgery,and group R2received wound infiltration of 0.375% ropivacaine 20 mL at the end of the surgery.All patients received sufentanil as patient controlled intravenous analgesia (PCIA) after surgery.VAS score and Prince-Henry score at the end of and 2,4,6,24 and 48 h after the surgery,the time to first additional sufentanil,the consumption of sufentanil and press times of the PCIA pump at 6,24 and 48 h after surgery,the time to first flatus or defecation and mobilization,length of stay in hospital after surgery,and adverse events with in 48 h were recorded.ResultsThe patients′ characteristics,surgery time,length of incision,operation method,volume of fluid input and ASA physical status distribution were comparable in the two groups.No obvious difference in VAS score,Prince-Henry score or side effects was noted between the two groups.Compared with group R2,the time to first additional sufentanil in group R1was longer:(60.97±20.79)min vs.(37.74±33.14)min;the consumption of sufentanil in group R1at 6 h was reduced:(16.80±1.74)μg vs.(21.62±2.62)μg;the press times of PCIA pump at 6 h in group R1were reduced:[2(1~3)] vs.[12(10~14)];time to first flatus of defecation was shorter in group R1:(21.47±2.45)h vs.(27.47±3.10)h.All of the differences were statistically significant (P<0.05).ConclusionWound infiltration of 0.5% ropivacaine 20 mL can provide an adequate early postoperative analgesia,reduce the consumption of sufentanil in PCIA,and accelerate the recovery of bowel function in patients undergoing open colorectal surgery.
Enhanced recovery after surgery (ERAS);Colorectal surgery;Ropivacaine;Wound infiltration;Postoperative analgesia
2016-01-11
哈爾濱醫科大學附屬第二醫院麻醉科,黑龍江省麻醉與危重病研究重點實驗室,黑龍江省高校麻醉基礎理論與應用研究重點實驗室,哈爾濱 150086
10.14053/j.cnki.ppcr.201609016

