結締組織生長因子對大鼠血管外膜成纖維細胞增殖作用的影響
李 軍,羅麗敏,董 曉,徐 霞,路 丹,彭 芬,黨書毅*
?
結締組織生長因子對大鼠血管外膜成纖維細胞增殖作用的影響
李軍1,4,羅麗敏2,董曉1,徐霞3,路丹4,彭芬4,黨書毅1*
目的研究血管活性因子結締組織生長因子(Connective tissue growth factor,CTGF)對大鼠血管外膜成纖維細胞(Adventitial fibroblasts,AFs)增殖作用的影響和細胞內信號轉導機制。方法離體培養AFs并作鑒定,采用CCK-8技術確定CTGF促AFs增殖作用的效應濃度,在CTGF效應濃度下加入不同的細胞內信號轉導阻斷劑,觀察哪種信號通路參與CTGF促AFs的增殖效應。結果采用組織貼塊法可以培養出AFs,經免疫熒光檢測培養的細胞為AFs,CTGF以濃度依賴方式促進AFs增殖,CTGF促AFs增殖的效應能被Rho激酶阻斷劑Y-27632、鈣調神經磷酸酶(Calcineurin,CaN)阻斷劑環孢菌素A(Cyclosporine A,CSA)和鈣通道阻斷劑尼卡地平所阻斷。結論貼塊法能成功培養出AFs;CTGF是可以促進AFs增殖的趨化因子,其促進增殖效應可能通過CaN、Rho以及Ca2+通路來介導。
結締組織生長因子;細胞增殖;CCK-8;信號轉導
0 引言
血管外膜在血管重構的發生、發展過程中起到了重要的作用,是多種心血管疾病發病的結構基礎,針對血管外膜的研究是當前心血管領域研究熱點之一[1]。血管外膜成纖維細胞(Adventitial fibroblasts,AFs)是血管外膜的主要組成部分,其在體內血管活性物質作用下,通過分泌活性因子,參與細胞表型轉化、增殖、凋亡、遷移及膠原的合成和分泌,從而參與血管的功能調節和修復過程[2]。AFs已成為治療心血管疾病的新靶點。結締組織生長因子(Connective tissue growth factor,CTGF)是一種生物學效應廣泛的血管活性物質,能促進血管生成、細胞趨化及誘導細胞外基質生成[3],但CTGF對血管外膜介導的血管重構是否起作用,能否促進AFs增殖及其相應機制目前知之甚少。本實驗在體外培養的AFs上,采用CCK-8等技術手段,以觀察CTGF對AFs增殖作用的影響,并初步探討其相應的細胞內信號轉導機制。
1 材料與方法
1.1主要試劑DMEM/F12培養基購自Gibco公司;胎牛血清購自Hyclone公司;免疫組化用小鼠抗大鼠α-SMA(α-平滑肌肌動蛋白,α-smooth muscle actin)和Vimentin單克隆抗體購自武漢博士德公司,CCK-8試劑盒購自碧云天生物科技公司;CTGF為美國Prospec公司產品;Y-27632、CSA、Nicardipine、H-7和PD98059等信號通路阻斷劑為biochemical公司產品,其余為市售分析純試劑。
1.2血管外膜成纖維細胞的原代培養和消化傳代取雄性SD大鼠,斷頸處死后立刻浸泡于75%酒精中5 min,開胸取胸主動脈,無菌條件下轉移至超凈工作臺。用眼科剪將血管縱向剖開,使內膜面向上,用眼科彎鑷自上而下輕輕刮除內膜后,再小心撕下近內膜面的中膜平滑肌層,剩余的絮狀乳白色組織即為血管外膜。將其轉移入含有20%胎牛血清的DMEM/12培養基中,剪成約1 mm3小塊,吸除多余的培養基,使用滅菌巴氏吸管將小塊吸出,并均勻平鋪在25 cm2培養瓶的底部。輕輕翻轉培養瓶使瓶底向上,向培養瓶中加入約6 mL含20% FBS的DMEM/F12培養基。將培養瓶置入37 ℃、含5% CO2細胞培養箱中直立靜置2 h后,慢慢翻轉培養瓶,使培養液緩慢覆蓋組織塊,并防止組織塊漂落在培養基中,繼續置于培養箱中培養,約72 h后,可見AFs自組織塊周圍爬出。此時,向培養瓶中補加3 mL含20% FBS的DMEM/F12培養基,以保證細胞生長所需的養分。2~3 d后,待細胞達70%~80%融合狀態時,即可按1∶4傳代。取2~3代細胞進一步實驗。
1.3外膜成纖維細胞的鑒定將AFs傳至24孔板中,待細胞生長至50%融合狀態時,倒掉培養液,使用PBS沖洗3遍,4%多聚甲醛固定20 min,PBS沖洗3 min×3次,用含0.3% Triton X-100、1%BSA的PBS透化處理10 min,PBS沖洗3 min×3次,加封閉血清室溫封閉60 min后,倒掉封閉血清,加小鼠抗大鼠α-SM-actin抗體及波形蛋白Vimentin抗體,37 ℃孵育2 h,PBS沖洗3 min×3次,滴加FITC標記的山羊抗小鼠,避光孵育60 min,倒置熒光顯微鏡下觀察結果,拍片。
1.4CCK-8試劑盒檢測細胞增殖取處于對數生長期、生長狀態良好的AFs,用含10% FBS的DMEM/12培養基調整細胞密度至5×103個/100 μL,接入96孔板,每孔100 μL細胞懸液,同時設空白組,37 ℃培養過夜(在細胞孔周圍孔內加入100 μL無菌PBS);根據不同分組和細胞處理設置分別處理細胞,每組5個復孔,37 ℃培養24 h后,每孔加入10 μL CCK-8,37 ℃培養4 h,酶標儀測定各孔吸光值(OD450)。
1.5實驗設計和分組
1.5.1不同濃度CTGF對AFs增殖的影響實驗分為6組:1組為對照組,不加CTGF;2~6組為不同濃度的CTGF組(CTGF 1、2、5、10、20 ng/mL)。
1.5.2不同信號途徑阻斷劑對CTGF效應的影響實驗分為5組:①對照組:僅加不含血清的DMEM/F12培養基;②CTGF組:只加CTGF,濃度為10 ng/mL,下同;③CTGF+尼卡地平(Nicardipine,10-6mol/L)組;④CTGF+環孢菌素(CSA,10-5mol/L)組;⑤CTGF+PD98059(10-5mol/L)組;⑥CTGF+Y-27632(10-5mol/L)組;⑦CTGF+H-7(10-5mol/L)組。
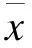
2 結果
2.1AFs的原代培養血管外膜組織塊在含20% FBS的DMEM/F12培養基中培養72 h后,可見梭型的AFs自組織塊周圍爬出(圖1)。為避免溫度、pH值等變化對細胞生長的影響,暫不換液,僅向培養瓶中補加3 mL新鮮培養基,以保證細胞生長所需的養分。約2~4 d后,細胞可達亞融合狀態(圖2)。
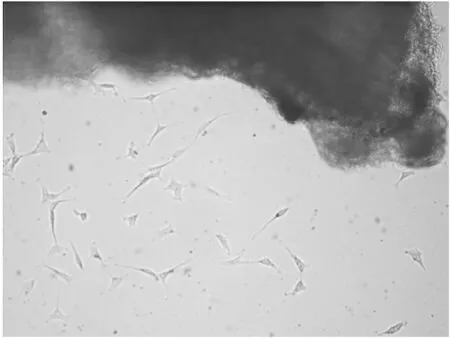
圖1 AFs原代培養(100×)
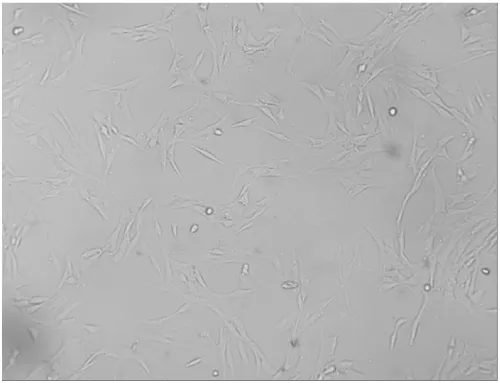
圖2 AFs亞融合狀態(100×)
2.2AFs的鑒定在24孔板中,待AFs長至50%融合狀態時,固定細胞,加入α-SM-actin抗體及波形蛋白Vimentin一抗抗體孵育后,再滴加FITC標記的二抗,倒置熒光顯微鏡下觀察、拍片。可見α-SM-actin在AFs中基本沒有表達(圖3A),而vimentin在AFs中高表達(圖3B),證實培養的細胞為AFs。
圖3 AFs免疫組化鑒定(200×)
2.3不同濃度CTGF對AFs增殖的影響(n=5)使用不同濃度的CTGF(0、1、2、5、10、20 ng/mL)刺激AFs 24 h后,CTGF以濃度依賴方式刺激AFs增殖。與對照組相比,在5 ng/mL濃度時,CTGF促AFs的增殖效應具有統計學意義(P<0.05),在10 ng/mL的濃度時,促增殖作用達到最大效應(P<0.05)。見圖4。
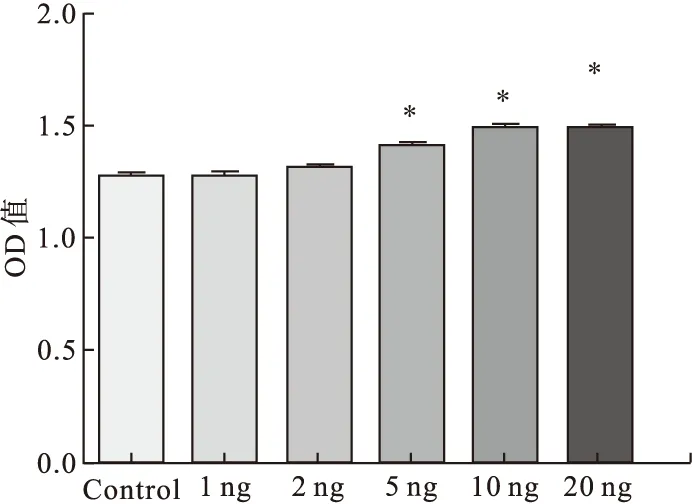
圖4 CTGF促AFs增殖效應的濃度曲線(n=5)
2.4不同信號通路阻斷劑對CTGF刺激AFs增殖的影響(n=5)使用CTGF(10 ng/mL)刺激AFs 24 h,同時加入不同信號通路阻斷劑與CTGF(10 ng/mL)共培養,結果發現,CTGF促AFs的增殖作用與對照組比較差異有統計學意義(P<0.05);與CTGF組相比,CTGF+Y-27632組、CTGF+CSA組和CTGF+Nicardipine組的OD值明顯降低,差異有統計學意義(P<0.05),提示CTGF促AFs增殖效應能夠被Y-27632、CSA和Nicardipine所抑制。CTGF+PD98059、CTGF+H-7組與CTGF組相比差異無統計學意義,說明CTGF促AFs增殖效應與PD98059和H-7無關。見圖5。
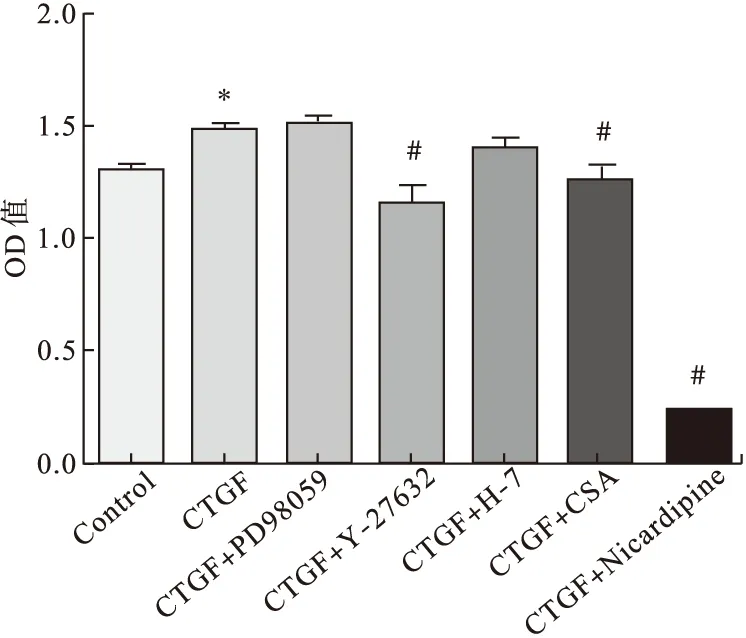
圖5 CTGF促AFs增殖的相關信號通路(n=5)
3 討論
血管壁由內膜、中膜和外膜組成,血管內膜和中膜在心血管系統疾病中的作用已經被充分證實,而血管外膜過去長期被認為只起到營養中膜以及血管支持作用。但越來越多的證據表明,血管外膜不僅僅是血管壁的一層支持結構,還可以通過和血管壁其他成分復雜的交互效應來發揮作用,是高血壓、動脈粥樣硬化、血管再狹窄等血管重構性疾病的病變起始部位[4]。
AFs是血管外膜的主要成分,AFs在多種作用機制下增殖、遷移、活化,發生表型轉化,細胞內持續表達α-SMA,轉化成肌成纖維細胞(Myofibroblast,MFB)[5]。MFB具有較強的分泌功能和收縮特性,分泌大量炎癥介質和生長因子,參與血管的功能調節和修復過程。該過程受多種肽類活性因子的調控,但其具體機制尚未完全闡明。我們前期的研究發現,尾加壓素Ⅱ(UrotensinⅡ,UⅡ)可以濃度依賴方式促進AFs表達α-SMA,向肌成纖維細胞表形轉化,并促進成纖維細胞分泌Ⅰ型膠原及細胞遷移。這些作用可以通過促有絲分裂蛋白激酶MAPK、鈣調神經磷酸酶、Rho以及PKC、鈣通道等途徑來實現[6]。CTGF作為一種效應廣泛的血管活性肽,在離體培養的AFs上是否具有促增殖作用,以及通過何種信號通路起作用是本研究的重點。
CTGF于1988年首先在小鼠實驗研究中被發現[7],此后在篩選人臍靜脈血管內皮細胞cDNA文庫時分離得到[8],可由成纖維細胞、血管內皮細胞、平滑肌細胞、多能干細胞及某些腫瘤細胞分泌合成[9],廣泛表達于心臟、肝、腎臟等多種組織和器官。CTGF的生物學效應廣泛,能刺激細胞增殖和凋亡、遷移和分化[9-11];而CTGF在血管外膜中的作用機制目前尚不明確。
本研究在體外培養的AFs中,發現CTGF以濃度依賴性的方式促進AFs增殖,CTGF促AFs增殖的效應能被Rho激酶阻斷劑Y-27632、鈣調神經磷酸酶(Calcineurin,CaN)阻斷劑環孢菌素A(CyclosporineA,CSA)和鈣通道阻斷劑尼卡地平所阻斷。提示CTGF具有促進AFs增殖作用,該作用可能通過Ca2+、CaN以及Rho激酶等多條途徑來實現。而PD98059和H-7兩種通路抑制劑,對CTGF的促增殖作用沒有影響,提示MAPK和PKC兩條通路未參與到CTGF的促增殖效應中。
AFs活性增加,表型轉化,發生增殖反應是血管重構的重要環節,在高血壓、冠心病以及血管損傷后再狹窄的發生發展過程中具有十分重要的意義,因此,CTGF對AFs的這種促增殖效應高度重視。本試驗提示,CTGF可以誘導AFs增殖,并且與Ca2+、CaN以及Rho激酶等通路相關,提示CTGF是一種新的AFs活性刺激劑,可通過旁分泌方式來實現與其他生物活性因子之間的調節過程。由于生物活性物質之間的調控網絡是機體維持血管自穩態的重要物質基礎,而CTGF在血管重構性疾病中對AFs的調控作用在心血管疾病的發生、發展及恢復過程中具有重要作用,提示CTGF也可以作為心血管疾病治療的新靶點。
本研究的局限性為僅僅從旁分泌的角度進行了CTGF功能的初步探討,且受實驗條件的限制,未對Ca2+、CaN以及Rho激酶調控的下游環節進行研究。對于CTGF對AFs效應各通路間的相互關系、主要途徑的Cross-Talking尚待進一步深入研究。
[1] 孫瑞娟,朱毅,汪南平,等.血管病變機制與血管功能調控研究的現狀與趨勢[J].中國科學:生命科學,2013,(2):103-111.
[2]Coen M,Gabbiani G,Bochaton-Piallat ML.Myofibroblast-mediated adventitial remodeling:an underestimated player in arterial pathology[J].Arterioscler Thromb Vasc Biol,2011,31(11):2391-2396.
[3]Dalm V,Dik WA,Thio HB,et al.Fibrosing disorders:insights into pathogenesis and new treatment options[J].Ned Tijdschr Geneeskd,2015,159:A8345.
[4]李軍,丁文惠,唐朝樞.血管外膜與血管穩態和重構[J].中國循環雜志,2016,(1):101-103.
[5]羅麗敏,李軍,劉菡,等.尾加壓素Ⅱ對皮膚成纖維細胞表達Ⅰ型膠原蛋白的影響[J].中華皮膚科雜志,2014,47(8):566-569.
[6]Zhang YG,Li J,Li YG,et al.Urotensin II induces phenotypic differentiation,migration,and collagen synthesis of adventitial fibroblasts from rat aorta[J].J Hypertens,2008,26(6):1119-1126.
[7]Almendral JM,Sommer D,Macdonald-Bravo H,et al.Complexity of the early genetic response to growth factors in mouse fibroblasts[J].Mol Cell Biol,1988,8(5):2140-2148.
[8]Bradham DM,Igarashi A,Potter RL,et al.Connective tissue growth factor:a cysteine-rich mitogen secreted by human vascular endothelial cells is related to the SRC-induced immediate early gene product CEF-10[J].J Cell Biol,1991,114(6):1285-1294.
[9]Aguiar DP,De Farias GC,De Sousa EB,et al.New strategy to control cell migration and metastasis regulated by CCN2/CTGF[J].Cancer Cell Int,2014,14:61.
[10]Yang Z,Sun Z,Liu H,et al.Connective tissue growth factor stimulates the proliferation,migration and differentiation of lung fibroblasts during paraquat-induced pulmonary fibrosis[J].Mol Med Rep,2015,12(1):1091-1097.
[11]Chang CC,Lin BR,Wu TS,et al.Input of microenvironmental regulation on colorectal cancer:role of the CCN family[J].World J Gastroenterol,2014,20(22):6826-6831.
Effect of CTGF on proliferation of rat adventitial fibroblasts
LI Jun1,4,LUO Li-min2,DONG Xiao1,XU Xia3,LU Dan4,PENG Fen4,DANG Shu-yi1*
(1.Department of Cardiology,Shiyan Taihe Hospital,Hubei University of Medicine,Shiyan 442000,China;2.Department of Dermatology,the First Hospital of China Medical University,Shenyang 110001,China;3.2013 Undergraduate Class of Pharmacy College,Hubei University of Medicine,Shiyan 442000,China;4.Department of Cardiology,the First Hospital of Peking University,Beijing 100034,China)
Objective To study the effect of vasoactive connective tissue growth factor (CTGF) on adventitial fibroblasts (AFs) proliferation and explore the mechanism of signal transduction.MethodsAFsinvitrowere cultured and cellular components were identified;CCK-8 technology was used to observe the effect of CTGF on proliferation of AFs;different intracellular signal transduction inhibitors were added to observe which signaling pathways involved in the proliferation effect of CTGF on AFs.ResultsThe cells cultured by explant patch method were identified as AFs by immunofluorescence assay.CTGF promoted AFs proliferation in a concentration dependent manner.CTGF′s promoting effect on the proliferation of AFS could be blocked by Rho kinase blocking agent Y-27632,calcineurin blocking agent cyclosporine A (CSA) and calcium channel blocker nicardipine.ConclusionAFs can be successfully cultured by the explant patch method,and CTGF can promote the proliferation of AFs,which may promote the proliferation effect through CaN,Rho and Ca2+pathway.
Connective tissue growth factor;Proliferation;CCK-8;Signal transduction
2016-03-18
1.湖北醫藥學院附屬太和醫院心內科,湖北 十堰 442000;2.中國醫科大學附屬第一醫院皮膚科,沈陽 110001;3.湖北醫藥學院藥學院2013級本科班,湖北 十堰 442000;4.北京大學第一醫院心內科,北京 100034
湖北省科技廳項目(2011CDC049);十堰市科技局研究項目(14Y17);十堰市太和醫院國家自然科學基金培育項目(2014PY03)
10.14053/j.cnki.ppcr.201609004

