經得起驗證——化學數據的應然追求
摘要:用化學理論對兩個實驗設計、兩道化學試題中的數據進行分析,發現它們都經不起實踐的檢驗。并分析了數據錯誤產生的原因,提出應多收集數據,多使用數據來分析化學問題,來幫助自己提高對錯誤數據的敏感性,以避免在教學中使用錯誤數據。
關鍵詞:化學數據;科學性;化學教學
文章編號:1005–6629(2016)9–0032–03 中圖分類號:G633.8 文獻標識碼:B
化學教學中經常會涉及一些數據。有時是為了要求學生從量的方面認識物質及其變化的規律,圍繞數據展開定量計算[1]。有時是為了更便捷、直觀地表述化學命題。有時是創設教學或試題情境的需要。這些數據可以來源于教材或其他文獻,也可以是來源于科研論文、實驗測量或實際生產[2]。總之,教學中的數據應該是真實可信的,應該是客觀、真實和經得起實踐與理論的檢驗的。可筆者在教學中卻發現部分材料中提供的數據違背了客觀實際,失去了可驗證性。列舉幾例,希望大家能關注化學材料中的數據問題。
1 實驗設計中存在的數據問題
案例1 利用NaHCO3與鹽酸反應來比較反應速率的數據問題
蘇教版《化學反應原理》中曾有如下實驗設計[3]:在兩個大小相同的氣球中各放入2.0g碳酸氫鈉粉末。取兩只同樣大小的錐形瓶,向其中一只錐形瓶中加入50mL 1.0 mol·L-1鹽酸,向另一只錐形瓶中加入50mL 0.1 mol·L-1鹽酸。然后在錐形瓶瓶口套上上述兩個氣球,同時將氣球中的碳酸氫鈉粉末加入到錐形瓶中,觀察并比較氣球膨脹的快慢。
仔細推敲后發現,這個實驗設計中提供的數據不科學。2.0g NaHCO3完全反應需要0.1 mol·L-1鹽酸的體積V=(2÷84)÷0.1×1000=238mL。由于0.1 mol·L-1鹽酸用量嚴重不足,導致實驗結論失去了說服力。
所幸教材編者已發現這個不足,在后期版本中修正了上述數據。可有教師雖然發現了這處修改,卻并不明白為什么要修改。
案例2 NaCl、NaHCO3溶解性比較中的數據設置問題
偶然機會接觸到為小學《科學》教材配套的《科學實驗活動練習冊》,其中有“比較食鹽和小蘇打在水中的溶解能力”實驗[4]:把30克食鹽平均分成六份,先取一小份放到20毫升水中,用玻璃棒充分攪拌;等食鹽完全溶解后,再加入第二份食鹽,繼續攪拌;完全溶解后,再加第三份食鹽……直到食鹽不能再溶解為止。記錄20毫升水中共溶解了幾份食鹽。用與剛才同樣的方法,將小蘇打一份一份地放入水中溶解。記錄20毫升水中共溶解了幾份小蘇打。
這個實驗設計應是出自我們化學人之手,它反映了我們只重原理,不重數據的現實。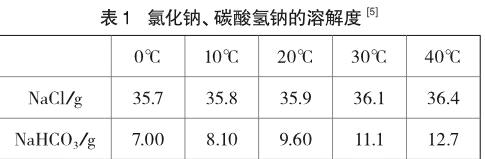
按40℃計算,20毫升水能溶解7.3g NaCl或2.5g NaHCO3。“30克”藥品遠遠超出了實驗的需要,造成藥品浪費,增加了實驗成本。
本實驗只是要證明NaCl的溶解性比NaHCO3大,從節約藥品且為實驗操作留有余地考慮,可修改為“稱量4克藥品分成四份……直到四份全部加入為止”。根據“4份NaCl可全溶,而NaHCO3卻不能”的實驗現象即可得出所需結論。
2 化學試題中存在的數據問題
在教學中發現,化學試題是數據出現科學性問題的“重災區”。可見,篩選習題時要關注試題數據的科學性問題,特別是一些次要數據或輔助性數據。
案例3 不存在pH=1的醋酸或pH=13的氨水
筆者所在地區的高二期末調研考試的試卷中,有這樣的表述:“pH=2的鹽酸和pH=1的醋酸,c(H+)之比為2:1”、“pH=13的氨水”。這樣的溶液存在嗎?
案例4 鎂與pH=3的酸反應的質量變化不能使托盤天平偏轉
試題[7]:在托盤天平的兩個托盤上,分別放置質量相同的燒杯A和B。在A、B燒杯中分別倒入等質量的pH=3的鹽酸和醋酸(溶液的密度均為1g/cm3),然后向兩燒杯中分別加入等質量且足量的鎂,反應過程中,觀察天平指針將(D)。
A.不發生偏轉
B.先偏向B,后轉向中間
C.先偏向B,后偏向A
D.開始不偏轉,后偏向A
試題結合了反應速率、電離平衡移動以及質量變化。剛加鎂的瞬間,兩燒杯的質量和c(H+)均相等,反應速率也相等,故不偏轉。隨后因醋酸的電離平衡不斷右移,造成醋酸中c(H+)較大,反應速率較快,且n(CH3COOH)大于n(HCl),所以燒杯B中被溶解的鎂多,天平不斷偏向A。
以上解析純粹站在理論角度,它忽視了一個重要細節:托盤天平的感量是0.1g。那要使A、B兩燒杯出現0.1g質量差,需要多少醋酸、鹽酸?
根據醋酸的Ka,可知pH=3的醋酸的濃度為1/18 mol·L-1。設醋酸和鹽酸的體積均為V L,鹽酸與Mg反應生成的H2為10-3 V g,即A盤減少的質量。所以醋酸與鎂反應至少要生成(0.1+10-3 V)g H2時天平才能偏轉。則: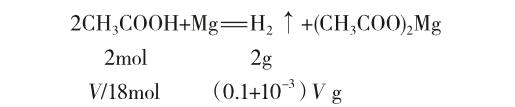
解得:V=1.8L。換算成溶液質量為1800g。這已經遠遠超出了托盤天平的量程(一般是200克)。
3 相關思考
數據是高度濃縮的科學語言,有著豐富的含義和教學功能。基于實踐和事實的數據可以讓教學“錦上添花”,但經不起推敲的數據卻會讓教學“如鯁在喉”。如上述四個案例,從原理上看正確可行,但數據卻成了其中的敗筆。因此,我們必須從培養學生思維嚴密性、從防范“誤人子弟”的高度來思考數據的問題。endprint
造成數據不科學的原因是多方面的。科學真實的數據源于重復的觀察和記錄,但在高中教學中,定性探究多,定量探究少(蘇教版全系教材中,僅有中和熱測定、中和滴定及鍍鋅鐵皮鋅層厚度的測定等少數幾個),教師親自動手測量獲取數據的機會不多,致使對數據的可靠性不夠敏感,缺乏對錯誤數據的鑒別能力,不經意間使用了一些不科學的數據。
由于對錯誤數據不夠敏感,又沒有對選用的數據進行多角度核驗,更沒有進行實地測量,導致錯誤數據不知不覺地滲入到了化學教學之中。
筆者認為,每一道不科學的試題都折射出教師在認知上的不足或誤區。以上4個案例告訴我們,科學的認識和使用數據是教師必須具備的能力之一,也是亟待提高的能力之一。這需要我們廣泛地收集數據,視數據為日常教學的重要資源,嘗試利用各類數據分析、論證化學問題。如,利用Fe(OH)3溶度積、Fe(SCN)n(3-n)+解離常數進行計算,發現Fe(OH)3懸濁液中加KSCN溶液不會變血紅色[8]。利用I2的溶解度、Fe3+氧化I-反應的平衡常數進行計算,發現I2氧化Fe2+生成的Fe3+足以和KSCN反應使溶液變色[9]。在糾正一些錯誤認知的同時,培養了用數據思考問題的習慣,提高數據敏感性。
多收集數據,多使用數據可以“熟能生巧”,可以提高對錯誤數據的敏感性,同時可以多角度地建立數據與其他知識間的有機鏈接,對防范在教學中出現錯誤數據有很大的幫助。
參考文獻:
[1]楊玉琴.中學生化學“定量化”能量的測評研究[J].化學教學,2013,(11):13~16.
[2]丁浩.基于教材數據處理與應用的實踐探索[J].化學教學,2015,(7):14~16.
[3]王祖浩主編.普通高中課程標準實驗教科書·化學反應原理(選修)(第二版)[M].南京:江蘇教育出版社,2007:33~34.
[4]《科學實驗活動練習冊》編寫組.義務教育課程標準·科學實驗活動練習冊(四年級·上冊)[M].杭州:浙江科學技術出版社,2015:14.
[5][6]楊德壬.中學教學全書·化學卷[M].上海:上海教育出版社,1996:890,894。
[7]大港一中高二第二次月考化學試卷(百度文庫:http://wenku.baidu.com).
[8]吳朝輝.關于一道Fe3+與SO3 2-實驗探究題的證偽與改編[J].化學教學,2015,(7):75~77.
[9]吳朝輝,翁雪香. Fe2+與Fe3+轉化實驗中意外現象解釋及相關試題商榷[J].化學教學,2015,(12):90~92.endprint

