綿羊卵泡液高豐度白蛋白去除方法的比較
陳 瑩,李曉林,林嘉鵬,吳陽升*,黃俊成*
(1.新疆農業大學 農學院,新疆 烏魯木齊 830052;2.農業部 草食家畜遺傳育種與繁殖重點開放實驗室/新疆畜牧科學院 生物技術研究所,新疆 烏魯木齊 830000)
?
綿羊卵泡液高豐度白蛋白去除方法的比較
陳 瑩1,李曉林2,林嘉鵬2,吳陽升2*,黃俊成2*
(1.新疆農業大學 農學院,新疆 烏魯木齊 830052;2.農業部 草食家畜遺傳育種與繁殖重點開放實驗室/新疆畜牧科學院 生物技術研究所,新疆 烏魯木齊 830000)
比較了2種試劑盒去除綿羊卵泡液中高豐度白蛋白的效果。結果表明: PierceTMAlbumin Depletion Kit去除高豐度白蛋白的效率高,但特異性不好; ProteoExtract? Albumin/IgG Removal Kit對高豐度白蛋白的去除效率不如前者,且不能有效去除綿羊的IgG,但其去除ALB的特異性要好于前者;經兩種試劑盒處理樣品的2-DE電泳分離圖譜顯示白蛋白區域顯色程度和面積均比綿羊卵泡液原液樣品的小,但PierceTM試劑盒對大分子低豐度蛋白質的回收效率低,而ProteoExtract?對小分子低豐度蛋白質的回收率低;經PierceTM試劑盒處理后樣品的蛋白質圖譜中可檢出點的數量更多。
綿羊;卵泡液;白蛋白;去除方法
卵泡液是在卵泡形成過程中生成的,是血漿組分跨過血-卵泡屏障轉移和卵泡細胞新陳代謝共同的產物。卵泡液和顆粒細胞共同為卵母細胞的發育和成熟提供微環境。卵巢的顆粒細胞、卵泡內膜細胞及基質細胞均可產生調節因子,通過自分泌和(或)旁分泌作用,參與卵巢內局部調控。這些物質的含量變化和蛋白或肽的修飾都能夠精確反映卵泡發育成熟的生理過程[1]。卵泡液的成分特征直接影響卵母細胞的質量和發育潛能[2]。因此研究卵泡液中蛋白質的組分及功能對研究卵泡發育進程及卵母細胞的生長發育具有重要作用。
雙向電泳技術結合質譜技術是一種有效的蛋白質組學分析方法。利用該技術對人的成熟和未成熟卵泡液間差異蛋白進行研究,發現不同發育階段的卵泡表現出不同的表達模式,這些差異表達蛋白質還可作為卵泡液成熟的標志物[3]。卵泡液的成分與血漿的成分類似,其血清白蛋白(Albumin, ALB)和免疫球蛋白(Immunoglobulin G, IgG)等高豐度蛋白質含量占總蛋白含量的60%~70%,嚴重干擾低豐度蛋白質的檢出率。因此,去除卵泡液中高豐度蛋白質將有利于分離和鑒定具有重要生物學功能的低豐度蛋白質。學者們對綿羊[4]、豬[5]、水牛[6]、牦牛[7]、雙峰駝[8]、馬[9]和狗[10]等動物均開展了卵泡液蛋白質組學的研究。雖然前期有人對綿羊的卵泡液進行了雙向電泳分析,但并沒有去除高豐度蛋白[4]。因此篩選和建立適于綿羊的白蛋白去除方法在綿羊卵泡液蛋白質組學研究中顯得尤為重要。
本研究采用ProteoExtract?Albumin/IgG Removal Kit和PierceTMAlbumin Depletion Kit對綿羊卵泡液中高豐度蛋白的去除效果進行了比較,以期篩選出適合綿羊卵泡液高豐度蛋白去除的方法,為綿羊卵泡液蛋白質組學的研究奠定技術基礎。
1 材料與方法
1.1綿羊卵泡液的采集
綿羊卵巢采自烏魯木齊市華凌屠宰場,在母羊被屠宰后立即剪取其卵巢并置于37 ℃生理鹽水中(含青霉素、鏈霉素雙抗),在1~2 h內運至實驗室。用2 mL注射器抽取卵巢上直徑為3~5 mm、光澤度和透明度好、表面毛細血管豐富的健康卵泡中的卵泡液。以12000 r/min離心10 min,取上清,以50 μL/管分裝,于-80 ℃下保存備用。
1.2卵泡液蛋白質濃度的測定
使用Pierce? BCA Protein Assay Kit (Thermo Fisher Scientific Inc. U. S. A)分別測定卵泡液及兩種去除高豐度蛋白試劑盒處理后樣品的蛋白質含量及濃度。根據試劑盒使用說明書進行操作,簡單地講,就是利用試劑盒中的試劑配制標準品,使用酶標儀測定標準品和稀釋一定倍數后的待測樣品在562 nm波長下的OD值。以OD值為橫坐標,標準品濃度為縱坐標,繪制標準曲線,依據標準曲線方程計算待測樣品的濃度。
1.3PierceTMAlbumin Depletion Kit對白蛋白的去除
按照試劑盒說明書進行去除高豐度蛋白的操作。重懸瓊脂糖樹脂(Cibacron Blue dye agarose resin),取400 μL懸浮液(包含200 μL樹脂顆粒)于離心柱中,瞬時離心,棄濾出液,加200 μL Wash buffer于離心柱中,瞬時離心,棄流出液。將離心柱置于新的離心管中;取1管分裝凍存的綿羊卵泡液樣品,用WB/BB進行10倍稀釋,取200 μL加入離心柱中,使其與樹脂顆粒完全混勻,在室溫下孵育3 min;以12000 r/min離心1 min,將流出液重新加入離心柱中,在室溫下孵育3 min;以12000 r/min離心1 min,收集流出液,將離心柱放于新的離心管中;加入50 μL WB/BB洗滌離心柱,以釋放未結合的蛋白;以12000 r/min離心1 min,收集流出液,將離心柱置于一個新的離心管中;重復前兩步4~5次,分別收集每次的流出液,測定蛋白質濃度;用洗脫液洗脫收集結合在樹脂顆粒上的蛋白,測定其濃度。
1.4ProteoExtract? Albumin/IgG Removal Kit對高豐度蛋白的去除
按照試劑盒說明書進行去除高豐度蛋白的操作,簡單地講,取制備的綿羊卵泡液,用結合緩沖液對其進行10倍稀釋。用結合緩沖液對吸附柱預處理兩次,然后將稀釋后的卵泡液樣品300 μL上柱,利用重力流收集穿流液。然后再取600 μL結合緩沖液上柱,收集穿流液;重復1次。共收集過柱穿流液1500 μL。測定穿流液的蛋白質濃度。用0.5 mol/L NaCl洗脫親和柱上的結合蛋白質,收集洗脫液,測定洗脫液中蛋白質濃度。
1.5電泳
1.5.1單向電泳配制10 cm×7 cm、厚0.75 mm的分離膠(12%)和濃縮膠(5%)。每孔上樣量20 μL,以90 V電泳20 min,以120 V電泳2 h。
1.5.2雙向電泳蛋白沉淀:根據蛋白質濃度測定結果,向經兩種試劑盒處理后的300 μg蛋白樣品各自加入3倍體積的預冷丙酮,混勻,-20 ℃靜置2 h以上(或過夜),離心(12000 r/min,10 min,4 ℃),棄上清。再加200 μL預冷丙酮漂洗沉淀,離心(12000 r/min,10 min,4 ℃),棄丙酮。室溫靜置2~3 min,使殘留丙酮揮發干凈。蛋白水化:在水化開始前,按每2.5 mL水化儲備液(8 mol/L尿素、2%CHAPS、2%IPG緩沖液、0.002%溴酚藍)添加7 mg DTT的比例準備水化液,向每個沉淀的蛋白質樣品中加入340 μL水化液溶解沉淀。取規格為18 cm、pH 3~10的IPG干膠條(GE Healthcare,美國),將其置于水化盤中,將經水化液溶解的蛋白質樣品加注在干膠條槽內,蓋好水化盤蓋,過夜。等電聚焦:設置運行參數,其中溫度20 ℃,電流50 μA/膠條,升壓方式、時間及電壓見表1。膠條平衡:將平衡緩沖液I [6 mol/L尿素、75 mmol/L Tris-HCl (pH 8.8)、29.3%甘油、2%SDS、0.002%溴酚藍、1%DTT]在室溫下平衡15 min;然后將膠條置于平衡緩沖液Ⅱ[6 mol/L尿素、75 mmol/L Tris-HCl (pH 8.8)、29.3%甘油、2%SDS、0.002%溴酚藍、2.5%碘乙酰胺]中平衡15 min;最后將平衡后的膠條轉移至第二向,以12.5%聚丙烯酰胺進行凝膠電泳(120 V,14 h,12 ℃)。

表1 等電聚焦的運行參數
1.6凝膠染色
對1-D PAGE和2-D PAGE凝膠均采用銀染的方法。銀染方法:用固定液(50%甲醇、12%乙酸、0.05%甲醛)固定2 h以上或過夜;用沖洗液(35%乙醇)沖洗20 min;用敏化液(0.025% Na2S2O3)敏化2~3 min;用去離子水沖洗3次,每次4~5 min;用銀染液(0.2%AgNO3、0.072%甲醛)染色20 min;用去離子水沖洗2次,每次5~10 s;用顯影液(6%Na2CO3、0.05%甲醛、2%敏化液)顯影1~3 min;根據顯色效果換終止液(50%甲醇、12%冰乙酸)終止反應。拍照凝膠圖像并分析。
2 結果與分析
2.1兩種試劑盒去除綿羊卵泡液中白蛋白后蛋白質濃度的變化
所采集卵泡液樣品經BCA試劑盒測定,其蛋白質濃度為56.6 μg/μL。
在使用PierceTMAlbumin Depletion Kit去除ALB時,需將卵泡液蛋白質樣品用Washing buffer進行10倍稀釋。稀釋后蛋白樣品200 μL,經過柱吸附后穿流液蛋白濃度為2.09 μg/μL (200 μL)。經Washing buffer洗柱4次(50 μL/次),洗柱液蛋白濃度分別是0.96、0.64、0.48、0.55 μg/μL。穿流液總蛋白含量為549.5 μg。高豐度白蛋白去除效率為51.5%(582.5 μg/1132 μg)。
在使用ProteoExtract? Albumin/IgG Removal Kit去除高豐度蛋白質時,用結合緩沖液將卵泡液樣品進行10倍稀釋。取300 μL稀釋的卵泡液樣品上柱(1698 μg),收集穿流液,合并4次洗柱液,共1500 μL,其蛋白質濃度為0.82 μg/μL,蛋白質總量為1230 μg。高豐度蛋白質去除效率為27.5%(468 μg/1698 μg)。
結果表明,PierceTMAlbumin Depletion Kit去除綿羊卵泡液高豐度蛋白的效率高。
2.2去除綿羊卵泡液樣品ALB的單向電泳結果
用兩種試劑盒去除綿羊卵泡液樣品高豐度ALB后對其進行單向(1-D)聚丙烯酰胺凝膠電泳(PAGE)分析。在1-D PAGE中,綿羊卵泡液中ALB和IgG的蛋白質含量超過總蛋白含量的70%(圖1中的oFF)。綿羊ALB由607個氨基酸組成 (Genbank ID: NP_001009376.1),分子量預測為69.2 kDa。電泳圖中含量最高的ALB蛋白質分子量約70 kDa,其含量超過總蛋白的50%(圖1中的E1和E2)。IgG分子電泳顯示為50 kDa和25 kDa的兩條帶(圖1)。
用PierceTM試劑盒處理卵泡液樣品后,其ALB含量顯著下降,同時多個低豐度蛋白的條帶濃度增加(圖1中的D1)。將結合在樹脂上的ALB洗脫后發現,還有多個非ALB被結合(圖1中的E1)。而用ProteoExtract?處理卵泡液后,其對ALB的去除效率不如前者,但去除ALB的特異性要好于前者(圖1中的E2)。雖然該試劑盒可有效去除人的IgG,但在本實驗中不能有效去除綿羊的IgG(圖1中的D2)。

M:蛋白質分子量標記; oFF:綿羊卵泡液; D1: PierceTM白蛋白去除試劑盒處理后樣品; E1: PierceTM試劑盒實驗組洗脫結合在樹脂上的蛋白質組分; D2: ProteoExtract?試劑盒處理后樣品; E2: ProteoExtract?試劑盒洗脫結合柱上蛋白質組分。
圖1兩種試劑盒去除綿羊卵泡液高豐度蛋白效果比較(SDS-PAGE圖)
2.3去除綿羊卵泡液樣品白蛋白的雙向電泳結果
用兩種試劑盒處理綿羊卵泡液后,分別用雙向電泳分離蛋白質樣品,所得圖譜如圖2所示。綿羊卵泡液中的高豐度白蛋白和IgG占總蛋白的比例高,顏色深(圖2A)。經過兩種試劑盒處理后,部分白蛋白被除去,部分蛋白點含量提高,其中PierceTM試劑盒的去除效率稍高于ProteoExtract?的(圖2B、圖2C)。但是這兩種試劑盒在大分子和小分子回收效率上有差異,其中PierceTM試劑盒似乎對大分子有親和性,對大分子的回收效率低(圖2C);而ProteoExtract?似乎對小分子有親和性,對小分子的回收率低(圖2B)。雖然兩種試劑盒均能去除部分高豐度白蛋白,但兩者對大分子或小分子低豐度蛋白質的回收存在一定程度的差異。
3 討論
隨著后基因組時代的到來,對蛋白質組學的研究也受到越來越廣泛的關注。近年來蛋白質的分離和鑒定技術發展迅速,其中雙向電泳結合質譜技術是蛋白質組學研究中應用最為普遍的技術,其具有包含信息量大、分辨率高、穩定性強、高效靈敏準確的特點,但在具體實驗過程中對于樣品制備的要求較為嚴格,除應注意增加樣品中總蛋白 (尤其是疏水性蛋白)的溶解度和減少制備過程中對蛋白的人為修飾外,還應該注意盡可能去除高豐度蛋白和無關蛋白,保證研究蛋白的可檢出性不受干擾。卵泡液中含量較高的蛋白質組分包括ALB和IgG。去除高豐度蛋白是蛋白質組學相關實驗樣品制備過程中的首要任務,是實驗成敗的關鍵因素之一。
本實驗使用的ProteoExtract? Albumin/IgG Removal Kit是利用免疫親和層析的原理去除體液中的Albumin/IgG的。特異性強是抗體親和層析方法的重要特點。即將抗高豐度蛋白(Albumin、IgG等)的抗體偶聯到惰性介質(樹脂、葡聚糖等)上,樣品在穿流介質過程中,高豐度蛋白被吸附在介質上;低豐度蛋白穿流而下,再經過濃縮,使得低豐度蛋白在總蛋白中的含量增加,提高蛋白質的檢出率[11-12]。人和綿羊的ALB在氨基酸序列上并不完全相同。本試驗中所用的Albumin/IgG Removal Kit試劑盒所攜帶的抗體識別人的抗原特異性強,而識別綿羊的ALB能力弱,甚至不識別綿羊的IgG,故去除效率低。該類試劑盒對水牛[6]和狗[10]卵泡液高豐度蛋白的去除效果亦不理想,處理后高豐度蛋白含量仍然很高。因此這類基于抗體親和層析人的體液高豐度蛋白去除試劑盒并不適合于家畜的卵泡液樣品的處理。只有首先具有特異于綿羊的高豐度蛋白抗體才可以更加有效地使用該類試劑盒。
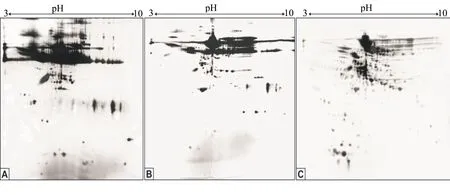
A:未處理的綿羊卵泡液樣品; B:使用ProteoExtract?白蛋白/IgG去除試劑盒實驗組處理后樣品;C:使用PierceTM白蛋白去除試劑盒實驗組處理后樣品。
化學小分子染料卡巴斯蘭(Cibacron Blue, CB)對人的ALB親和吸附能力最強(90%),同時對綿羊和牛的ALB也具有一定的親合性(分別為39%和22%),并且在低pH值下具有較高的吸附能力[13]。將蛋白樣品與固化到惰性介質上的CB共孵育時,高豐度蛋白被結合上而被去除,從而提高低豐度蛋白質在總蛋白中的含量[14-15]。本試驗使用的PierceTMAlbumin Depletion Kit是利用CB對ALB的親和性特點去除該蛋白的。雖然其去除效率高于另一種試劑盒,但該方法的特異性不強,還有一些其它分子被去除。
綜合比較這兩種去除高豐度蛋白的試劑盒對綿羊卵泡液樣品處理的結果,可以看出這兩種方法均能去除綿羊卵泡液樣品中的高豐度蛋白。PierceTM白蛋白去除試劑盒去除高豐度蛋白的效率比較高,可以達到富集小分子量低豐度蛋白的目的,但也會造成部分小分子量蛋白的損失。ProteoExtract?白蛋白/IgG去除試劑盒特異性好,但去除高豐度蛋白的效率不高。因此,相對而言, PierceTM白蛋白去除試劑盒更適用于綿羊卵泡液蛋白質組學研究中的樣品處理,所得的雙向電泳圖譜能夠較好地展現綿羊卵泡液的總蛋白信息,并且有利于后續質譜鑒定工作的開展。
本研究結果為進一步優化綿羊卵泡液雙向電泳體系,尋找和鑒定綿羊卵泡發育過程中的關鍵蛋白奠定了基礎。未來進行家畜體液蛋白質組學研究中,還有待于開發更加高效特異的去除高豐度蛋白的方法。
[1] Rodgers R J, Irving-Rodgers H F. Formation of the ovarian follicular antrum and follicular fluid [J]. Biol Reprod, 2010, 82(6): 1021-1029.
[2] Revelli A, Delle P L, Casano S, et al. Follicular fluid content and oocyte quality: from single biochemical markers to metabolomics [J]. Reprod Biol Endocrinol, 2009, 7: 40.
[3] Spitzer D, Murach K F, Lottspeich F, et al. Different protein patterns derived from follicular fluid of mature and immature human follicles [J]. Hum Reprod, 1996, 11(4): 798-807.
[4] 徐鐵山,張勇,李鴻巖,等.綿羊卵泡液蛋白質組2-DE圖譜的構建及初步分析[J].湖南農業科學,2010,13:149-151.
[5] 孫艷玲,周虛,李曉艷,等.豬卵泡液樣品制備方法對雙向電泳圖譜的影響[J].生物技術通報,2010(5):149-157.
[6] 黃愉淋,付強,黃德倫,等.去除高豐度蛋白質后水牛卵泡液的雙向電泳差異分析[J].畜牧獸醫學報,2014,45(7):1113-1119.
[7] Zhao G S, Liu S S, Wu X H, et al. A proteomics study of Tianzhu white yak ovary during estrus and pregnancy [J]. Pak Vet J, 2014, 34(1): 87-91.
[8] 陶金忠,趙國順,胡俊杰,等.雙峰駝卵泡發育過程中卵泡液差異蛋白質組學[J].獸類學報,2014,34(1):80-86.
[9] Fahiminiya S, Labas V, Roche S, et al. Proteomic analysis of mare follicular fluid during late follicle development [J]. Proteome Sci, 2011, 9: 54.
[10] Fahiminiya S, Reynaud K, Labas V, et al. Steroid hormones content and proteomic analysis of canine follicular fluid during the preovulatory period [J]. Reprod Biol Endocrinol, 2010, 8: 132.
[11] Bjorhall K, Miliotis T, Davidsson P. Comparison of different depletion strategies for improved resolution in proteomic analysis of human serum samples [J]. Proteomics, 2005, 5(1): 307-317.
[12] Echan L A, Tang H Y, Ali-Khan N, et al. Depletion of multiple high-abundance proteins improves protein profiling capacities of human serum and plasma [J]. Proteomics, 2005, 5(13): 3292-3303.
[13] Leatherbarrow R J, Dean P D. Studies on the mechanism of binding of serum albumins to immobilized cibacron blue F3G A [J]. Biochem J, 1980, 189(1): 27-34.
[14] Aziz A, Zhang W, Li J, et al. Proteomic characterisation ofEchinococcusgranulosushydatid cyst fluid from sheep, cattle and humans [J]. J Proteomics, 2011, 74(9): 1560-1572.
[15] Altintas E B, Denizli A. Efficient removal of albumin from human serum by monosize dye-affinity beads [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2006, 832(2): 216-223.
(責任編輯:黃榮華)
Comparative Study on Effects of Removing High-abundance Albumin from Sheep Follicular Fluid by Two Different Kits
CHEN Ying1, LI Xiao-lin2, LIN Jia-peng2, WU Yang-sheng2*, HUANG Jun-cheng2*
(1. College of Agronomy, Xinjiang Agricultural University, Urumqi 830052, China; 2. Key Laboratory of Genetics, Breeding and Reproduction of Grass-feeding Livestock, Ministry of Agriculture / Institute of Biotechnology, Xinjiang Academy of Animal Sciences, Urumqi 830000, China)
We compared the effects of removing high-abundance albumin from sheep follicular fluid by two different kits. The results showed that PierceTMAlbumin Depletion Kit had a high efficiency of removing high-abundance albumin, but its specificity was poor. ProteoExtract? Albumin/IgG Removal Kit had a lower efficiency of removing high-abundance albumin than the former, and it could not effectively remove the IgG from sheep follicular fluid, but it had a better specificity in removing from albumin than the former. The 2-DE electrophoresis patterns showed that the coloration degree and area of albumin district of sheep follicular fluid samples treated with two kits were smaller than those of untreated samples. PierceTMkit had a low recovery efficiency to macromolecular and low-abundance proteins, while ProteoExtract? kit had a low recovery efficiency to small-molecular and low-abundance proteins. In the protein diagram of the samples treated with PierceTMkit, there were more detected points.
Sheep; Follicular fluid; Albumin; Removing method
2016-03-24
國家自然科學基金項目(U1203381);新疆維吾爾自治區重點實驗室開放課題(2015KL007)。
陳瑩,女,碩士研究生,主要從事家畜繁殖生物技術的研究。*通訊作者:吳陽升、黃俊成。
S826.89
A
1001-8581(2016)09-0005-04

