羥自由基氧化系統對蝦蛄鹽溶蛋白結構和功能性的影響
周景麗,張坤生,任云霞(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津300134)
羥自由基氧化系統對蝦蛄鹽溶蛋白結構和功能性的影響
周景麗,張坤生*,任云霞
(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津300134)
采用由0.01 mmol/L FeCl3、0.1 mmol/L抗壞血酸和不同濃度(0~20 mmol/L)H2O2組成的羥自由基氧化體系,對蝦蛄鹽溶蛋白分別氧化1、3、5 h后測定蛋白的羰基含量、巰基含量、二酪氨酸含量、蛋白表面疏水性、濁度及乳化性。結果表明:羥自由基氧化會引起蝦蛄鹽溶蛋白結構發生改變,表現在羰基含量增加、巰基含量減少、二酪氨酸含量增加、表面疏水性升高、濁度上升及乳化性下降。這些氧化引起的變化說明,蝦蛄鹽溶蛋白結構對羥自由基氧化體系有很大的敏感性。
蝦蛄,鹽溶蛋白,氧化,羥自由基
蝦蛄是季節性極強的海產品[1],且消費者對其需求量日益增加,所以對蝦蛄的研究具有十分重要的意義。蝦蛄在加工、流通和貯藏過程中,不可避免地受到溫度、光、射線、氧、水分和催化劑等外界環境的影響,導致脂肪和蛋白質等營養成分發生氧化[2]。研究表明,蛋白質氧化是導致肉類食品品質下降的重要原因[3]。氧化不僅可以降低肉的食用品質,如嫩度、多汁性、風味和色澤等,還會影響肉的功能性,如乳化性[4-5]。目前對肌肉蛋白質氧化的報道主要集中在畜肉和魚類,蝦蛄肉品質劣變是否與蛋白質發生氧化相關還未見報道。本實驗采用羥自由基氧化體系對蝦蛄鹽溶蛋白進行氧化,通過測定羰基、巰基、二酪氨酸、表面疏水性、濁度及乳化性,探討蛋白質發生氧化對蝦蛄鹽溶蛋白內部結構產生的影響。
1 材料與方法
1.1 材料與儀器
蝦蛄 購買于天津金元寶濱海農產品交易市場;考馬斯亮藍G250、溴酚藍(BPB) 天津市科密歐化學試劑開發中心;牛血清白蛋白(BSA)、EDTA Sigma試劑公司;無水乙醇、磷酸氫二鈉、磷酸二氫鈉、三氯化鐵 天津市北方天醫化學試劑廠;85%磷酸、30%過氧化氫、乙酸乙酯、鹽酸 天津市風船化學試劑科技有限公司;抗壞血酸、KCl天津市贏達稀貴化學試劑廠;哌嗪-N,N—雙(2-乙磺酸)(PIPES)、5,5'-二硫代雙(2-硝基苯甲酸)(DTNB) 北京博奧拓達科技有限公司;2,4-二硝基苯肼、鹽酸胍 天津市光復精細化工研究所;十二烷基硫酸鈉(SDS) 北京鼎國生物技術有限責任公司;尿素、甘氨酸、Tris等化學試劑 均為分析純。
A2004A電子天平 上海精天儀器有限公司;IKAT10高速組織勻漿機 德國IKA公司;Avanti J-E高效離心機 美國貝克曼庫爾特有限公司;UV-7504紫外可見分光光度計 上海欣茂儀器有限公司;EL20實驗室pH計 梅特勒-托利多儀器有限公司;磁力攪拌器 天津市歐諾儀器儀表有限公司;5J2-0004熒光分光光度計 日立高新技術公司
1.2 實驗方法
1.2.1 蝦蛄鹽溶蛋白的提取 參考Sun[6]和邱春強[7]的方法,并結合前期實驗結果做改進如下:取經過冷凍的蝦蛄,在4℃下解凍24 h。將解凍后的蝦蛄去頭,去甲殼,去凈腸腺及蝦黃,稱取蝦蛄肉5 g,加入2.7倍體積的pH為6.46的磷酸鹽緩沖液,并要求NaCl濃度0.10 mol/L。在10000 r/min的轉速下用高速組織勻漿機均質30 s,并用磁力攪拌20 min。將勻漿液用紗布過濾,在10000 r/min的轉速下離心10 min,收集上清液即為蝦蛄鹽溶蛋白。用去離子水稀釋上清液后測定蛋白質含量,蛋白質含量的測定采用考馬斯亮藍法[8]。
1.2.2 蝦蛄鹽溶蛋白的氧化 參考Wu等[9]的方法構建以下模擬氧化體系:反應歷程為,VC+Fe3+→Fe2+,Fe2++H2O2→·OH。本實驗主要采用H2O2氧化體系,模擬體系中,蝦蛄鹽溶蛋白的濃度為5 mg/mL,FeCl3濃度為0.01 mmol/L,VC濃度為0.1 mmol/L,H2O2濃度分別為0.5、1、5、10、20 mmol/L。在4℃條件下氧化1、3、5 h用1 mmol/L EDTA終止。以上的氧化反應均在15 mmol/L哌嗪-N,N—雙(2-乙磺酸)緩沖溶液(pH6.0,離子強度0.6 mol/L)中進行。空白對照為新鮮蝦蛄中提取出來后,未加氧化劑直接于4℃放置1、3、5 h的蝦蛄鹽溶蛋白,每個處理設置3個重復。
1.2.3 羰基含量測定 參考 Levine等[10]測定羰基的方法,并稍作修改,方法如下:取10 mL的離心管中,加入1 mL濃度為5 mg/mL的蛋白溶液與1 mL 10 mmol/L 2,4-二硝基苯肼的2 mol/L HCl溶液,在25℃下反應1 h(每5 min旋渦振蕩一次),添加1 mL 20%三氯乙酸,10000 r/min離心5 min,棄清液,蛋白沉淀用1 mL的乙醇-乙酸乙酯溶液(體積比為1∶1)洗滌3次,揮發完溶劑后將蛋白質懸浮于3 mL 6 mol/L鹽酸胍溶液中,在37℃條件下水浴保溫30 min,10000 r/min離心5 min。空白樣品中加入1 mL不含2,4-二硝基苯肼的2 mol/L HCl溶液。以空白為對照370 nm下測吸光值,蛋白質羰基衍生物的含量(nmol/mg蛋白)使用摩爾吸光系數為22000 mol-1·L·cm-1計算。
1.2.4 巰基含量測定 總巰基的測定參考Simplicio等[11]使用Ellman試劑法稍作修改進行測定。方法如下:將1 mL 5 mg/mL蛋白溶液與8 mL Tris-甘氨酸溶液(pH=8,每升該溶液中含有10.4 g Tris,6.9 g甘氨酸,1.2 g EDTA,8 mol尿素)混合,將4.5 mL樣品溶液加入0.5 mL 10 mmol/L Ellman試劑,30 min后在412 nm處測定吸光值,巰基濃度計算使用摩爾吸光系數13600 mol-1·L·cm-1計算。
1.2.5 二酪氨酸含量測定 參考Davies等[12]的方法并略加修改測定樣品中二酪氨酸含量,取氧化后的蝦蛄鹽溶蛋白溶液1 mL,稀釋10倍后用考馬斯亮藍法測定溶液的蛋白含量。用熒光光度法測定溶液中二酪氨酸含量,測定條件為:發射波長420 nm(狹縫5 nm),激發波長325 nm(狹縫5 nm)。測定結果用熒光強度除以稀釋后蛋白濃度,表示為相對熒光值(Arbitrary Units,AU)。
1.2.6 蛋白表面疏水性的測定 參考孫為正[13]的方法,并稍作修改方法如下:用20 mmol/L磷酸鹽緩沖液(pH6.46)將蝦蛄鹽溶蛋白溶液濃度調至2 mg/mL。取2 mL稀釋蛋白液加入40 μL 1 mg/mL的溴酚藍(BPB)溶液,充分混合。對照組處理為磷酸鹽緩沖液中直接加入溴酚藍溶液(不含蝦蛄鹽溶蛋白),其余操作同上。處理組和對照組在室溫下振蕩10 min,然后在4℃條件下4000 r/min離心15 min。磷酸鹽緩沖液空白作為本底,上清液在595 nm處測定吸光度。用結合態的疏水溴酚藍結合量(總溴酚藍與游離溴酚藍的差值)作為表面疏水性指數。表面疏水性用以下公式表示:
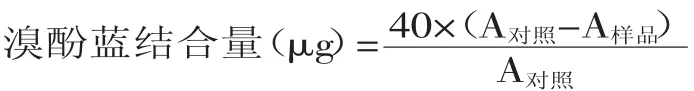
1.2.7 蝦蛄鹽溶蛋白濁度的測定 依據Benjakul[14]的方法測定蝦蛄鹽溶蛋白濁度。吸取蛋白濃度為1 mg/mL的蝦蛄鹽溶蛋白的溶液5 mL放入試管中,經過不同H2O2濃度羥自由基氧化系統氧化后,分別在30、40、50、60、70℃的水浴鍋中水浴30 min后取出,冷卻后以不加蛋白的溶液為空白,在600 nm處測定吸光值。
1.2.8 蝦蛄鹽溶蛋白乳化活力和乳化穩定性的測定
蝦蛄鹽溶蛋白的乳化性質的測定采用濁度法[15]。取質量濃度為1 mg/mL的磷酸化蝦蛄鹽溶蛋白8.0 mL 與2.0 mL的大豆油混合放入直徑為2.5 cm的塑料離心管中用勻漿機高速勻漿1 min,立即從距離心管底0.5 cm的地方取勻漿液50 μL,加入到5 mL為0.1% (m/v)SDS溶液中,振蕩混勻后在500 nm處測定吸光值記作A0,勻漿后10 min再次在相同的位置取勻漿液50 μL,加入到5 mL 0.1%SDS溶液中,振蕩混勻后測定吸光值A10,用0.1%SDS溶液作空白對照。磷酸化蝦蛄鹽溶蛋白的乳化活力EAI(m2/g)和乳化穩定性ESI (%),分別用下面的公式來計算:
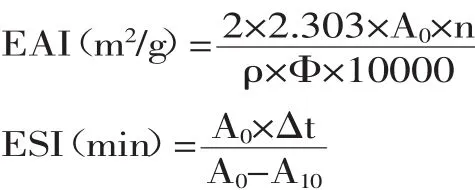
式中:EAI為乳化能力;ESI為乳化穩定性;n為稀釋倍數;ρ為蛋白質質量濃度(g/mL);Φ為油相體積分數(v/v)(Φ=0.2);A0為均質結束后樣品在波長500 nm處的吸光度;A10為均質10 min后的樣品在波長500 nm處的吸光度;Δt為10 min。
1.2.9 數據處理 實驗用設計分析軟件為Design Expert 8.0,采用SPSS16.0對數據進行處理和分析。
2 結果與分析
2.1 自由基氧化體系對蝦蛄鹽溶蛋白中羰基含量的影響由圖1可見,當氧化時間相同時,羰基含量隨H2O2濃度的升高而增加,如在氧化5 h條件下,蝦蛄鹽溶蛋白經過0.5、1、5、10、20 mmol/L H2O2氧化后,與對照組相比,羰基含量分別增加了8.3%、23.8%、56.9%、86.7%、99.4%。當H2O2濃度相同時,羰基含量隨氧化時間的延長而增加,如蝦蛄鹽溶蛋白經過1、3、5 h氧化后,當H2O2濃度增加至20 mmol/L時,與對照組相比,其羰基含量分別增加了54.2%、87.6%、99.4%。羰基的產生被作為蛋白氧化的重要指標之一,羰基含量越高表明蛋白質氧化程度越高[16-17]。羰基主要由氨基酸側鏈(通常為易受自由基攻擊的帶有NH或者NH2的氨基酸殘基)及肽鍵的氧化斷裂產生[18],羰基含量的增加可能是由于羥自由基(·OH)對氨基酸側鏈或肽鏈的氧化攻擊造成[19]。
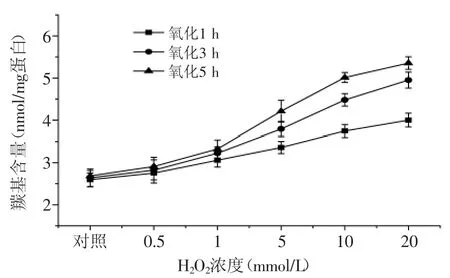
圖1 自由基氧化體系對蛋白羰基含量的影響Fig.1 Effect of free radical generating system on carbonyl content of protein
2.2 自由基氧化體系對蝦蛄鹽溶蛋白中巰基含量的影響
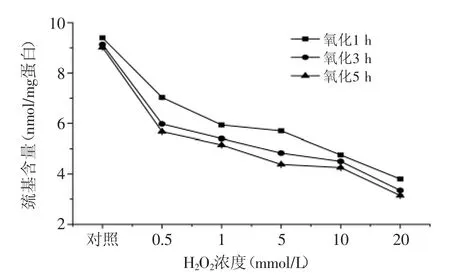
圖2 自由基氧化體系對蛋白巰基含量的影響Fig.2 Effect of free radical generating system on sulfhydryl content of protein
由圖2可知,自由基氧化體系對巰基含量的影響與對羰基含量的變化趨勢恰好相反,當氧化時間相同時,巰基含量隨H2O2濃度的升高而減少,如在氧化5 h條件下,蝦蛄鹽溶蛋白經過0.5、1、5、10、20 mmol/L H2O2氧化后,與對照組相比,巰基含量分別減少了37.1%、42.9%、51.4%、52.8%、65.1%。當H2O2濃度相同時,巰基含量隨氧化時間的延長而降低,如蝦蛄鹽溶蛋白經過1、3、5 h氧化后,當H2O2濃度增加至20 mmol/L時,與對照組相比,其巰基含量分別降低了59.6%、63.3%、65.1%。巰基含量的降低可能是由于羥自由基誘導的蛋白質氧化會導致蛋白質中巰基轉化成二硫鍵,從而造成蛋白質巰基含量下降[20]。
2.3 自由基氧化體系對蝦蛄鹽溶蛋白中二酪氨酸含量的影響
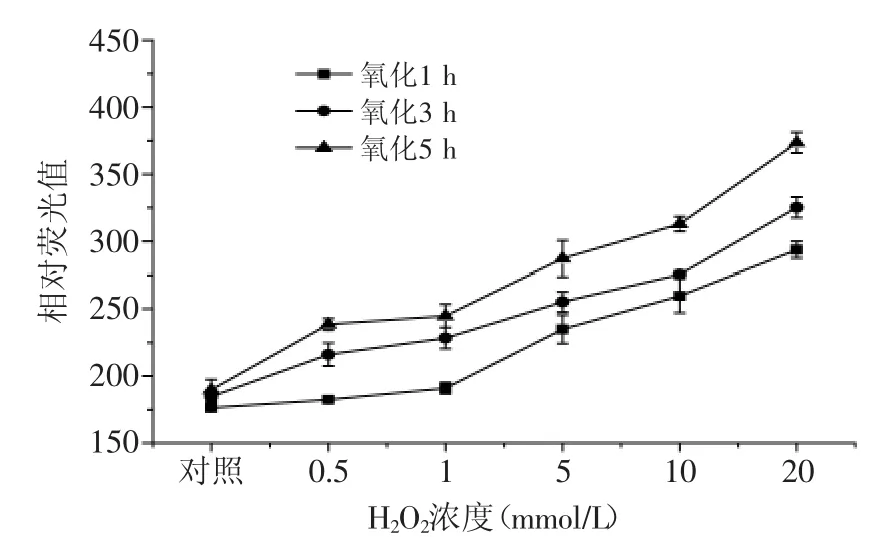
圖3 自由基氧化體系對蛋白二酪氨酸含量的影響Fig.3 Effect of free radical generating system on bityrosine content of protein
由圖3可知,自由基氧化體系對二酪氨酸含量相對熒光值的影響與對羰基含量的變化趨勢相似,當氧化時間相同時,二酪氨酸含量相對熒光值隨H2O2濃度的升高而增加,如在氧化5 h條件下,蝦蛄鹽溶蛋白經過0.5、1、5、10、20 mmol/L H2O2氧化后,與對照組相比,二酪氨酸含量相對熒光值分別增加了25.6%、29.1%、51.4%、65%、99.5%。當H2O2濃度相同時,二酪氨酸含量相對熒光值隨氧化時間的延長而增加,如蝦蛄鹽溶蛋白經過1、3、5 h氧化后,當H2O2濃度增加至20 mmol/L時,與對照組相比,其二酪氨酸含量相對熒光值分別增加了62.9%、78%、99.6%。酪氨酸是易受活性氧自由基氧化攻擊的敏感型氨基酸,氧化后生成二聚酪氨酸,其含量可作為分析蛋白氧化的另一個重要指標[12]。有研究報道,在氧化體系中,隨著氧化劑濃度的升高,會有越來越多的酪氨酸自由基和酪氨酸殘基產生,這些酪氨酸自由基和酪氨酸殘基會相互結合生成二酪氨酸,導致二酪氨酸含量逐漸增加[21]。
2.4 自由基氧化體系對蝦蛄鹽溶蛋白表面疏水性的影響
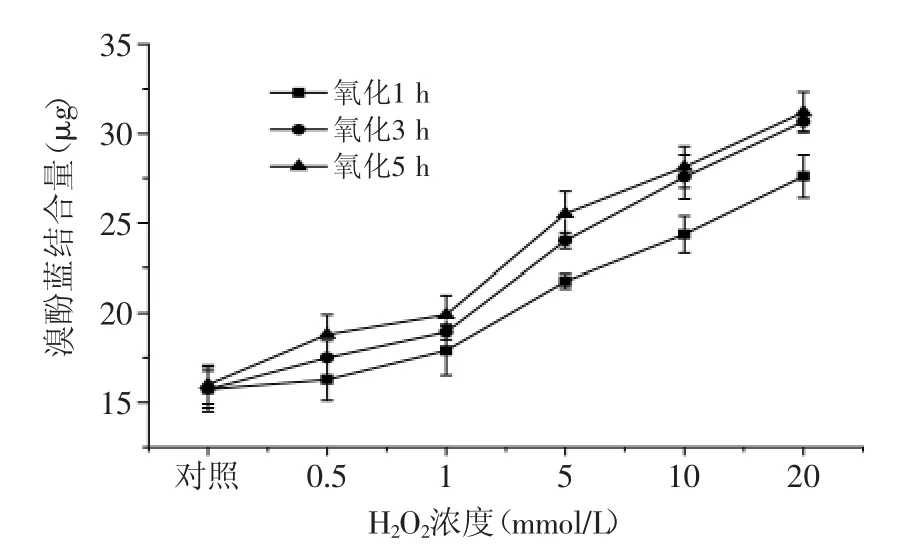
圖4 自由基氧化體系對表面疏水性的影響Fig.4 Effect of free radical generating system on the surface hydrophobicity of protein
由圖4可見,當氧化時間相同時,蝦蛄鹽溶蛋白結合溴酚藍的量隨H2O2濃度的升高而增加,如在氧化5 h條件下,蝦蛄鹽溶蛋白經過0.5、1、5、10、20 mmol/LH2O2氧化后,與對照組相比,結合溴酚藍的量分別增加了17.5%、24.4%、59.4%、75.8%、95%。當H2O2濃度相同時,結合溴酚藍的量隨氧化時間的延長而增加,如蝦蛄鹽溶蛋白經過1、3、5 h氧化后,當H2O2濃度增加至20 mmol/L時,與對照組相比,其結合溴酚藍的量分別增加了75.5%、94.9%、95%。通過測定蛋白質表面疏水性的變化可反映氧化引起的蛋白質的物理或化學特性的變化。蛋白氧化會導致蛋白質中疏水性氨基酸的暴露[22]。蛋白質疏水性殘基可與溴酚藍結合,從而可以通過測定蛋白質與溴酚藍的結合量來反映蛋白質的表面疏水性[23]。
2.5 自由基氧化體系對蝦蛄鹽溶蛋白濁度的影響

圖5 自由基氧化體系對蛋白濁度的影響Fig.5 Effect of free radical generating system on the turbidity of protein
由圖5可見,蝦蛄鹽溶蛋白經氧化后,加熱時樣品的濁度表現出不同程度的變化。當氧化時間和加熱溫度相同時,蛋白濁度隨H2O2濃度的升高而增加,如在氧化1 h,加熱溫度為70℃條件下,蝦蛄鹽溶蛋白分別經過0、0.5、1、5、10、20 mmol/L H2O2氧化后,蛋白濁度分別為0.292、0.523、0.546、0.618、0.707和0.762。當加熱溫度和H2O2濃度相同時,蛋白濁度隨氧化時間的延長而增加,如加熱溫度為50℃,H2O2濃度為5 mmol/L條件下,蝦蛄鹽溶蛋白分別經過1、3、5 h氧化后,濁度分別為0.434、0.4394和0.494。當氧化時間和H2O2濃度相同時,蛋白濁度隨加熱溫度的升高而升高,如在氧化3 h和H2O2濃度為5 mmol/L條件下,蝦蛄鹽溶蛋白分別經過30、40、50、60和70℃時,蛋白濁度分別為0.162、0.3505、0.4394、0.5785和0.698。出現這些趨勢的原因可能是氧化和加熱可以使蛋白質之間發生交聯反應,而蛋白質分子發生交聯會導致蛋白溶液光學密度增加[24],因此濁度可用于監測蛋白溶液在加熱過程中蛋白質分子之間的交聯程度[25]。
2.6 自由基氧化體系對蝦蛄鹽溶蛋白乳化活力和乳化穩定性的影響
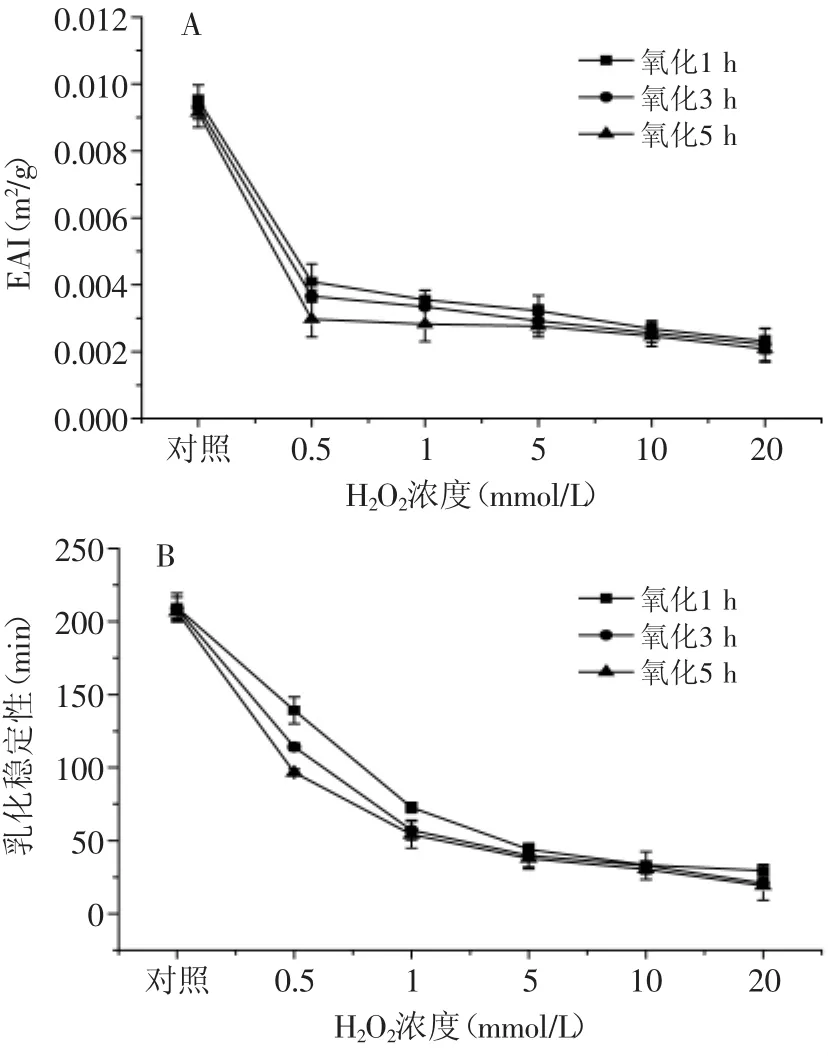
圖6 自由基氧化體系對蛋白乳化活性和乳化穩定性的影響Fig.6 Effect of free radical generating system on EAI and ESI of protein
由圖6可見,當氧化時間相同時,乳化活力和乳化穩定性隨H2O2濃度的升高而降低,如在氧化5 h條件下,蝦蛄鹽溶蛋白經過0.5、1、5、10、20 mmol/L H2O2氧化后,與對照組相比,乳化活力分別降低到0.00297、0.00283、0.00276、0.00247和0.00208 m2/g,乳化穩定性分別降低到96.747、54.186、37.882、30.461和19.191 min。當H2O2濃度相同時,乳化活力和乳化穩定性隨氧化時間的延長而降低,如蝦蛄鹽溶蛋白經過1、3、5 h氧化后,當H2O2濃度增加至20 mmol/L時,與對照組相比,乳化活力分別降低到0.00232、0.00222和0.00208 m2/g,乳化穩定性分別降低到29.484、21.060和19.191 min。實驗得出ESI和EAI有相同的下降趨勢,這表明自由基氧化體系嚴重影響了蝦蛄鹽溶蛋白的乳化能力,這與前期研究得出蛋白質氧化后其表面疏水性的增加和巰基含量的下降的結果相一致。表明氧化破壞了蛋白結構的完整性,使其發生變性,蛋白不能再形成穩定的界膜,蛋白與脂肪交聯能力下降,從而使其乳化活性和乳化穩定性下降[26]。
3 結論
蝦蛄鹽溶蛋白經過羥自由基氧化后,羰基含量隨著氧化時間和羥自由基濃度的增加呈現增加趨勢;二酪氨酸含量和表面疏水性也發生不同程度的增加,且氧化時間越長,與對照相比,增加越明顯;巰基含量隨氧化時間和羥自由基濃度的增加而下降,這些結果表明,羥自由基氧化會引起蛋白功能性質的降低,表現在蛋白濁度隨加熱時間、氧化時間和羥自由基濃度的升高而升高;蛋白的乳化活力和乳化穩定性隨氧化時間和羥自由基濃度的升高下降。功能性的降低會破壞蝦蛄肉的加工性能及食用品質,所以在蝦蛄貯存及加工過程中應該防止蝦蛄肉的氧化,減少蝦蛄肉品質的劣變。
[1]郭文場,劉佳賀.中國沿海蝦蛄的養殖與綜合利用[J].特種經濟動植物,2011(11):13-16.
[2]Johns A M,Birkshaw L H,Ledward D A.Catalysts of lipid oxidation in meat products[J].Meat Science,1989,25(3):209-220.
[3]胡忠良,嚴璐,鄒玉峰,等.氧化對肌原纖維蛋白加工特性的影響[J].食品與發酵工業,2011,37(10):128-133.
[4]Xiong Y L,Blanchard S P,Ooizumi,et al.Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J].Journal of Food Science,2010,75(2):215-221.
[5]Lund M N,Heinonen M.Protein oxidation in muscle foods:a review[J].Molecular Nutrition and Food Research,2011,55(1):83-95.
[6]Jingxin Sun,Zhen Wu,Xinglian Xu,et al.Effect of peanut protein isolate on functional properties of chicken salt-soluble proteins from breast and thigh muscles during heat-induced gelation[J].Meat Science,2012,91:88-92.
[7]邱春強,張坤生,任云霞.超高壓和瓜爾膠對雞肉鹽溶蛋白凝膠的影響[J].核農學報,2014,28(3):433-439.
[8]彭倩.豬血中血紅蛋白的分離、磷酸化及其功能性的研究[D].天津:天津商業大學,2010.
[9]Wu M G,Xiong Y L,Chen J.Rheology and microstructure of myofbrillar protein-plant lipid composite gels:Effect of emulsion droplet size and membrane type[J].Journal of Food Engineering,2011,106(4):318-324.
[10]Levine R L,Williams J A,Stadtman E R,et al.Carbonyl assays for determination of oxidatively modified proteins[J].Methods Enzymol,1994,233:346-357.
[11]P Di Simplicio,K H Cheeseman,T F Slater.The reactivity of the SH group of bovine serum albumin with free radicals[J].Free Radical Research,1991,14(4):253-262.
[12]Davies K J A.Protein damage and degradation by oxygen radicals[J].Journal of Biological Chemistry,1987,262:9895-9901.
[13]孫為正.廣式臘腸加工過程中脂質水解、蛋白質降解及風味成分變化研究[D].廣州:華南理工大學,2011.
[14]Benjakul S,Visessanguan W,Ishizaki S,et al.Differences in gelation characteristics of natural actomyosin from two species of bigeyesnapper,PriacanthustayenusandPriacanthusmacracanthus [J].Journal of Food Science,2001,66(9):1311-1318.
[15]Kingsley K Agyare,Kwaku Addo,Xiong Y L.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids,2009,23(1):72-81.
[16]Liu G,Xiong Y L,Butterfield D A.Chemical,physical and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolates[J].Food Chemistry and Toxicology,2000,65 (5):811-818.
[17]Dean R T,Fu S L,Stocker R,et al.Biochemistry and pathology of radical-mediated protein oxidation[J].Biochemical Journal,1997,324:1-18.
[18]Stadtman E R.Protein oxidation and aging[J].Science,1992,257(5074):1220-1224.
[19]Butterfield D A,Stadtman E R.Protein oxidation processes in aging brain.Timiras P S,edit.Advances in Cell Aging and Gerontology[M].Netherlands:Elsevier Science Press,1997,2:161-191.
[20]Wang Y S,Xiong Y L,Rentfrow G K,et al.Oxidation promotes cross-linking but impairs film-forming properties of whey proteins[J].Journal of Food Engineering,2013,115:11-19.
[21]崔旭海,孔保華.自由基引起的氧化對牛乳清蛋白凝膠特性的影響[J].農業工程學報,2009,25(1):222-228.
[22]Sun W Z,Zhou F B,Sun D W,et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins[J].Food and Bioprocess Technology,2013,6(7):1703-1712.
[23]Santé-Lhoutellier V,Aubry L,Gatellier P.Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins[J].Journal of Agricultural Food Chemistry,2007,55:5343-5348.
[24]Xia X F,Kong B H,Xiong Y L,et al.Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J].Meat Science,2010,85(3):481-486.
[25]李銀.蛋白氧化對肌肉保水性的影響機制研究[D].北京:中國農業科學院,2014.
[26]李艷青,孔保華,夏秀芳,等.羥自由基氧化對鯉魚肌原纖維蛋白乳化性及凝膠性的影響[J].食品科學,2012,33(9):31-35.
Protein oxidation-induced structure and function changes of the oratosquilla oratoria salt-soluble protein
ZHOU Jing-li,ZHANG Kun-sheng*,REN Yun-xia
(Tianjin Key Laboratory of Food Biotechnology,College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China)
The objective of this study was to investigate the content of carbonyl,sulfhydryl,bityrosine,the surface hydrophobicity,the turbidity and emulsifying of the oratosquilla oratoria salt-soluble protein treated by hydroxyl radical generating systems containing 0.01 mmol/L ferric trichloride,0.1 mmol/L ascorbic acid and 0~20 mmol/L hydrogen peroxide for 1,3 h and 5 h respectively.The results revealed that the carbonyl content,the bityrosine content,the turbidity and the sulfhydryl increased,while sulfhydryl content,emulsifying activity and emulsion stability decreased.These oxidation-induced structural changes revealed high susceptibility of the oratosquilla oratoria salt-soluble protein to oxidative stress.
oratosquilla oratoria;the salt-soluble protein;oxidation;hydroxyl radical
TS201.2
A
1002-0306(2016)02-0330-05
10.13386/j.issn1002-0306.2016.02.058
2015-04-20
周景麗(1990-),女,碩士研究生,研究方向:食品加工與貯藏,E-mail:zhoujingli1110@126.com。
*通訊作者:張坤生(1957-),男,博士,教授,研究方向:食品加工與貯藏,E-mail:zhksheng@tjcu.edu.cn。
國家科技支撐計劃項目(2012BAD37B06-07)。

