堿性β-葡萄糖苷酶產生菌株的篩選、鑒定及部分酶學性質研究
李 松,楊 倩,范李龍,崔鳳杰,趙鵬翔(.安徽工程大學生物與化學工程學院,安徽蕪湖4000;.江蘇大學食品與生物工程學院,江蘇鎮江0;.國網節能服務有限公司北京生物質能源技術中心,北京0005)
堿性β-葡萄糖苷酶產生菌株的篩選、鑒定及部分酶學性質研究
李 松1,楊 倩1,范李龍1,崔鳳杰2,趙鵬翔3
(1.安徽工程大學生物與化學工程學院,安徽蕪湖241000;2.江蘇大學食品與生物工程學院,江蘇鎮江212013;3.國網節能服務有限公司北京生物質能源技術中心,北京100053)
為開發新型堿性微生物來源的β-葡萄糖苷酶資源,本文采用七葉苷平板顯色篩選法在堿性條件下從多個土壤樣本和印染洗滌廢水中篩選得到一株β-葡萄糖苷酶產生菌株,并對該菌株進行了分子生物學鑒定、發酵特性及部分酶學性質研究。結果表明:篩選菌株為Bacillus sp.,其最適生長和產酶溫度為35~37℃,最適生長和產酶pH分別為9.5和9.0;該菌株所產β-葡萄糖苷酶最適作用溫度和pH分別為50℃和9.5;在50℃以下和pH9.0~10.0內比較穩定;Cu2+、Fe2+、Ca2+和Mn2+對該酶表現出一定抑制作用,而Mg2+、Zn2+和Co2+對該酶催化活性沒有明顯影響。研究結果對產堿性β-葡萄糖苷酶的微生物資源獲取和信息整理具有一定的借鑒意義。
堿性β-葡萄糖苷酶,篩選,酶學性質
β-葡萄糖苷酶(EC 3.2.1.21,BG),又稱β-D-1,4-葡萄糖苷水解酶,常與內切葡聚糖酶(EC 3.2.1.4,EG)和纖維二糖水解酶(EC 3.2.191,CBHs)共同構成一組可對纖維素進行高效協同作用的纖維素酶系[1-3]。β-葡萄糖苷酶可將纖維二糖徹底水解并釋放葡萄糖,同時該酶常因微生物自然分泌量的不足而成為整個纖維素酶系水解過程中的主要限速酶[4]。β-葡萄糖苷酶對纖維二糖的水解活性最強,但由于β-葡萄糖苷酶對底物(糖基)部分結構的專一性較差,使得β-葡萄糖苷酶不僅能夠使C-O、C-S、C-N和C-F等鍵斷裂,還可以水解β-半乳糖苷鍵,甚至由于對糖分子結構中C6位的專一性不高而能夠水解木糖[5],這使得β-葡萄糖苷酶除了可以與其他纖維素酶組分協同水解纖維素外,還可以在糖苷轉移或水解[6-7]、制茶[8]以及食品增香[9-10]等多個領域使用。
堿性酶制劑在洗滌用酶中占有非常重要的地位,如堿性脂肪酶、堿性淀粉酶、堿性蛋白酶和堿性纖維素酶等[11]。其中,堿性酶制劑的研究及其品種的更新和應用拓展,在很大程度上得益于對嗜堿菌資源的深度開發和利用。目前使用的堿性纖維素酶主要是由一類耐堿或嗜堿芽孢桿菌屬或鏈霉菌屬微生物產生,因為該類堿性芽孢桿菌往往僅具有纖維素酶單一組分(內切葡聚糖酶)的生成能力,因此堿性纖維素酶又可專指堿性內切葡聚糖酶[12-13]。關于堿性β-葡萄糖苷酶的研究報道非常少,使得對該酶資源的獲取和利用進展緩慢,同時也限制了該酶的工業應用。因此,研究和開發堿性β-葡萄糖苷酶對該酶應用領域的拓展和實際使用均具有一定的現實意義。本文以獲取堿性β-葡萄糖苷酶資源并研究其催化性質多樣性為目的,從土壤以及印染廠洗滌廢水中篩選得到一株堿性β-葡萄糖苷酶的產生菌株,通過16S rDNA序列比對和生理生化特性研究對該菌株進行了鑒定,同時對堿性β-葡萄糖苷酶的部分酶學性質進行分析。
1 材料與方法
1.1 材料與儀器
分離樣本 采集于蕪湖市神山公園、蕪湖市周邊農田等地表下5~10 cm土壤以及印染廠洗滌廢水(各處理工段總廢水);初篩培養基(酵母膏0.5%,蛋白胨1%,NaCl 0.5%,KH2PO40.1%,瓊脂2.0%)、復篩培養基(七葉苷1.0%,(NH4)2SO40.3%,KH2PO40.1%,MgSO40.05%,檸檬酸高鐵銨0.025%,瓊脂2.0%)、種子培養基(葡萄糖2.0%,蛋白胨0.5%,酵母粉0.3%,NaCl 0.5%,KH2PO40.1%,MgSO40.05%)和發酵培養基(乳糖2%,NaCl 0.1%,NaNO30.3%,蛋白胨0.5%,酵母粉0.3%,MgSO40.05%) 均使用Na2CO3調節pH 至9.5;PCR產物回收、純化和質粒提取試劑盒 購自大連生物工程(大連)有限公司;七葉苷(CAS#66778-17-4) 購自上海綠葉生物科技有限公司;其他分析純或化學純生化試劑 購自國藥集團化學試劑有限公司;細菌16S rDNA通用引物27F(5′-AGAGTTTGA TCCTGGCTCAG-3′)和1429R(5′-GGTTACCTTGTTA CGACTT-3′) 購自蘇州金唯智生物科技有限公司。
滅菌鍋LDZX-50KBS 上海申安醫療器械廠;高速冷凍離心機Allg642 美國貝克曼公司;振蕩培養箱GHZ-123B 太倉市華美生化儀器廠;超凈工作臺SW-CJ-2FD 蘇凈集團蘇州安泰空氣技術有限公司;PCR儀TC312 美國伯樂公司;紫外可見光分光光度計L5 上海精科儀器有限公司;生物顯微鏡XSP-2C 上海光學儀器廠;掃描電子顯微鏡S4800日本日立公司。
1.2 實驗方法
1.2.1 菌株篩選 將采集的34個土壤樣本和1個印染廢水樣本在無菌環境中使用無菌水進行溶解或稀釋并梯度稀釋至10-1、10-2和10-3。分別取200 μL各樣本梯度稀釋液涂布于初篩培養基,在37℃條件下恒溫培養24 h至出現易挑取的單菌落。分別用滅菌處理的牙簽從每個樣本的分離平板中優先挑取2~3個菌落形態或顏色有差異的單菌落,點種復篩培養基并于37℃條件下恒溫培養24 h。挑取在復篩培養基中出現深褐色顯色圈的菌落,使用復篩培養基做進一步劃線分離,并對該分離菌進行后續研究。
1.2.2 菌株形態學觀察 將分離菌株劃線初篩培養基并在37℃條件下恒溫培養24 h,觀察菌落形態,同時挑取單菌落于0.2 mL無菌水中并振蕩混勻,吸取10 μL菌懸液制片并進行革蘭氏染色或掃描電鏡觀察。
1.2.3 菌株生理生化實驗 篩選菌株的革蘭氏染色及其對大分子物質的水解及產酸等實驗參照《微生物學實驗》[14]所述方法和步驟進行。
1.2.4 菌株的分子生物學鑒定 分離菌株染色體DNA的提取、質粒DNA的小量制備及DNA的酶切、連接、轉化等操作參見文獻[15]進行。其中,以該菌株染色體DNA為模板,使用細菌16S rDNA通用引物在54℃退火溫度下進行擴增,得到的PCR產物經純化后連接入T-載體并使用擴增引物進行序列測定,序列測定委托蘇州金唯智生物科技有限公司完成。通過在線數據庫Blast/blastp(http://www.ncbi.nlm.nih.gov/Blast)對測定序列進行比對,選擇同源性較高的序列利用BioEdit軟件進行ClustalW多重比對(重復計算1000次),并進一步使用MEGA 5.0軟件對其結果通過Neighbor-Joining(NJ)法構建系統發育樹。
1.2.5 搖瓶發酵 挑取單菌落接入種子培養基30 mL/ 250 mL,在37℃、200 r/min條件下培養16 h后按10%比例接入發酵培養基50 mL/250 mL并在37℃、200 r/min條件下進行發酵。微生物生長前期為菌種快速增殖期,然后進入平穩期,因此在0~24 h期間內每隔2 h取樣,在24~54 h期間內每隔6 h取樣,進行菌體密度和酶活力測定。
在上述培養過程中,分別將溫度設定在25、30、35、40、45℃條件下進行發酵,以研究溫度對菌株生長和產酶的影響;分別將發酵液初始pH調整為7.0、7.5、8.0、8.5、9.0、9.5和10.0條件下進行發酵,以研究發酵液初始pH對菌株生長和產酶的影響。
1.2.6 酶學性質研究 分別在40、45、50、55、60、65、70℃等溫度下測定酶活力,以測定的最高酶活力為100%計算相對酶活力,以研究酶的最適作用溫度;將酶液分別在40、50、60、70℃溫度條件下保溫1 h后測定殘余酶活力,以未經保溫處理的酶液活力為對照(計為100%)計算相對酶活力,以研究酶液在不同溫度下的穩定性;分別在pH8.0、8.5、9.0、9.5、10.0、10.5和11.0條件下測定酶活力,以測定的最高酶活力為100%計算相對酶活力,以研究酶的最適作用pH;將酶液分別使用pH為8.0、9.0、10.0和11.0的緩沖液稀釋2倍后于30℃下保溫1 h后測定殘余酶活力,以經保溫處理但未加緩沖液的酶液活力為對照(計為100%)計算相對酶活力,以研究酶液在不同pH條件下的穩定性。其中,pH8.0~8.5使用Tris-鹽酸緩沖液(0.05 mol/L),pH9.0~10.5使用甘氨酸-氫氧化鈉緩沖液(0.05 mol/L),pH11.0使用磷酸氫二鈉-氫氧化鈉緩沖液(0.05 mol/L)。在反應體系中分別加入金屬離子Mg2+、Zn2+、Cu2+、Fe2+、Mn2、Ca2+和Co2+至終濃度分別為1 mmol/L和5 mmol/L,以未加入金屬離子的酶液活力為對照(計為100%)計算相對酶活力,以研究金屬離子對酶催化性質的影響。
1.2.7 菌體密度測定 發酵液樣品經適當稀釋后于600 nm處測定吸光值(OD600)并按公式(1)計算菌體密度,同時對β-葡萄糖苷酶活力進行測定。

式(1)中,ODM為發酵液中菌體密度;A1為發酵液稀釋樣品在600 nm處的吸光值;A0為未接種培養基在600 nm處的吸光值;N為稀釋倍數;測定中均采用1 cm玻璃比色杯。
1.2.8 β-葡萄糖苷酶活力測定 取1 mL發酵液于10,000 r/min離心5 min,取上清并使用甘氨酸-氫氧化鈉緩沖液(0.05 mol/L,pH9.5)適當稀釋。取0.5 mL適當稀釋的粗酶液加入1 mL 1%水楊苷(溶于0.05 mol/L,pH9.5甘氨酸-氫氧化鈉緩沖液)及0.5 mL 0.05 mol/L,pH9.5甘氨酸-氫氧化鈉緩沖液,50℃保溫30 min,加入3 mL 3,5-二硝基水楊酸(DNS)試劑[16]沸水浴10 min,冷卻后加水稀釋至25 mL,使用分光光度計測定在540 nm處測定吸光值(OD520)。
酶活力單位定義:在上述反應條件下,每分鐘水解七葉苷生成1 μmol還原糖(以葡萄糖計)所需的酶量定義為1個β-葡萄糖苷酶活力單位(U)。其中,以煮沸滅活的酶液作為對照。測定結束后樣品中β-葡萄糖苷酶活力按式(2)進行計算。
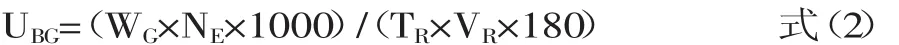
式(2)中,UBG為單位體積樣品中β-葡萄糖苷酶活力(U/mL);WG為從葡萄糖標準曲線中查得的葡萄糖的質量濃度(mg/mL);NE為酶液稀釋倍數;TR為反應時間(min);VR為反應體系中加入的酶液的體積(mL)。
1.3 數據處理
所有實驗項均做3個平行,3個平行數據的平均值和標準差計算以及數據作圖均采用OriginLab Origin V7.5(Northampton,MA,USA)軟件進行,數據以平均值±標準差形式表示。
2 結果與分析
2.1 菌株篩選
實驗結果經統計發現,在所選擇的34個土壤樣本中,平均每克樣本中含有可在pH9.5條件下生長的耐堿細菌數量約30 cfu,最多約120 cfu,最少3~4 cfu;在所選擇的一個印染洗滌廢水樣品中含耐堿細菌數量約1200~1500 cfu/mL,平均含量要遠遠高于正常土壤中耐堿細菌的數量,可能是洗滌廢水的堿性環境(pH11.0~11.5)對堿性微生物存在的富集作用所致。根據菌落形態、顏色的差異,共計挑選97個單菌落點種復篩平板,同時進行大分子水解實驗,如表1所示。結果顯示,在堿性條件下具有木聚糖酶產生能力的菌株最多,約占所分離菌株總數的37%,其中有部分菌株(約5%)同時具有3種以上大分子物質水解能力,但是僅有一株分離自印染廢水樣本的細菌(編號為AB46)具有β-葡萄糖苷酶活力,使篩選平板在培養過程中出現深棕色,如圖1(a)所示。挑取菌株AB46劃線初篩培養基,培養16 h后顯示AB46菌落呈乳白色,表面圓潤、整齊、有光澤,不產粘性物質,如圖1 (b)所示。革蘭氏染色及顯微形態觀察結果顯示AB46為革蘭氏陽性細菌,細胞為長桿狀,長約3~5 μm,直徑約0.3~0.6 μm,如圖1(c)和圖1(d)所示。

表1 耐堿細菌大分子水解平板檢測Table1 Macromolecule hydrolysis assay of alkaline bacteria
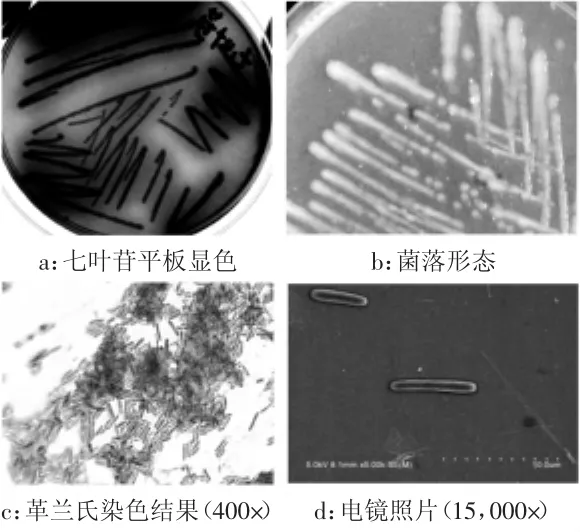
圖1 菌株AB46菌落及顯微形態觀察Fig.1 The colony and microscope morphology of strain AB46
2.2 菌株鑒定
生理生化實驗結果(表2)表明菌株AB46不能在45℃及以上溫度生長,表明該菌為中溫菌;該菌除了具有β-葡萄糖苷酶分泌能力外,還可以分泌淀粉和纖維素水解酶系;該菌可以利用常見的六碳糖進行成長(如葡萄糖),但不能利用五碳糖(如木糖)。
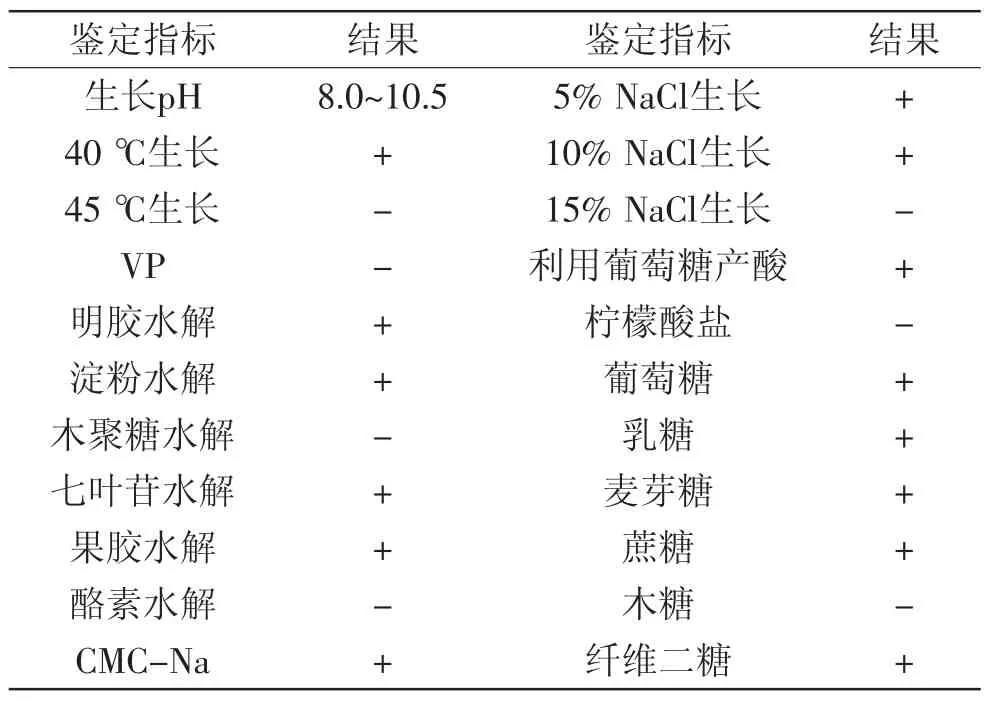
表2 菌株AB46生理生化特性Table2 The physiological and biochemical characteristics of strain AB46
菌株AB46 16S rDNA序列經測序后提交GenBank并獲得登陸號為:KP115895.1,選擇與較為相似的序列構建系統發育樹,如圖2所示。結果顯示,雖然在已鑒定到種的芽孢桿菌屬中,AB46與Bacillus cohnii(科氏芽孢桿菌)同源性最高,但AB46在同源進化分類上卻與Bacillus sp.(GenBank:EF672045.1)聚為一類。因此,結合形態學觀察(圖1)和生理生化實驗結果(表2)將菌株AB46鑒定為Bacillus sp.,并命名為Bacillus sp.AB46。
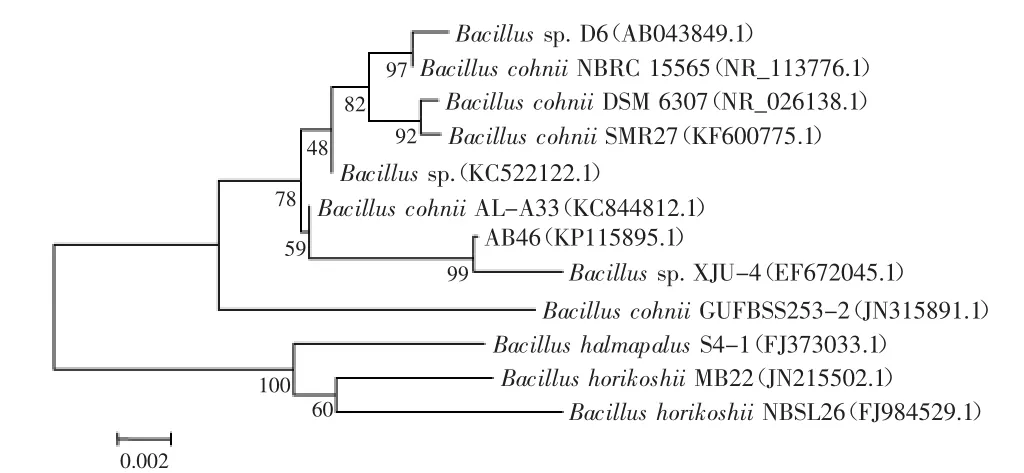
圖2 菌株AB46 16S rDNA序列系統發育樹Fig.2 Phylogenetic tree of strain AB46 based on the 16S rDNA sequence alignment
2.3 菌株生長與產酶過程
將菌株AB46在37℃、pH9.5條件下進行培養,每隔一定取樣并進行菌體密度和β-葡萄糖苷酶活力測定,結果如圖3所示,菌株AB46經歷一個典型的對數生長期后在16 h左右開始進入對數生長期的拐點(生長速率開始下降),并在24 h左右達到最大菌體密度,發酵至30 h左右菌體密度開始明顯下降,菌體細胞進入衰亡期。發酵至42 h時β-葡萄糖苷酶活力達到最大值,約0.9 U/mL,隨后開始下降。
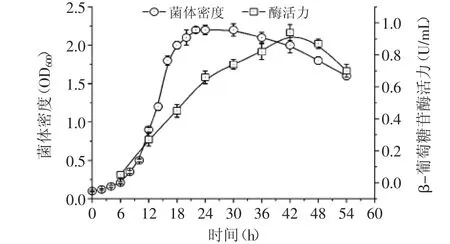
圖3 菌株AB46搖瓶發酵過程中生長及產酶變化趨勢Fig.3 Growth and enzyme production curves of strain AB46 in shaking flask fermentation
2.4 發酵條件對細胞生長和產酶的影響
2.4.1 初始pH對生長和產酶的影響 在不同pH條件下發酵獲得的最大菌體密度和酶活力結果如圖4所示。結果表明AB46最適生長pH為9.5,在pH9.0~10.0范圍內生長良好,當pH低于7.5時該菌株幾乎停止生長,顯示該菌株是一種專性嗜堿菌;β-葡萄糖苷酶活力變化趨勢表明AB46最適產酶pH為9.0,當pH高于9.5或低于8.5時產酶量明顯下降,最適產酶pH范圍較窄。在整體變化趨勢上,除了最適產酶pH比最適生長pH低0.5之外,兩者隨pH變化的趨勢均較為接近。
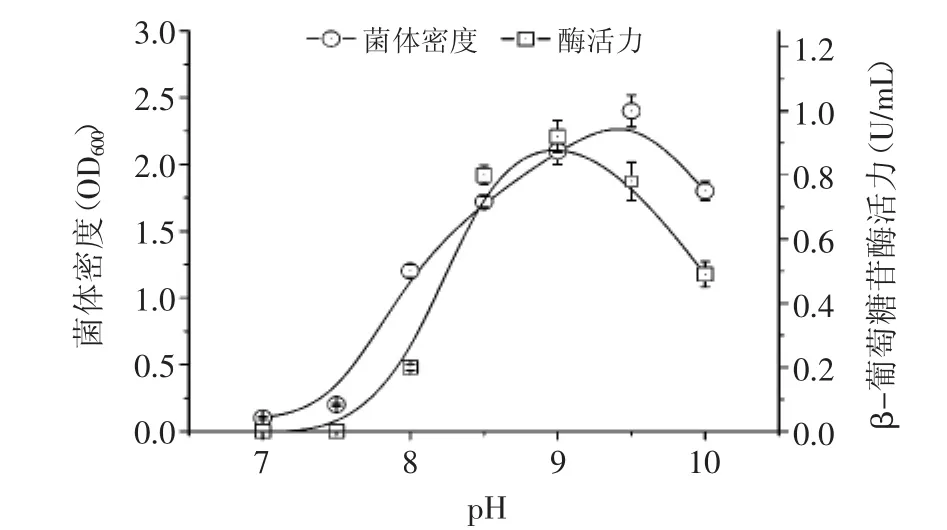
圖4 初始pH對菌株AB46發酵生長及產酶的影響Fig.4 Effect of initial pH value on growth and enzyme production of strain AB46 in shaking flask fermentation
2.4.2 溫度對生長和產酶的影響 在不同溫度條件下發酵獲得的最大菌體密度和酶活力結果如圖5所示。結果表明AB46最適生長溫度范圍為35~37℃,同時在25~40℃范圍內亦可快速生長,當溫度上升至45℃時菌體細胞幾乎停止生長,表明該菌株并不是耐熱細菌;在不同溫度條件下,該菌株產β-葡萄糖苷酶趨勢與菌體生長趨勢較為接近,即菌株的最適生長溫度與最適產酶溫度相同。

圖5 溫度對菌株AB46發酵生長及產酶的影響Fig.5 Effect of temperature on growth and enzyme production of strain AB46 in shaking flask fermentation
2.5 酶學性質研究
2.5.1 溫度和pH對酶催化活力的影響 在不同溫度和pH下分別測定β-葡萄糖苷酶的催化活力,結果表明:該酶最適作用溫度為50℃,在45~50℃范圍內催化活力較高,如圖6(a)所示;該酶最適作用pH為9.5,在pH8.0~11.0之間均具有最高催化活力的60%以上,如圖6(b)所示。
2.5.2 溫度和pH對酶穩定性的影響 熱穩定性研究顯示該酶40℃下保溫1 h后殘余酶活力81%,在60℃下保溫1 h后酶活力全部喪失,如圖7(a)所示,表明該酶的耐熱性一般,即使在60℃能夠發揮最大催化效率的70%左右,但在高溫(大于50℃)條件下的長時間處理過程中,該酶的應用性能可能會受到一定的限制。pH穩定性研究顯示該酶在pH8.0~9.0之間非常穩定,當pH上升至10.0時,酶的穩定性隨著pH的升高而出現大幅下降,如圖7(b)所示。綜合其最適反應pH條件可以判斷該酶屬于堿性β-葡萄糖苷酶,在弱堿性環境中(pH9.0~10.0)具有較好的穩定性和催化效率。

圖6 溫度(a)和pH(b)對酶催化活力的影響Fig.6 Effect of temperature(a)and pH(b)on catalytic activity of the enzyme
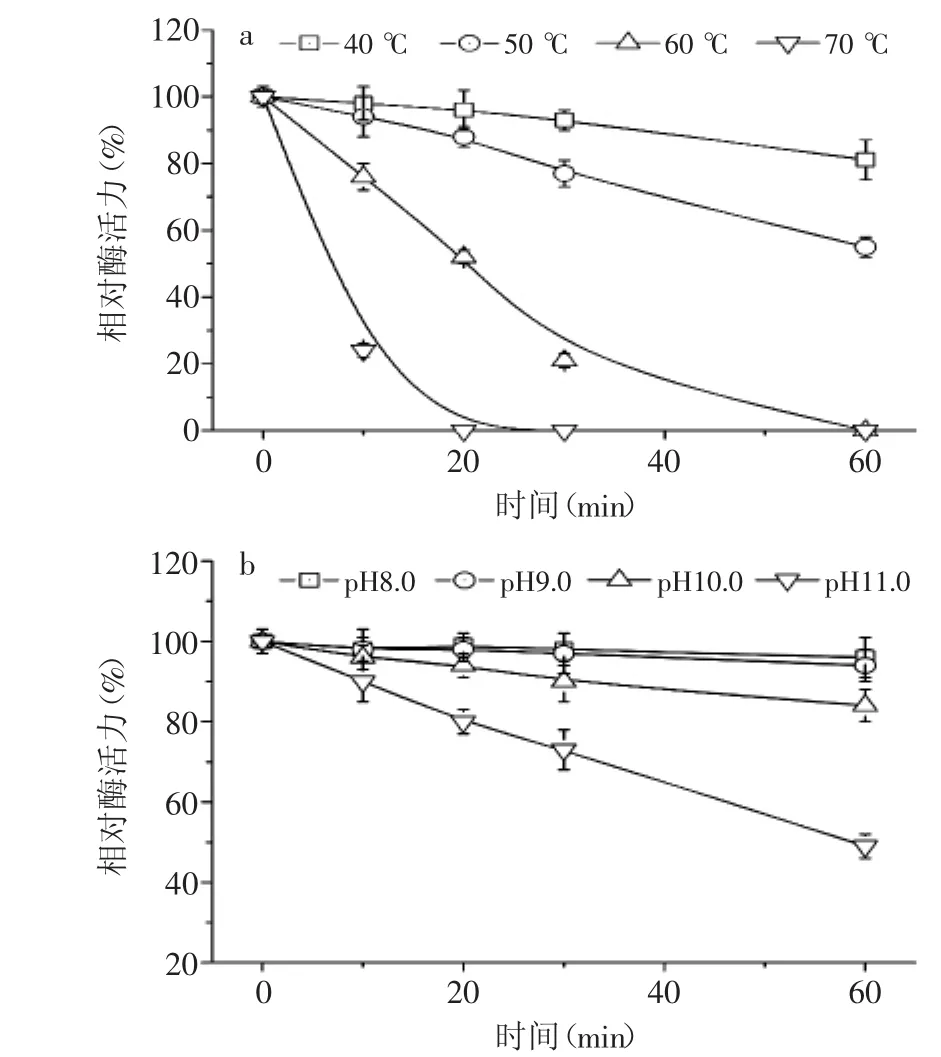
圖7 溫度(a)和pH(b)對酶穩定性的影響Fig.7 Effect of temperature(a)and pH(b)on stability of the enzyme
2.5.3 金屬離子對酶催化活力的影響 研究結果如圖8所示,表明高濃度(5 mmol/L)的Cu2+、Fe2+、Ca2+和Mn2+對該酶表現出一定抑制作用,而Mg2+、Zn2+和Co2+對該酶催化活性沒有明顯影響。
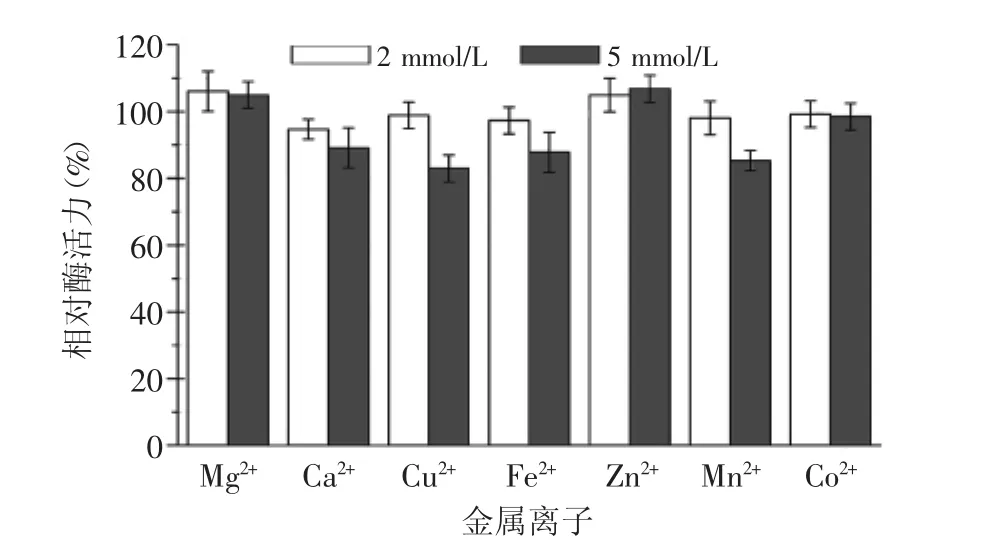
圖8 金屬離子對酶催化活力的影響Fig.8 Effect of mental ions on catalytic activity of the enzyme
3 結論與討論
目前關于堿性β-葡萄糖苷酶的研究報道非常少,僅有的少量報道顯示不同來源的堿性β-葡萄糖苷酶堿性作用條件較為相似,如馬振剛等[17]通過基因槍方法從兔盲腸細菌宏基因組中克隆到一種堿性β-葡萄糖苷酶編碼基因,在大腸桿菌中異源表達量后其堿性β-葡萄糖苷酶最適作用pH為10.0,在pH4.0~11.0范圍內保持較高酶活力;蘇迪等[18]報道一種克雷伯氏桿菌所產堿性β-葡萄糖苷酶最適作用pH為10.0,在pH7.0~11.0范圍內具有較高催化活力。本文采用七葉苷篩選平板顯色法快速從多個樣本中篩選出產β-葡萄糖苷酶菌株并鑒定為Bacillus sp.,研究結果顯示該菌株在pH9.0~10.0范圍內生長良好,是一種專性嗜堿菌。該菌株所產β-葡萄糖苷酶最適作用溫度為50℃,最適作用pH為9.5并在pH8.0~11.0范圍內可發揮較高催化活力;該酶在弱堿環境中(pH9.0~10.0)非常穩定,但在高溫(大于60℃)條件下容易失活。綜上,研究中使用七葉苷平板顯色法快速篩選得到β-葡萄糖苷酶產生菌株,雖然所獲得的菌株產酶水平比較低,但所獲菌株的生長和產酶特性及酶作用條件等研究結果可為產堿性β-葡萄糖苷酶的微生物資源研究及后期堿性β-葡萄糖苷酶基因的克隆和異源表達等工作奠定一定基礎。
[1]Juturu V,Wu J C.Microbial cellulases:Engineering,production and applications[J].Renewable and Sustainable Energy Reviews,2014,33:188-203.
[2]Karmakar M,Ray R R.Current trends in research and application of microbial cellulases[J].Research Journal of Microbiology,2011(6):41-53.
[3]Bhatia L,Johri S,Ahmad R.An economic and ecological perspective of ethanol production from renewable agro waste:a review[J].AMB Express,2012,2(1):65.
[4]Lee W H,Nan H,Kim H J,et al.Simultaneous saccharification and fermentation by engineered Saccharomyces cerevisiae without supplementing extracellular β-glucosidase[J].Journal of Biotechnology,2013,167(3):316-322.
[5]邵金輝,韓金祥,朱有名,等.葡萄糖苷酶在工農醫領域的應用[J].生命的化學,2005,25(1):22-24.
[6]Shin K C,Lee H J,Oh D K.Substrate specificity of βglucosidase from Gordonia terrae for ginsenosides and its application in the production of ginsenosides Rg3,Rg2,and Rh1from ginseng root extract[J].Journal of Bioscience and Bioengineering,2015,119(5):497-504.
[7]張丹,劉耀平,魚紅閃,等.人參皂苷β-葡萄糖苷酶的分離純化及其酶學特性[J].應用與環境生物學報,2003,9(3):259-262.
[8]王斌,江和源,張建勇,等.酶工程技術在茶葉深加工中的應用及展望[J].茶葉科學,2010,30(1):521-526.
[9]Chandra M,Kalra A,Sangwan N S,et al.Biochemical and proteomic characterization of a novel extracellular β-glucosidase from Trichoderma citrinoviride[J].Molecular Biotechnology,2013,53:289-299.
[10]Guo Y,Yan Q,Yang Y,et al.Expression and characterization of a novel β-glucosidase,with transglycosylation and exo-β-1,3-glucanase activities,from Rhizomucor miehei[J].Food Chemistry,2015,175:431-438.
[11]Sarethy I P,Saxena Y,Kapoor A,et al.Alkaliphilic bacteria: applications in industrial biotechnology[J].Journal of Industrial Microbiology&Biotechnology,2011,38(7):769-790.
[12]Annamalai N,Rajeswari M V,Elayaraja S,et al.Thermostable,haloalkaline cellulase from Bacillus halodurans CAS 1 by conversion of lignocellulosic wastes[J].Carbohydrate Polymers,2013,94(1):409-415.
[13]劉剛,余少文,孔舒,等.堿性纖維素酶及其應用的研究進展[J].生物加工過程,2005,3(2):9-14.
[14]沈萍,陳向東.微生物學實驗[M].第4版.北京:高等教育出版社,2007.
[15]薩姆布魯克J,拉塞爾D W.分子克隆實驗指南[M].第三版.北京:科學出版社,2002.
[16]MillerG L.Use of dinitrosalicylic acid reagent for determination of reduce sugar[J].Analytical Chemistry,1959,31 (3):426-428.
[17]馬振剛,唐婧,馬淑華,等.新型堿性低分子量β-葡萄糖苷酶基因的分離與酶學性質研究[J].食品工業科技,2012,4:108-113.
[18]蘇迪,徐小蓉,唐婧.高產堿性β-葡萄糖苷酶的產纖維素酶菌株的篩選[J].貴州農業科學,2012,40(2):87-89.
Screening and identification of alkaline β-glucosidase producing-strain and partial enzyme characterization
LI Song1,YANG Qian1,FAN Li-long1,CUI Feng-jie2,ZHAO Peng-xiang3
(1.School of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China;2.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China;3.Beijing Biomass Energy Technology Center,State Grid Energy Conservation Service Ltd.,Beijing 100053,China)
One β-glucosidase producing strain was selected from various soil samples and dyeing wastewater by using esculin agar plate screening method with the aim to study and develop alkaline microbial origin βglucosidase resources,and the microbiology identification,fermentation properties and enzyme characterization of the isolated strain were further studied.The isolated strain was identified as Bacillus sp.,and the optimum growth and enzyme production temperatures was between 35~37℃,and the optimum growth and enzyme production pH were at 9.5 and 9.0,respectively.The optimum temperature and pH of the produced enzyme was 50℃and 9.5,respectively,and the enzyme was stable at temperatures below 50℃and in a pH range of 9.0~10.0.Mental ions,such as Cu2+,Fe2+,Ca2+and Mn2+showed some inhibition to the enzyme,Mg2+,Zn2+and Co2+have no significantly effect on the catalytic activity of the enzyme.The results obtained in the study were meaningful for microbial resources and information consolidation of alkaline β-glucosidase producing strain.
alkaline β-glucosidase;screening;enzyme characterization
TS201.1
A
1002-0306(2016)02-0180-06
10.13386/j.issn1002-0306.2016.02.028
2015-05-11
李松(1980-),男,博士,研究方向:發酵工程、工業微生物遺傳育種,E-mail:lisong821123@126.com。
安徽省自然科學青年基金資助項目(1408085QC61);安徽工程大學引進人才科研啟動基金(2013YQQ003);國家電網公司科技項目資助(合同號:SGECS56-2014)。

