云南省馬鈴薯黑痣病病原菌融合群鑒定及8種藥劑對其的毒力
劉 霞, 馮 蕊, 高達芳, 王東岳, 楊艷麗
(云南農業大學植物保護學院, 云南省植物病理重點實驗室, 昆明 650201)
?
云南省馬鈴薯黑痣病病原菌融合群鑒定及8種藥劑對其的毒力
劉霞,馮蕊,高達芳,王東岳,楊艷麗*
(云南農業大學植物保護學院, 云南省植物病理重點實驗室, 昆明650201)
由立枯絲核菌引起的馬鈴薯黑痣病是一種常見的土壤和種薯傳播病害,在世界各地均有發生。本試驗對分離純化的67個絲核菌菌株進行融合群測定,結果表明:67個菌株都屬于AG3融合群;對其中來自6個不同地域的11個菌株進行ITS測定, 11個菌株的相似度為99%。8種藥劑對馬鈴薯黑痣病菌的毒力測定結果表明,20%氟胺·嘧菌酯水分散粒劑50 mg/L和25 g/L咯菌腈懸浮種衣劑50 mg/L的抑菌效果較好,室內抑菌效果可達100%。
馬鈴薯黑痣病;融合群;毒力測定
馬鈴薯黑痣病是世界范圍內的病害,世界各地均有不同程度的發生。20世紀70年代以來,日本、歐美的發達國家就已經十分重視對此病的研究,并有過不少相關報道[1-2]。在國內,彭文學等[3]研究發現河北省有馬鈴薯黑痣病,而且是幾種常見的真菌病害之一。
馬鈴薯黑痣病又稱立枯絲核菌病、莖基腐病、絲核菌潰瘍病、黑色粗皮病,是由立枯絲核菌(RhizoctoniasolaniKühn)引起的一種土傳真菌病害。關于絲核菌(尤其是立枯絲核菌)的分類,Parmeter等[4]在1969年系統地提出了Rhizoctoniasolani種內的融合群(anastomosis group)分類法,將歐洲、北美、澳大利亞等地的138個分離菌株歸為4個融合群,記為AG1~AG4。隨后, Ogoshi[5]、李華榮[6]對立枯絲核菌進行了系統的描述,在此基礎上,根據融合群頻率、硫胺素需求、同工酶譜、致病性、DNA堿基同源性和培養性狀等特性將其劃分為不同亞群。到目前為止,立枯絲核菌已被劃分為14個融合群,分別命名為AG1~AG13和AG-BI[6-7]。從分布上看,AG1~AG4在全世界均有分布,AG7和AG-BI主要分布于亞洲的日本,AG6主要分布于日本和以色列,AG8分布于中國和澳大利亞。雖然立枯絲核菌的融合群遍布于全世界,但是局部地區的融合群種類卻很單一。某一地區的絲核菌病害,基本是由同一融合群所引起,雖然從同一個病株上可以分離出很多種類的融合群[8],但其致病融合群均為同一種。AG3融合群寄主范圍較小,馬鈴薯為其最適宜寄主[9]。Carling等[7]從馬鈴薯病株上分離到AG3、AG2-1和雙核絲核菌,對其分析表明,AG3為主要致病融合群。除AG3外,AG1、AG2、AG4、AG5、AG7和AG9等也在馬鈴薯黑痣病的報道中出現過[10-14]。王東岳等[15]報道,云南省馬鈴薯主產區昆明、曲靖、昭通、麗江、迪慶、大理、宣威等地均有黑痣病的發生,其中昆明地區馬鈴薯黑痣病發病最嚴重,發病率達到36%,發病最輕的宣威市發病率亦達到12%。由此可見,馬鈴薯黑痣病在云南省普遍發生,危害日益加重,對云南省馬鈴薯黑痣病病菌的融合群進行鑒定,并篩選出有效的殺菌劑十分必要。
1 材料與方法
1.1供試菌株
馬鈴薯黑痣病菌菌株采自云南省昆明市、麗江市、大理白族自治州、迪慶藏族自治州、昭通市等10個市(州)的41個采集點,共95個樣品,經分離純化共得到67株菌株,包括8株從地上莖(白霉)純化的菌株和59株從地下薯塊(黑痣)純化的菌株;立枯絲核菌標準菌株(代號為B)屬于AG3融合群,由云南農業大學楊根華教授饋贈。
1.2主要試劑
引物:ITS引物由上海生工生物工程有限公司合成;DNA marker購自北京全式金生物技術有限公司;馬鈴薯葡萄糖瓊脂培養基(PDA):馬鈴薯200 g,瓊脂粉17 g,葡萄糖20 g,蒸餾水1 000 mL,高壓滅菌(102.9 kPa, 30 min);2%水瓊脂培養基(WA):20 g瓊脂,1 000 mL水,高壓滅菌。
1.3供試藥劑
70%甲基硫菌靈可濕性粉劑,日本曹達株式會社;70%噁霉靈可濕性粉劑,青島海納生物科技有限公司;25 g/L咯菌腈懸浮種衣劑,瑞士先正達作物保護有限公司;20%氟胺·嘧菌酯(10%氟酰胺,10%嘧菌酯)水分散粒劑,美國世科姆公司;500 g/L異菌脲懸浮劑,拜耳作物科學(中國)有限公司;60%霜脲·嘧菌脂水分散粒劑,美國世科姆公司;20%辣根素水乳劑(20%異硫氰酸烯丙酯,ATTC),中國農業大學種苗健康北京市工程研究中心提供;10億/mL芽胞桿菌水劑,南京新果園生態農業科技有限公司。
1.4菌絲融合群測定
1.4.1對峙培養法進行融合群測定
馬鈴薯黑痣病菌融合群的測定參照陳延熙等的載玻片配對法[16]并加以改進(將載玻片改為效果更加明顯的玻璃紙)。菌絲融合類型采用Sneh的融合群標準[17],分為①完全融合:接觸的細胞細胞壁溶解,原生質體融合,相互之間具有吸引現象;②完全不融合:細胞壁不溶解,兩菌互不干擾,交叉而過;③不完全融合:接觸的細胞細胞壁溶解,其中一個細胞的細胞質流入另一個細胞內,引起雙方融合,同時可引起接觸細胞周圍的細胞死亡或者畸形生長,有殺死反應,一方引誘另一方。如果菌絲間能完全融合或不完全融合則被視為同一融合群,根據標準菌株與被測菌株的融合反應鑒定供試菌株的融合群類型。每菌株重復3次。
1.4.2ITS序列分析驗證融合群類型
選取11株來自不同地域,與標準菌株屬于同一融合群的菌株進行ITS序列測定,進一步檢驗菌株的融合群類型。
1.4.2.1供試菌株DNA的提取
所有供試菌株先在PDA平板上25 ℃培養3 d,取直徑為5 mm的菌盤塊轉移到鋪有無菌玻璃紙的PDA平板中央,25 ℃培養4 d,收集玻璃紙上層菌絲,采用改進的CTAB方法[18]提取馬鈴薯黑痣病病菌的基因組DNA。
1.4.2.2供試菌株的ITS序列擴增及測定
采用真菌通用引物ITS1/ITS4對馬鈴薯黑痣病病菌不同融合群ITS區域進行PCR擴增,并將擴增產物送華大基因公司進行純化測序,根據測序結果分析馬鈴薯黑痣病病菌不同融合群菌株間系統演化關系。
1.4.2.3序列分析
將測得的11個菌株的ITS序列在NCBI中進行BLAST,同時分別下載7條同源序列,與測定的序列組成原始數據組。運用MEGA 5.05,采用鄰接法構建系統發育樹,進行融合群的分析及確定。
1.4.38種藥劑對馬鈴薯黑痣病病菌的毒力測定
采用生長速率法[19]測定供試的8種藥劑對馬鈴薯黑痣病病菌的毒力。每種藥劑設3個濃度,每個濃度重復3次,同時以不加藥劑的PDA培養基作對照。25℃培養3 d后用十字交叉法測量菌落直徑,以平均菌落直徑代表菌落大小,計算菌落生長抑制率。
抑制率(%)=(對照組菌落直徑-處理組菌落直徑)/(對照組菌落直徑-菌餅直徑)×100。
選取抑制效果較好的3種藥劑對來自不同地域的16個菌株進行毒力測定,確定不同地域之間存在的差異,方法同上。
2 結果與分析
2.1馬鈴薯黑痣病病菌融合群測定
2.1.1對峙培養結果
供試菌株分別與標準菌株進行對峙培養的結果表明,67個菌株均能與標準菌株部分或全部融合,屬于AG3融合群。
馬鈴薯黑痣病病菌菌絲完全融合分為兩種情況,一是兩個菌絲之間產生連接點,將兩個菌絲連接到一起,可以看做是點融合(圖1a);另一種是兩個菌絲全部緊貼融合在一起,可以看做是面融合(圖1b)。可以看出,無論是哪一種融合現象,兩種菌絲之間具有親和性,可以融合到一起,均屬于AG3融合群。

圖1 馬鈴薯黑痣病病菌的菌絲融合Fig.1 Hyphal fusion reaction of Rhizoctonia solani isolates from potato
2.1.2ITS序列分析結果
從對峙試驗得到的AG3融合群菌株中挑選出6個不同地域的共11個菌株以及標準菌株(代號為B)進行ITS測序,其中2-2號、3號和7號來自麗江市;12號、23號和64號來自昆明市;28號來自保山市;32號來自西雙版納傣族自治州;34號和X1號來自臨滄市;48號來自迪慶藏族自治州。ITS測序結果顯示,選取的11個菌株ITS序列與GenBank上已知絲核菌AG3的序列相似度達到99%以上,其中64號、23號、12號、X1號、48號菌株和供試的標準菌株與GenBank上編號為AB905378.1的AG3菌株的相似度達到了99%;28號、32號、34號、2-2號菌株與GenBank上編號為AB905383.1的AG3菌株的相似度為99%;3號菌株和7號菌株與GenBank上編號為AB905384.1的AG3菌株的相似度達到了100%,結合平板對峙培養結果分析,可以確定所有菌株均屬于融合群AG3。
將這11個菌株、標準菌株和在GenBank上挑選出的7個已知菌株[包括5條AG3菌株的序列:AB905378.1、AB905383.1、AB905386.1、AB905389.1和AB905384.1以及一條AG1(JQ692294.1)和一條AG4(JF699278.1)的序列]共計19條序列進行比對、調整、刪減后以鄰接法構建系統發育樹。由圖2可知,平板對峙培養鑒定出的11個菌株、標準菌株以及GenBank上挑選出的5個已知AG3菌株分屬于相同的分支,可以確定這些菌株均為AG3,從而驗證了對峙培養測定的準確性。因此云南省馬鈴薯黑痣病病菌最主要的融合群為AG3,對峙培養法是測定融合群類型最簡單,有效的方法。
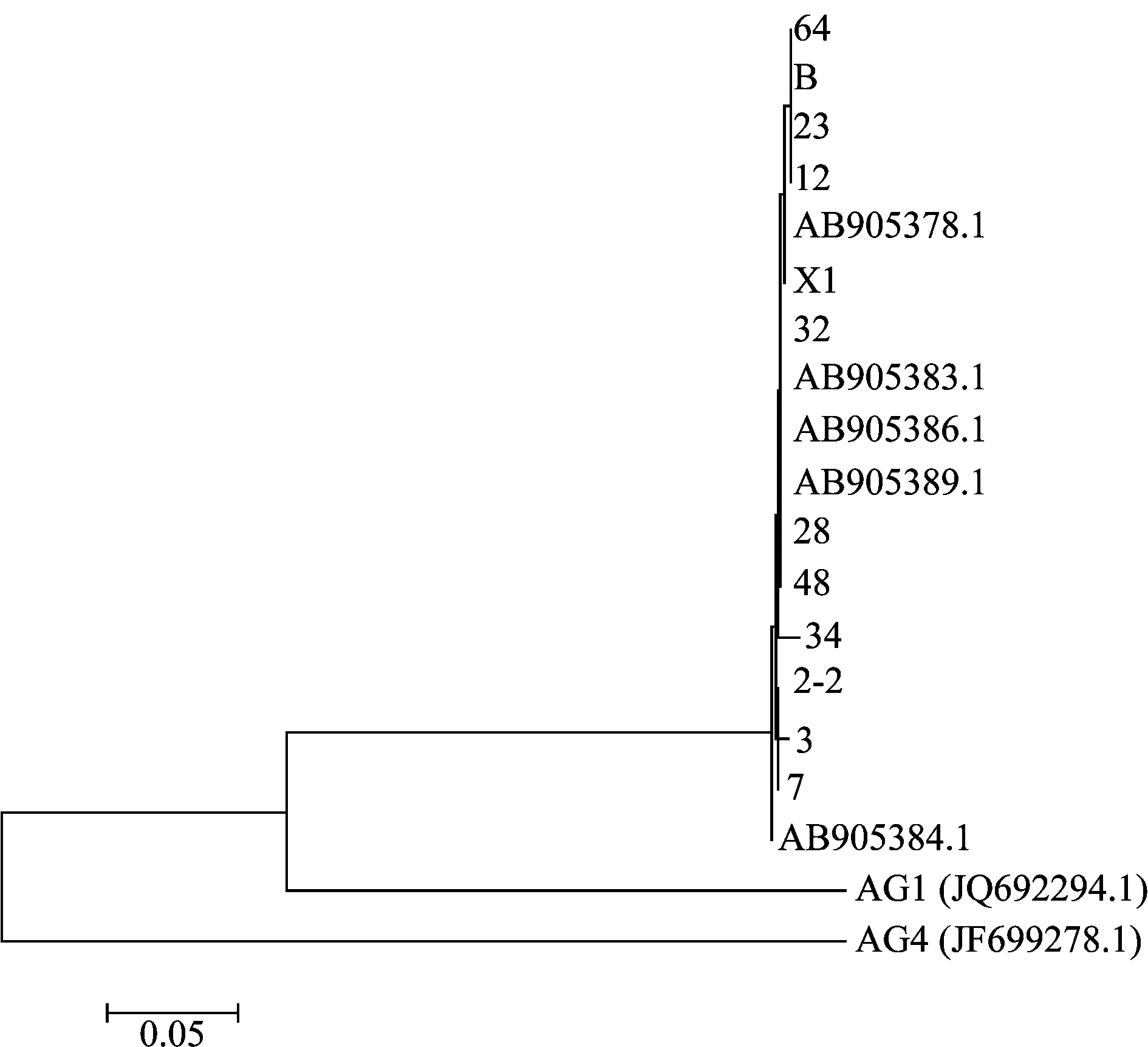
圖2 基于ITS序列的云南省馬鈴薯黑痣病病菌 融合群代表菌株的系統發育樹Fig.2 Phylogenic tree based on the ITS sequences of representative strains from different regions
2.28種藥劑對馬鈴薯黑痣病病菌的毒力測定
每種藥劑根據建議濃度范圍設定3個濃度,每個濃度重復3次,結果表明20%氟胺·嘧菌酯水分散粒劑50 mg/L、25 g/L咯菌腈懸浮種衣劑50 mg/L、70%甲基硫菌靈可濕性粉劑150 mg/L、20%辣根素水乳劑(ATTC)200 mg/L、500 g/L異菌脲懸浮劑100 mg/L對馬鈴薯黑痣病病菌具有抑制作用,其中20%氟胺·嘧菌酯水分散粒劑50 mg/L和25 g/L咯菌腈懸浮種衣劑50 mg/L抑制率達到100%,70%甲基硫菌靈可濕性粉劑150 mg/L抑制率37.8%,20%辣根素水乳劑(ATTC)200 mg/L和500 g/L異菌脲懸浮劑100 mg/L的抑制率分別為14.4% 和6.7%,其他供試藥劑和濃度的抑菌效果不明顯(表1)。因此,選擇20%氟胺·嘧菌酯水分散粒劑50 mg/L、25 g/L咯菌腈懸浮種衣劑50 mg/L和70%甲基硫菌靈可濕性粉劑150 mg/L對來自昆明、臨滄、保山、麗江等地的16個菌株進行毒力測定。
測定結果顯示,3種藥劑對16個絲核菌菌株具有很好的抑制效果,除了25 g/L咯菌腈懸浮種衣劑50 mg/L對25號的抑制率為31.0%,其他的抑制率均為100%(表2),因此,該3種農藥可以在上述地區使用。

表1 8種藥劑對馬鈴薯黑痣病病菌的毒力Table 1 Toxicity of eight fungicides on black scurf of potato

表2 3種藥劑對絲核菌不同菌株的抑制效果Table 2 Inhibition effect of three fungicides to different strains of Rhizoctonia solani
3 討論與結論
3.1融合群比對
通過對67株馬鈴薯黑痣病病菌融合群的鑒定得出,云南省馬鈴薯黑痣病病菌的融合群為單一的AG3融合群,這與其他地區的鑒定結果不盡相同。Carling等[20]、Lehtonen等[13]和Yanar等[21]研究馬鈴薯黑痣病病菌融合群時發現,雖有AG2-1、AG5或AG6等融合群出現,但AG3仍為其主要融合群。有研究人員調查發現馬鈴薯和魔芋為AG3融合群菌株的最適寄主, AG2融合群的菌株則易感染十字花科作物,這可能是AG3為馬鈴薯黑痣病病菌的主要致病融合群的原因之一[8]。據報道,采自不同國家的馬鈴薯黑痣病病菌融合群種類也存在差異,其中,土耳其為AG1~AG3、AG5、AG8~AG10和AG13[22],美國阿拉斯加為AG1~AG8和AG BI[20],法國為AG2-1、AG3和AG5[1]。Chand等[11]研究發現AG2菌株僅從植株上分離得到,這說明馬鈴薯黑痣病病菌融合群分布與病原菌分離部位有關。本試驗的絲核菌菌株來源于兩部分,其中從地下薯塊共分離59個菌株,經鑒定均為AG3融合群;從地上莖共分離到8個菌株,也均為AG3融合群,表明目前在云南省馬鈴薯主要產區獲得的絲核菌均為AG3融合群,但由于調查區域和采集樣品的局限性,不能排除在云南省馬鈴薯產區存在其他融合群類型,因此需要進一步擴大調查范圍,最終明確云南省馬鈴薯黑痣病病菌融合群的類型和分布。
3.2毒力測定
馬鈴薯黑痣病作為世界性病害,受到地域、品種等諸多因子的影響,且具有土傳和種傳的特點,防治較為艱難,生產上還沒有抗馬鈴薯黑痣病的品種[21]。目前主要采用田間管理[21]、輪作倒茬[23]、化學防治[24]以及生物防治[25-27],其中最有效的依然是化學防治,化學防治常用的藥劑有戊菌隆、嘧菌酯、異菌脲、甲基立枯磷、甲基硫菌靈和代森錳鋅等[1,12,28]。栽種時可用多菌靈等內吸性殺菌劑浸種或咯菌腈、甲基硫菌靈等藥劑拌種[29]或用次氯酸鈉和甲基硫菌靈處理種薯[30]來防治。對塊莖防效較好的藥劑有甲基立枯磷和戊菌隆[31]。本研究測定了8種藥劑對馬鈴薯黑痣病病菌的毒力,結果顯示20%氟胺·嘧菌酯水分散粒劑50 mg/L、25 g/L咯菌腈懸浮種衣劑50 mg/L和70%甲基硫菌靈可濕性粉劑150 mg/L對云南各地區的黑痣病病原菌有較好的防效,可在大田進一步試驗驗證。Kataria等[28,32]對10組融合群進行了多種藥劑的毒力篩選,結果發現不同融合群對同一種藥劑的敏感性也存在較大差異,并且相同融合群(AG2-1或AG4)內的一些相同菌株對相同藥劑敏感性也存在明顯的不同[32]。同樣,對馬鈴薯黑痣病病菌的一些融合群(AG2-1、AG3、AG4和AG5)進行藥劑毒力測定及篩選時,相同融合群及其內部也存在很大的差異[1,13,33]。因此,應根據云南省馬鈴薯黑痣病病原菌的變化及時調整防治策略。
[1]Campion C, Chatot C, Perraton B, et al. Anastomosis groups, pathogenicity and sensitivity to fungicides ofRhizoctoniasolaniisolates collected on potato crops in France [J]. European Journal of Plant Pathology, 2003, 109(9): 983-992.
[2]James W C, McKenzie A R. The effect of tuber-borne sclerotia ofRhizoctoniasolaniKühn on the potato crop [J]. American Potato Journal, 1972, 49: 296-301.
[3]彭文學, 朱杰華. 河北省馬鈴薯真菌病害種類及分布[J]. 中國馬鈴薯, 2008, 22(1): 31-33.
[4]Parmeter J R, Sherwood R T, Platt W D. Anastomosis grouping among isolates ofThanatephoruscucumeris[J]. Phytopathology, 1969, 59(9): 1270-1278.
[5]Ogoshi A. Studies on the grouping ofRhizoctoniasolaniKühn with hyphal anastomosis and on the perfect stages of groups [J]. Bulletin of the National Institute of Agricultural Sciences C, 1976,30: 1-63.
[6]李華榮. 絲核菌的菌絲融合群及其遺傳多樣性研究的新進展[J]. 菌物系統, 1999, 18(1): 100-107.
[7]Carling D E, Baird R E, Gitaitis R D, et al. Characterization of AG-13, a newly reported anastomosis group ofRhizoctoniasolani[J]. Phytopathology, 2002, 92(8): 893-899.
[8]Anderson N A. The genetics and pathology ofRhizoctoniasolani[J]. Annual Review of Phytopathology, 1982, 20: 329-347.
[9]Lootsma M, Scholte K, 楊哲, 等. 土壤消毒與收獲方式對翌年馬鈴薯Rhizoctoniasolani病害發生的影響[J]. 國外農學-雜糧作物, 1997(2): 44-46.
[10]Sneh B, Jabaji-Hare S, Neate S, et al.Rhizoctoniaspecies: taxonomy, molecular biology, ecology, pathology, and control [M]. Dordrecht: Kluwer Academic Publishers, 1996.
[11]Chand T, Logan C. Cultural and pathogenic variation in potato isolates ofRhizoctoniasolaniin northern Ireland [J]. Transactions of the British Mycological Society, 1983, 81(3): 585-589.
[12]Virgen-Calleros G, Olalde-Portugal V, Carling D E. Anastomosis groups ofRhizoctoniasolanion potato in central México and potential for biological and chemical control [J]. American Journal of Potato Research, 2000, 77(4): 219-224.
[13]Lehtonen M J, Ahvenniemi P, Wilson P S, et al. Biological diversity ofRhizoctoniasolani(AG-3) in a northern potato-cultivation environment in Finland [J]. Plant Pathology, 2008, 57(1): 141-151.
[14]Abd Elsalam K A, Omar M R, Aly A A. First report ofRhizoctoniasolaniAG-7 on cotton in Egypt [J]. Journal of Phytopathology, 2010, 158(4): 307-309.
[15]王東岳, 劉霞, 楊艷麗, 等. 云南省馬鈴薯黑痣病大田發生情況及防控試驗[J]. 中國馬鈴薯, 2014, 28(4): 225-229.
[16]陳延熙,張敦華,段霞瑜,等.關于Rhizoctoniasolani菌絲融合分類和有性世代的研究[J].植物病理學報,1985,15(3):139-143.
[17]Sneh B, Burpee L, Ogoshi A. Identification ofRhizoctoniaspecies [M]. St. Paul, Minnesota: American Phytopathological Society, 1991: 18-78.
[18]B?ng U. Screening of natural plant volatiles to control the potato (Solanumtuberosum) pathogensHelminthosporiumsolani,Fusariumsolani,PhomafoveataandRhizoctoniasolani[J]. Potato Research, 2007, 50(2): 185-203.
[19]吳文君. 植物化學保護實驗技術導論[M]. 西安: 陜西科學技術出版社, 1988.
[20]Carling D E, Lcincr R H. Isolation and characterization ofRhizoctoniasolaniand binucleateR.solani-like fungi from aerial stems and subterranean organs of potato plants [J]. Phytopathology, 1986, 76(7): 725-729.
[21]Jeger M J, Hide G A, Van Den Boogert P H J F, et al. Pathology and control of soil-borne fungal pathogens of potato [J]. Potato Research, 1996, 39(3): 437-469.
[22]Yanar Y, Yilmaz G, Cesmeli I. Characterization ofRhizoctoniasolaniisolates from potatoes in Turkey and screening potato cultivars for resistance to AG-3 isolates [J]. Phytoparasitica, 2005, 33(4): 370-376.
[23]Bandy B P, Leach S S, Tavantzis S M. Anastomosis group 3 is the major cause ofRhizoctoniadisease of potato in Maine [J]. Plant Disease, 1988, 72(7): 596.
[24]Mulder A, Turkensteen L J, Bouman A. Perspectives of green-crop-harvesting to control soil-borne and storage diseases of seed potatoes [J]. Netherlands Journal of Plant Pathology, 1992, 98: 103-114.
[25]Gallou A, Cranenbrouck S, Declerck S.Trichodermaharzianumelicits defence response genes in roots of potato plantlets challenged byRhizoctoniasolani[J]. European Journal of Plant Pathology, 2009, 124(2): 219-230.
[26]董錦艷, 李銣, 張克勤. 粘帚霉屬真菌代謝物的研究進展[J]. 微生物學通報, 2006, 33(2): 124-131.
[27]Jager G, Velvis H. Biological control ofRhizoctoniasolanion potatoes by antagonists. 2. Sprout protection against soil-borneR.solanithrough seed inoculation withVerticilliumbiguttatum[J]. Netherlands Journal of Plant Pathology, 1984, 90(1): 29-33.
[28]Bains P S, Bennypaul H S, Lynch D R.Rhizoctoniadisease of potatoes (Rhizoctoniasolani): fungicidal efficacy and cultivar susceptibility [J]. American Journal of Potato Research, 2002, 79(2): 99-106.
[29]邱廣偉. 馬鈴薯黑痣病的發生與防治[J]. 農業科技通訊, 2009(6): 133-134.
[30]Errampalli D, Johnston H W. Control of tuber-borne black scurf (Rhizoctoniasolani) and common scab (Streptomycesscabies) of potatoes with a combination of sodium hypochlorite and thiophanate-methyl preplanting seed tuber treatment [J]. Canadian Journal of Plant Pathology, 2001, 23(1): 68-77.
[31]Wicks T J, Morgan B, Hall B. Chemical and biological control ofRhizoctoniasolanion potato seed tubers [J]. Australian Journal of Experimental Agriculture,1995,35(5):661-664.
[32]Kataria H R, Verma P R, Gisi U. Variability in the sensitivity ofRhizoctoniasolanianastomosis groups to fungicides [J]. Journal of Phytopathology, 1991, 133(2): 121-133.
[33]Woodhall J W, Lees A K, Edwards S G, et al. Infection of potato byRhizoctoniasolani: effect of anastomosis group [J]. Plant Pathology, 2008, 57(5): 897-905.
(責任編輯:楊明麗)
Anastomosis groups ofRhizoctoniasolaniand toxicity of eight fungicides againstR.solanifrom black scurf of potato
Liu Xia,Feng Rui,Gao Dafang,Wang Dongyue,Yang Yanli
(College of Plant Protection, Yunnan Provincial Key Laboratory of Plant Pathology,Yunnan Agricultural University, Kunming650201, China)
Black scurf of potato (RhizoctoniasolaniKühn) is a kind of soil-borne and tuber-borne disease. The disease occurs in potato production regions of world widely. Identification of anastomosis groups of 67 collected samples showed that all theR.solaniisolates belonged to AG3. ITS sequences analysis on 11 isolates from six regions demonstrated that the similarity of eleven strains was 99%. Toxicity bioassay of eight fungicides showed that 20%flutolanil+azoxystrobin WG and 25 g/L fludioxonil FSC had the strongest inhibition activity againstR.solani, with the control efficiency of 100%.
black scurf of potato;anastomosis group;toxicity
2015-01-13
2015-04-15
云南省現代農業馬鈴薯產業技術體系(2015KJTX003);云南省科技計劃項目(2013ZA006)
E-mail: zqccn@aliyun.com
S 435.32
A
10.3969/j.issn.0529-1542.2016.02.030

