大腸桿菌絲氨酸轉運系統單基因敲除對絲氨酸生產的影響
崔云風,石斌超,李 晶,趙志軍,史吉平,張 霞,*
(1.石河子大學生命科學學院,新疆石河子 832000;2.中國科學院上海高等研究院,上海 201210)
?
大腸桿菌絲氨酸轉運系統單基因敲除對絲氨酸生產的影響
崔云風1,石斌超1,李晶2,趙志軍2,史吉平2,張霞1,*
(1.石河子大學生命科學學院,新疆石河子 832000;2.中國科學院上海高等研究院,上海 201210)
氨基酸轉運系統改造是一種重要的氨基酸菌種選育方式。sdaC,cycA,sstT和tdcC是目前報道的大腸桿菌中與L-絲氨酸轉運吸收相關的四個基因,本研究以實驗室前期構建的L-絲氨酸工程菌SWCH-05為基礎,采用Red重組系統,分別構建了sdaC,cycA,sstT和tdcC單基因敲除菌,并通過補料分批發酵實驗考察了轉運吸收基因缺失對菌株產L-絲氨酸的影響。發酵結果表明,sdaC敲除菌L-絲氨酸產量達到了16.3 g/L,與出發菌株相比提高了43%,cycA敲除菌L-絲氨酸產量為14.1 g/L,與出發菌株相比提高了25%,而sstT和tdcC基因敲除菌的L-絲氨酸產量均與對照菌相近。
轉運系統,L-絲氨酸,大腸桿菌,基因敲除
目前,L-絲氨酸(L-serine,L-Ser)已廣泛應用于食品、化妝品、飼料、醫藥等行業[1-2]。發酵法生產L-Ser具有原料廉價、易提取等優點,其代謝工程育種研究獲得了廣泛關注[3-5]。
氨基酸轉運系統改造是新發展起來的一種氨基酸育種方式,其通過提高胞內目的氨基酸的分泌速率或者降低胞外目的氨基酸的吸收速率,可以提高菌株的氨基酸生產強度;還可以使胞內目的氨基酸的濃度一直保持在較低水平,進而減弱或規避各種復雜的反饋調控作用,促進氨基酸的合成。近年來,關于蘇氨酸、賴氨酸和丙氨酸等氨基酸轉運系統的研究結果表明,氨基酸轉運系統改造已經成為了氨基酸代謝工程策略的一種重要手段[6-10]。
目前L-Ser轉運系統的研究仍處于生化與分子鑒定的階段,但已經發現了數個與L-Ser轉運相關的蛋白,如:轉運蛋白SdaC被認為是專一性調控L-Ser的吸收[11-12],轉運蛋白CycA同時參與調控細胞對L-Ala、L-Gly和L-Ser的吸收[13];轉運蛋白SstT同時調控L-Thr和L-Ser的吸收[14];而透酶TdcC主要負責L-Thr的吸收,但在厭氧條件下也參與L-Ser的吸收轉運[15-16]。此外,對于L-Ser的分泌轉運系統,目前僅研究發現負責L-Thr分泌的轉運蛋白ThrE同時也參與調控L-Ser的分泌[17]。
本研究以實驗室前期構建的L-Ser基因工程菌SWCH-05為出發菌株,利用Red重組技術分別構建了L-Ser吸收轉運蛋白編碼基因sdaC,cycA,sstT和tdcC的單基因敲除菌,并通過發酵實驗考察了L-Ser轉運系統基因敲除對菌體生長及L-Ser生產的影響。
1 材料與方法
1.1材料與儀器
菌株SWCH-01是大腸桿菌模式菌株E.coliW3110的sdaA基因敲除菌;菌株SWCH-05是實驗室前期誘變篩選獲得的一株E.coliSWCH-01衍生菌株;質粒pSC-05是攜帶抗反饋調節基因serAfbr(feedback inhibition-resistant)和其它3個大腸桿菌絲氨酸合成途徑關鍵酶基因serB、serC和pgk的低拷貝,具有PR和PL雙啟動子的原核表達質粒;SWCH-05/pSC-05由實驗室前期通過基因工程手段構建(數據另文發表)。敲除所需的工具質粒pKD13,pKD46和pCP20購自美國耶魯大學大腸桿菌菌株庫(E.coliGenetic Stock Center,New Haven,USA)[17],本研究所用到的菌株和質粒具體見表1;>Primer STAR HS DNA聚合酶、Taq DNA聚合酶(Mix)均購自大連寶生物有限公司;DNA Ladder Mix購自Fementas公司;氨芐青霉素、硫酸卡那霉素購自上海捷倍思基因技術有限公司;質粒小量制備試劑盒、細菌基因組提取試劑盒、PCR清潔試劑盒購自AxyPrep公司;L-Ser標準品、異硫氰酸苯酯購自Sigma公司;其他化學試劑購于國藥集團化學試劑有限公司;常規試劑采用國產分析純;引物合成和測序由蘇州金唯智生物科技有限公司完成。
Gel Dox XR+凝膠成像系統、S1000PCR儀、電轉儀MicroPulser美國BIO-RAD公司;DU730型紫外分光光度計德國Beckman公司;ZHWY-2102C恒溫培養振蕩器上海智城儀器制造有限公司;Centrifuge5430低溫離心機德國Eppendorf公司;MLS-3780型高壓蒸汽滅菌鍋日本三洋公司;高效液相色譜儀RID-10A/SPD-20A日本島津公司。

表1 實驗用菌株和質粒Table 1 Strains and plasmids used in the experiment
1.2實驗方法
1.2.1引物設計根據大腸桿菌W3110基因組序列,分別設計四對敲除引物sdaC _p1和sdaC _p2,cycA _p1和cycA_p2,sstT_p1和sstT_p2,tdcC_p1和tdcC_p2,其中下劃線部分為目標基因上下游各50 bp的同源臂序列,以質粒pKD13 DNA為模板,分別擴增1403 bp目標基因打靶DNA片段。選取大腸桿菌W3110基因組中目標基因上游和下游的某段DNA序列作為鑒定目標基因敲除的引物。引物k1和k2分別為質粒pKD13中Kan基因內部序列。本研究所用引物的DNA序列如表2所示。
1.2.2大腸桿菌基因的敲除采用Red同源重組的方法分別敲除sdaC,cycA,sstT和tdcC四個基因,具體操作方法參照文獻[19]。
1.2.3培養基的配制種子培養基為LB培養基:10 g/L Typtone,5 g/L Yeast extract,10 g/L NaCl。發酵培養基組分包括:3 g/L MgSO4·7H2O,0.017 g/L CaCl2·2H2O,8 g/L葡萄糖和3 g/L KH2PO4,1 g/L NaCl,5 g/L(NH4)2SO4,0.07 g/L FeSO4·7H2O,0.11 g/L檸檬酸鈉,0.2 g/L酵母膏,1.5 mL/L微量元素液1000×母液(7 g/L CoCl2·6H2O,2.5 g/L CuSO4·5H2O,25 g/L H3BO,16 g/L MnCl2·4H2O,1.5 g/L Na2MoO4·2H2O,3 g/L ZnSO4·7H2O)。
1.2.4發酵培養種子培養:挑取單菌落至裝有50 mL LB培養基的250 mL三角瓶中,30 ℃,200 r/min培養8~10 h。發酵罐發酵培養:以10%(v/v)的比例轉接種子培養液至裝有2.5 L發酵罐培養基中發酵。發酵初始溫度為35 ℃,當菌體生長至對數生長期前期時,升溫至38 ℃開始誘導培養產L-Ser。當發酵液中初始葡糖糖基本耗盡時,開始流加600 g/L的葡萄糖溶液,并調控流速使發酵液中的葡萄糖濃度小于5 g/L。發酵過程中,通過流加濃氨水使培養基pH保持在pH6.8~7.0。

表2 本研究使用的引物Table 2 Primers used in the experiment
注:下劃線部分為目標基因上下游各50 bp的同源臂序列。
1.2.5測定方法發酵液中的菌體密度以600 nm波長下分光光度計檢測的吸光值OD600 nm表示,細胞干重根據前期構建的經驗公式獲得(1OD=0.492 g/L CDW)。
發酵液中的葡萄糖濃度采用高效液相色譜測定[20]。
本研究采用高效液相色譜異硫氰酸苯酯(PITC)柱前衍生法檢測發酵液中L-絲氨酸的含量,具體衍生方法參照文獻[21]。
分析條件:發酵液中的L-Ser濃度通過島津LC-20A測定。采用的色譜柱為:Agilent Extend C18(250 mm×4.6 mm,5 μm)色譜柱。流動相為:(A)0.05 mol/L乙酸鈉(pH為6.50±0.05)和(B)甲醇∶乙腈∶水(20∶60∶20),流速為1 mL/min。梯度洗脫程序為:0~12 min,流動相(B)濃度保持7%;12~13 min流動相(B)濃度由7%升至100%;流動相(B)濃度保持100%至18 min,18~19 min流動相(B)濃度由100%降至7%,19~25 min流動相(B)濃度保持7%,回到初始條件。使用紫外檢測器檢測標樣及樣品中L-Ser在254 nm的吸收峰值,進樣體積10 μL,柱溫45 ℃。
1.2.6數據處理方法每個實驗重復三次,實驗數據采用SPSS 17.0軟件進行顯著性分析,采用Origin 7.0軟件作圖。
2 結果與分析
2.1sdaC,cycA,sstT,tdcC單基因敲除菌的構建
將E.coliSWCH-05作為研究對象,在其基因組上分別敲除L-Ser轉運吸收基因sdaC,cycA,sstT和tdcC。以質粒pKD13 DNA為模板,通過引物sdaC_p1和sdaC_p2擴增得到打靶PCR片段sdaCD50-Kan-sdaCD50,將PCR片段轉化至E.coliSWCH-05/pKD46的感受態細胞中,同源重組后在Kan抗性平板上初步篩選基因sdaC的敲除突變株。分別通過兩對引物sdaC_v1和k1,k2和sdaC_v2對sdaC敲除突變菌進行菌落PCR鑒定。依據敲除原理,當sdaC基因敲除后,其基因組經PCR擴增后可分別獲得1218 bp和1299 bp的PCR片段。DNA凝膠電泳的結果與理論值大小相符,表明基因sdaC已經被Kan基因所置換(圖1a,泳道1~2)。基因cycA,sstT和tdcC的敲除方法與sdaC類同,分別通過其相應的兩對鑒定引物進行菌落PCR鑒定后,發現其各自DNA凝膠電泳的結果與理論值大小相符,表明基因cycA,sstT和tdcC已分別被Kan基因所置換(圖1b,c,d的泳道1~2)。

圖1 大腸桿菌sdaC、cycA、sstT、tdcC基因敲除的PCR分析Fig.1 Identification of the sdaC,cycA, sstT,tdcC knockout strain by PCR 注:M:Marker;(a)Lane 1:sdaC_v1→k1;Lane 2:k2→sdaC_v2;Lane3:sdaC_v1→sdaC_v2;(b)Lane 1:cycA_v1→k1;Lane2:k2→cycA_v2;Lane3:cycA_v1→cycA_v2;(c)Lane1:sstT_v1→k1;Lane2:k2→sstT_v2;Lane3:sstT_v1→sstT_v2;(d)Lane1:tdcC_v1→k1;Lane 2:k2→tdcC_v2;Lane3:tdcC_v1→tdcC_v2。
將質粒pCP20轉化至sdaC基因被Kan置換的菌株中,誘導FLP重組酶表達,消除其Kan抗性基因,利用引物sdaC_v1和sdaC_v2進行菌落PCR根據序列分析,Kan基因消除后,PCR擴增應獲得1406 bp的DNA片段。DNA凝膠電泳的結果與理論值相符(圖1a,泳道3)。將PCR片段膠回收后連接至 pMD19-T載體后送測序,測序結果表明sdaC基因敲除正確,命名sdaC敲除菌為SWCH-51。利用同樣的方法消除cycA,sstT和tdcC三個基因敲除菌中的Kan抗性基因,菌落PCR鑒定后,DNA凝膠電泳的結果與理論值大小相符(圖1b,c,d的泳道3)。經測序證明cycA,sstT和tdcC基因敲除均正確,分別命名三個基因敲除菌為SWCH-52、SWCH-53、SWCH-54。
2.2L-絲氨酸基因工程菌的構建
將攜帶L-絲氨酸合成途徑關鍵酶基因的質粒pSC-05分別轉化至大腸桿菌L-絲氨酸吸收系統基因敲除菌SWCH-51、SWCH-52、SWCH-53和SWCH-54中構建L-絲氨酸基因工程菌SWCH-51/pSC-05、SWCH-52/pSC-05、SWCH-53/pSC-05、SWCH-54/pSC-05。
2.3L-絲氨酸基因工程菌的補料分批發酵
為了考察L-Ser吸收系統基因敲除對菌體發酵產L-Ser的影響,在5 L發酵罐中分別對對照菌SWCH-05/pSC-05及構建的基因工程菌SWCH-51/pSC-05、SWCH-52/pSC-05、SWCH-53/pSC-05和SWCH-54/pSC-05進行了補料分批發酵。結果表明:與對照菌相比(圖2),當敲除基因sdaC,sstT或tdcC時,菌體的生長未受到明顯的影響;但當敲除基因cycA時,菌體的最高OD600 nm達到58,與對照菌相比提高了28%,改善了菌體的生長情況(圖3b)。這是因為SdaC、CycA、SstT和TdcC四個轉運蛋白同時控制著L-Ser以及L-Thr和L-Ala等幾種氨基酸的吸收,而氨基酸是菌體組成的基本單位,因此其基因的敲除必然會不同程度地影響菌體的生長。
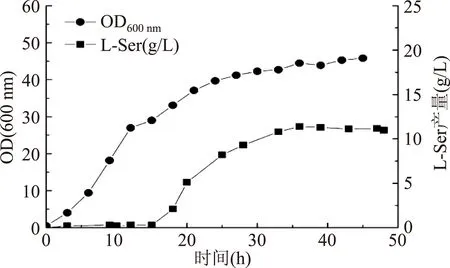
圖2 菌株SWCH-05/pSC-05的補料分批發酵Fig.2 Fed-batch fermentation of E. coli SWCH-05/pSC-05
在L-Ser生產方面,當敲除sstT或tdcC時,菌株發酵的L-Ser產量分別為12.2 g/L 和11.6 g/L,與對照菌11.3 g/L 相近;當敲除基因cycA時,L-Ser產量為14.1 g/L,與對照菌相比提高了25%;當敲除基因sdaC時,L-Ser產量提高至16.3 g/L,與對照菌相比提高了43%(圖3a)。這可能是由于SdaC專一性調控L-Ser吸收,而其他三個轉運蛋白同時調控著2~3種氨基酸的吸收,因此sdaC基因的敲除對菌株產L-Ser的影響更大。

圖3 菌株 BJ-02/pSC-05的補料分批發酵 Fig.3 Fed-batch fermentation of E. coli SWCH-51/pSC-05(a)、SWCH-52/pSC-05(b)、 SWCH-53/pSC-05(c)、SWCH-54 pSC-05(d)
3 結論
本文首次考察了與L-Ser吸收相關的4個基因sdaC,cycA,sstT和tdcC的缺失突變對菌株發酵產L-Ser的影響。結果表明sdaC的敲除可以明顯促進菌體積累L-Ser;cycA的敲除對菌體積累L-Ser的影響次之;而其它兩個基因的敲除對L-Ser的產量基本沒有影響。這為進一步考察L-Ser吸收轉運系統的多基因缺失突變對菌體積累L-Ser的影響奠定了基礎。
本研究初步考察L-Ser轉運系統基因敲除對菌株積累L-Ser的影響,未來仍可從以下幾個方面進行深入的研究:a.L-Ser轉運基因的鑒定。本研究涉及的sdaC等四個基因主要是依據其生理生化特征發現與L-Ser轉運相關,仍缺乏分子層次上的鑒定;此外仍需探索是否存在其它尚未鑒定的L-Ser轉運系統基因。b.L-Ser轉運系統作用機制的研究。有些L-Ser轉運系統蛋白同時調控幾個氨基酸的吸收或分泌,作為菌體細胞基本單位的氨基酸必然會影響菌體的正常生理代謝活動,這種情況下除考察其對L-Ser積累的影響外,還應該考察其對其它氨基酸轉運的影響,進而探究菌體生理代謝活動的變化機制。c.L-Ser轉運蛋白間的協同效應。本研究考察了sdaC等四個轉運蛋白的單基因缺失對菌株積累L-Ser的影響,仍可以通過構建其多基因敲除菌考察上述四個基因之間的協同效應。
[1]劉巖,王慧,史吉平,等. 微生物法生產L-絲氨酸代謝工程研究進展[J].生物技術通報,2015,31(8):44-49.
[2]周芳,李洪軍,楊復習,等. 磷脂酰絲氨酸研究進展[J].食品工業科技,2008(5):297-300.
[3]Gu P,Yang F,Su T,et al. Construction of an L-serine producing Escherichia coli via metabolic engineering[J]. Journal of Industrial Microbiology & Biotechnology,2014,41(9):1443-1450.
[4]Xu G,Jin X,Guo W,et al. Characterization,modification,and overexpression of 3-phosphog-lycerate dehydrogenase in Corynebacterium glutamicum for enhancing L-serine production[J]. Annals of Microbiology,2014,65(2):929-935.
[5]賈慧慧,李曉靜,陳濤,等. 微生物發酵法生產 L-絲氨酸及L-半胱氨酸研究進展[J]. 中國生物工程雜志,2014,34(5):100-106.
[6]Burkovski A,Kr?mer R. Bacterial amino acid transport proteins:occurrence,functions,and significance for biotechnological applications[J]. Applied Microbiology and Biotechnology,2002,58(3):265-274.
[7]Lee K H,Park J H,Kim T Y,et al. Systems metabolic engineering of Escherichia coli for L-t hreonine production[J]. Molecular Systems Biology,2007,3(1):149.
[8]Vrljic M,Sahm H,Eggeling L. A new type of transporter with a new type of cellular function:l-lysine export from Corynebacterium glutamicum[J]. Molecular Microbiology,1996,22(5):815-826.
[9]Hori H,Yoneyama H,Tobe R,et al. Inducible L-alanine exporter encoded by the novel gene ygaW(alaE)in Escherichia
coli[J]. Applied and Environmental Microbiology,2011,77(12):4027-4034.
[10]趙志軍,陳晟,吳丹,等. 大腸桿菌色氨酸轉運系統單基因敲除對色氨酸生產的影響[J].生物工程學報,2011,27(12):1765-1772.
[11]Shao Z Q,Lin R T,Newman E B. Sequencing and characterizeation of the sdaC gene and identification of the sdaCB operon inEscherichiacoliK12[J]. European Journal of Biochemistry,1994,222(3):901-907.
[12]Hsieh J M,Besserer G M,Madej M G,et al. Bridging the gap:A GFP-based strategy for overexpression and purification of membrane proteins with intra and extracellular C-termini[J]. Protein Science,2010,19(4):868-880.
[13]Schneider F,Kr?mer R,Burkovski A. Identification and characterization of the mainβ-alanine uptake system inEscherichiacoli[J]. Applied Microbiology and Biotechnology,2004,65(5):576-582.
[14]Kim Y M,Ogawa W,Tamai E,et al. Purification,reconstitution,and characterization of Na+/serine symporter,SstT,of Escherichia coli[J]. Journal of Biochemistry,2002,132(1):71-76.
[15]Ogawa W,Kayahara T,Tsuda M,et al. Isolation and characterization of an Escherichia coli mutant lacking the major serine transporter,and cloning of a serine transporter gene[J]. Journal of Biochemistry,1997,122(6):1241-1245.
[16]Na D,Park J H,Jang Y S,et al. Systems metabolic engineering of Escherichia coli for chemicals,materials,biofuels,and pharmaceuticals[M]. Systems Metabolic Engineering. Springer Netherlands,2012:117-149.
[17]Simic P,Sahm H,Eggeling L. L-Threonine export:use of peptides to identify a new translocator from Corynebacterium glutamicum[J]. Journal of Bacteriology,2001,183(18):5317-5324.
[18]Baba T,Ara T,Hasegawa M,et al. Construction of Escherichia coli K-12 in-frame,single-gene knockout mutants:the Keio collection[J]. Molecular Systems Biology,2006,2(1):1-11.
[19]Zhao Z J,Zou C,Zhu Y X,et al. Development of L-tryptophan production strains by defined genetic modification in Escherichia coli[J]. Journal of Industrial Microbiology & Biotechnology,2011,38(12):1921-1929.
[20]Wang D,Zhou J,Chen C,et al. R-acetoin accumulation and dissimilation in Klebsiella pneumoniae[J].Journal of Industrial Microbiology and Biotechnology,2015,42(8):1105-1115.
[21]楊智,陽利龍,祝文兵,等. 異硫氰酸苯酯柱前衍生化RP-HPLC法測定人血漿中10種氨基酸的濃度[J]. 中國臨床藥理學與治療學,2011,16(5):549-552.
Effect of single-gene knockout of L-serine transport system on L-serine production inEscherichiacoli
CUI Yun-feng1,SHI Bin-chao1,LI Jing2,ZHAO Zhi-jun2,SHI Ji-ping2,ZHANG Xia1,*
(1.College of Life Science,Shihezi University,Shihezi 832000,China;2.Shanghai Advanced Research Institute of Chinese Academy of Sciences,Shanghai 201210,China)
Transport system modification is an important method in strain improvement. It has been reported that the uptake of L-serine was regulated by four genes ofsdaC,cycA,sstTandtdcCinEscherichiacoli. In this study,the four single-gene knockout mutant strains ofsdaC,cycA,sstTand tdcC were constructed,respectively. The fermentation results showed that thesdaCandcycAknockout mutants produced 16.3 g/L and 14.1 g/L L-serine,respectively,which were 43% and 25% higher than that of the control strain. However,the production ofsstTandtdcCmutants were both similar to the control strain.
transport system;L-serine;Escherichiacoli;gene knockout
2016-01-04
崔云風(1989-),男,碩士研究生,研究方向:氨基酸代謝工程,E-mial:cyfsdau@163.com。
張霞(1964-),女,教授,研究方向:植物資源與遺傳,E-mail:xiazh@shzu.edu.cn。
國家自然科學基金青年科學基金項目(31300048)。
TS201.3
A
1002-0306(2016)14-0191-05
10.13386/j.issn1002-0306.2016.14.030

