基于蛋白質組學方法研究左歸丸治療去卵巢所致骨質疏松癥大鼠的作用機制※
張 穎 李 涢 張 杰 劉梅潔 趙宏艷 潘靜華 鞠大宏
(首都醫科大學附屬北京潞河醫院中醫科,北京 101149)
?
基于蛋白質組學方法研究左歸丸治療去卵巢所致骨質疏松癥大鼠的作用機制※
張穎李涢1張杰1劉梅潔1趙宏艷1潘靜華1鞠大宏△
(首都醫科大學附屬北京潞河醫院中醫科,北京101149)
目的基于蛋白質組學方法研究左歸丸治療去卵巢所致骨質疏松癥大鼠的作用機制,進而為闡明“腎主骨”理論的科學內涵尋找實驗依據。方法將60只雌性Wistar大鼠隨機分為2組,正常對照組20只和造模組40只。造模組大鼠通過摘除雙側卵巢建立絕經后骨質疏松癥(PMOP)模型,正常對照組大鼠只摘取卵巢周圍的少許脂肪組織。手術2周后,再將40只造模組大鼠隨機分為模型組及左歸丸組,各20只。左歸丸組予左歸丸水煎劑灌胃,正常對照組及模型組予等容積蒸餾水灌胃。給藥3個月后,比較3組大鼠脛骨骨小梁體積百分比(TBV%)水平,取大鼠雙側股骨骨髓進行蛋白質雙向電泳并對電泳圖譜進行分析,篩選出左歸丸干預的相關蛋白,并進行質譜分析鑒定。結果模型組、左歸丸組大鼠脛骨TBV%水平低于正常對照組(P<0.05),左歸丸組大鼠脛骨TBV%水平高于模型組(P<0.05)。3組大鼠共篩選出23個差異蛋白質點,其中12個蛋白質點由于蛋白質分數不具有統計學意義而未得到鑒定,11個蛋白質點得到鑒定。檢索數據庫顯示10號差異蛋白質點alpha-enolase為α-烯醇化酶,其免疫組化法檢測顯示模型組α-烯醇化酶陽性表達密度高于正常對照組(P<0.05),而左歸丸組α-烯醇化酶陽性表達密度低于模型組(P<0.05),這與雙向凝膠電泳圖譜分析和質譜鑒定結果相一致。結論左歸丸可能通過調節骨髓內與細胞增殖、分化、代謝、凋亡及氧化反應等相關蛋白質來實現對PMOP的防治作用,這些差異蛋白質可能與PMOP的發生發展具有一定的相關性。
骨質疏松,絕經后;左歸丸;蛋白質組學;大鼠;動物;實驗
絕經后骨質疏松癥(postmenopausal osteoporosis,PMOP)是一種與衰老有關的常見病,主要發生于絕經后婦女,是由于雌激素缺乏導致的骨量減少,骨密度降低,骨結構變化,使骨脆性增加而易發骨折的一種代謝性疾病[1]。中醫學認為,腎藏精,主骨生髓,腎陽虛衰,則不能充骨生髓,腎陰虧損,精失所藏,不能養髓,致使骨松不健[2]。左歸丸是中醫具有代表性的補腎方劑之一,具有滋陰補腎、填精益髓的功效。本實驗在以往研究工作的基礎上[3],以卵巢切除大鼠作為PMOP動物模型,用左歸丸進行干預,采用蛋白質組學方法探索產生的具有調節作用相關蛋白,以期從蛋白水平揭示補腎方劑左歸丸對PMOP的作用機制,進而為闡明“腎主骨”理論的科學內涵提供進一步的實驗依據。
1 材料與方法
1.1實驗動物選用雌性無特定病原體(SPF)級Wistar大鼠60只,體質量190~220 g,由中國人民解放軍軍事醫學科學院實驗動物中心提供[許可證號:SCXK-(軍)2007-004],均在中國中醫科學院中醫基礎理論研究所清潔級實驗動物室內飼養[實驗動物室許可證號:SYXK(京)-2010-0032]。
1.2實驗藥物左歸丸方藥組成:熟地黃24 g,山藥12 g,枸杞子12 g,山茱萸12 g,牛膝9 g,菟絲子12 g,龜版膠12 g,鹿角膠12 g。常規水煎制濃縮,濃度為生藥0.968 g/mL。此藥物濃度按照人日用臨床劑量,經人-大鼠體表面積比值折算,濃縮8倍而成[4]。
1.3主要試劑及儀器
1.3.1試劑丙烯酰胺(美國Amrsco公司,批號:0341);甲叉雙丙烯酰胺(美國Amrsco公司,批號:0172);三(羥甲基)氨基乙烷(美國Amrsco公司,批號:0497);十二烷基硫酸鈉(美國Sigma公司,批號:L5750);乙二胺四乙酸二鈉(美國Amrsco公司,批號:0105);四甲基乙二胺(美國Amrsco公司,批號:0497);碘代乙酰胺(德國Merck公司,批號:8047440025);尿素(美國Amrsco公司,批號:0568);硫脲(美國Amrsco公司,批號:M-226);固相pH梯度干膠條(美國GE公司,批號:17-1234-01);IPG膠條緩沖液(美國GE公司,批號:71-5005-82);蛋白酶抑制劑(德國Roche公司,批號:04-693-124-001);血清白蛋白標準(美國GE公司,批號:17044601);Bradford法測定蛋白試劑盒(索萊寶科技有限公司);考馬斯亮藍R-350(美國GE公司,批號:17-0518-01)。
1.3.2儀器Ettan Daltm等電聚焦系統(美國GE公司);Ettan Daltsix垂直電泳系統(美國GE公司);UMAX 2100透射掃描儀(臺灣力廣科技股份有限公司);PE Lambda12紫外分光光度計(美國PerkinElmer公司);Microson超聲波細胞破碎儀(美國Misonix公司)。
1.4實驗方法
1.4.1動物分組及模型制作將60只雌性Wistar大鼠隨機分為2組,正常對照組20只和造模組40只。2組均采用戊巴比妥鈉腹腔注射麻醉后,造模組大鼠摘除雙側卵巢,正常對照組大鼠只摘取卵巢周圍的少許脂肪組織[5]。手術2周后,將40只造模組大鼠再隨機分為2組,模型組20只和左歸丸組20只。
1.4.2給藥方法分組后開始對大鼠灌胃給藥。左歸丸組按生藥9.68 g/kg予左歸丸水煎劑灌胃,每日1次,連續灌胃6 d,休息1 d后再連續灌胃給藥,每周稱質量1次,據此調整給藥量,共給藥3個月。正常對照組、模型組則按同法予等容積蒸餾水灌胃。
1.5觀察指標及方法
1.5.1骨小梁體積百分比(TBV%)檢測各組大鼠在處死前15 d及前3 d分別腹腔注射鹽酸四環素30 mg/kg,以對骨進行熒光標記[6]。給藥結束后,將各組大鼠處死,取大鼠右側脛骨置于4%多聚甲醛溶液中固定24 h,乙醇逐級脫水,二甲苯浸泡2 d。依次在塑料聚合液Ⅰ液、Ⅱ液、Ⅲ液中各浸泡3 d,隨后進行塑料包埋[7],制作不脫鈣骨切片,甲苯胺藍染色,以觀察骨小梁體積百分比(TBV%)變化。
1.5.2蛋白質提取取各組大鼠雙側股骨,置于-80 ℃保存備用。取股骨骨髓于eppendorf離心管中,加入0.5 mL組織裂解液(主要由尿素、硫脲、4% CHAPS兩性離子去污劑、1%二硫蘇糖醇、乙二胺四乙酸二鈉配制而成)。同時加入1×Cocktail(混合物)蛋白酶抑制劑。將含裂解液的eppendorf離心管埋入冰中,超聲破碎,3~4 s/次,間隔10 s左右,至溶液透明。加入脫氧核糖核酸酶I(DNaseI)(10 μg/μL)、核糖核酸酶A(RNase A)(10 μg/μL)各5 μL,4 ℃靜置30 min后,放入離心機以14 000 r/min離心30 min。取上清液,分裝,置于-80 ℃保存備用[8]。
1.5.3骨髓蛋白分析鑒定分別提取正常組、模型組及左歸丸組大鼠股骨骨髓蛋白質,應用蛋白質雙向凝膠電泳技術分析比較3組大鼠股骨骨髓之間蛋白質的表達,找出各組之間的差異蛋白質點。通過質譜方法對這些差異蛋白質進行進一步鑒定,獲取差異蛋白質的肽質量指紋圖譜和相關數據庫信息。采用免疫組化法驗證骨髓中相應蛋白的表達[9]。

2 結 果
2.13組大鼠脛骨TBV%水平比較見表1。
表13組大鼠脛骨TBV%水平比較
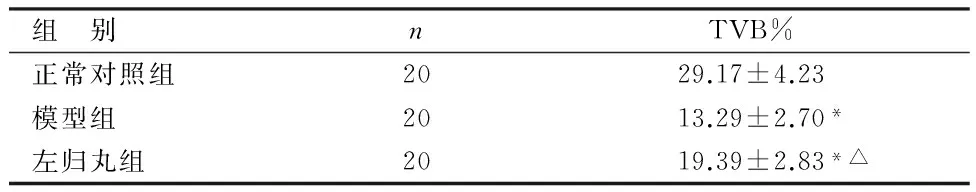
組 別nTVB%正常對照組2029.17±4.23模型組2013.29±2.70*左歸丸組2019.39±2.83*△
與正常對照組比較,*P<0.05;與模型組比較,△P<0.05
由表1可見,模型組、左歸丸組大鼠脛骨TBV%水平低于正常對照組,比較差異有統計學意義(P<0.05);左歸丸組大鼠脛骨TBV%水平高于模型組,比較差異有統計學意義(P<0.05)。
2.23組大鼠股骨骨髓中蛋白質的表達
2.2.1雙向凝膠電泳結果雙向凝膠電泳圖像結果經Image Master 2D Platinum 5.0軟件分析,所識別的蛋白質點個數為(826±35)個,以3倍差異表達作為標準,配合人工校正,在正常組、模型組及左歸丸組3組之間共找到差異蛋白質點為23個,見圖1、圖2。

圖1 3組大鼠骨髓雙向凝膠電泳圖譜
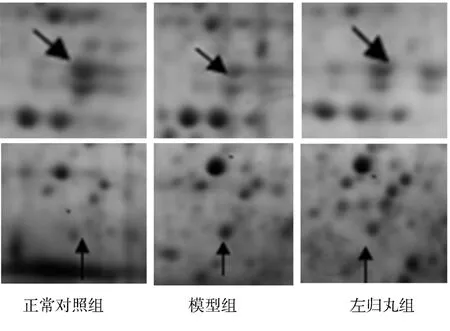
圖2 3組大鼠骨髓雙向凝膠電泳圖譜中差異蛋白質點
2.2.23組大鼠差異蛋白質點質譜鑒定結果對23個差異蛋白質點進行酶解、質譜分析得到肽質量指紋圖譜后,查詢美國國立生物技術信息中心(NCBI)nr數據庫(截止至2011-10-14),其中12個蛋白質點由于數據搜索的蛋白質分數不具有統計學意義而未得到鑒定(≥61分才具有統計學意義),11個蛋白質點得到鑒定,其中2個蛋白為未知命名蛋白(1號和11號),見表2。檢索數據庫顯示10號差異蛋白質點alpha-enolase為α-烯醇化酶,圖3為α-烯醇化酶的肽質量指紋圖譜,圖4為α-烯醇化酶的分數直方圖。
2.2.3免疫組化法驗證3組大鼠股骨骨髓中α-烯醇化酶的表達見圖5、表3。
由圖5、表3可見,模型組α-烯醇化酶陽性表達密度高于正常對照組,比較差異有統計學意義(P<0.05);左歸丸組α-烯醇化酶陽性表達密度低于模型組,比較差異有統計學意義(P<0.05)。
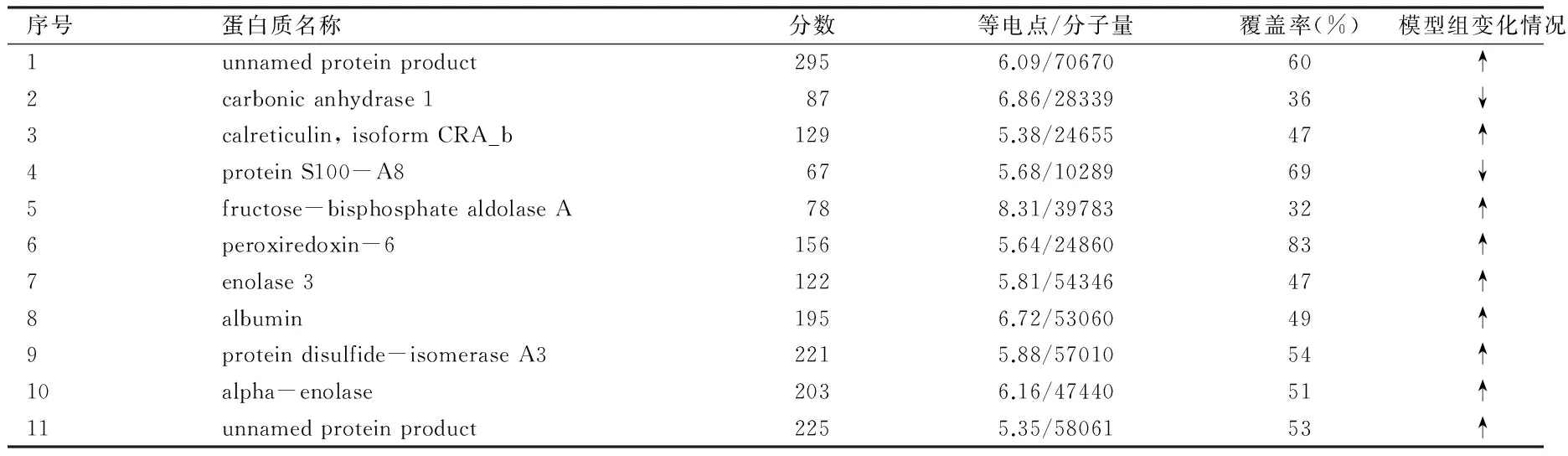
表2 11個差異蛋白質點鑒定結果及其表達變化情況
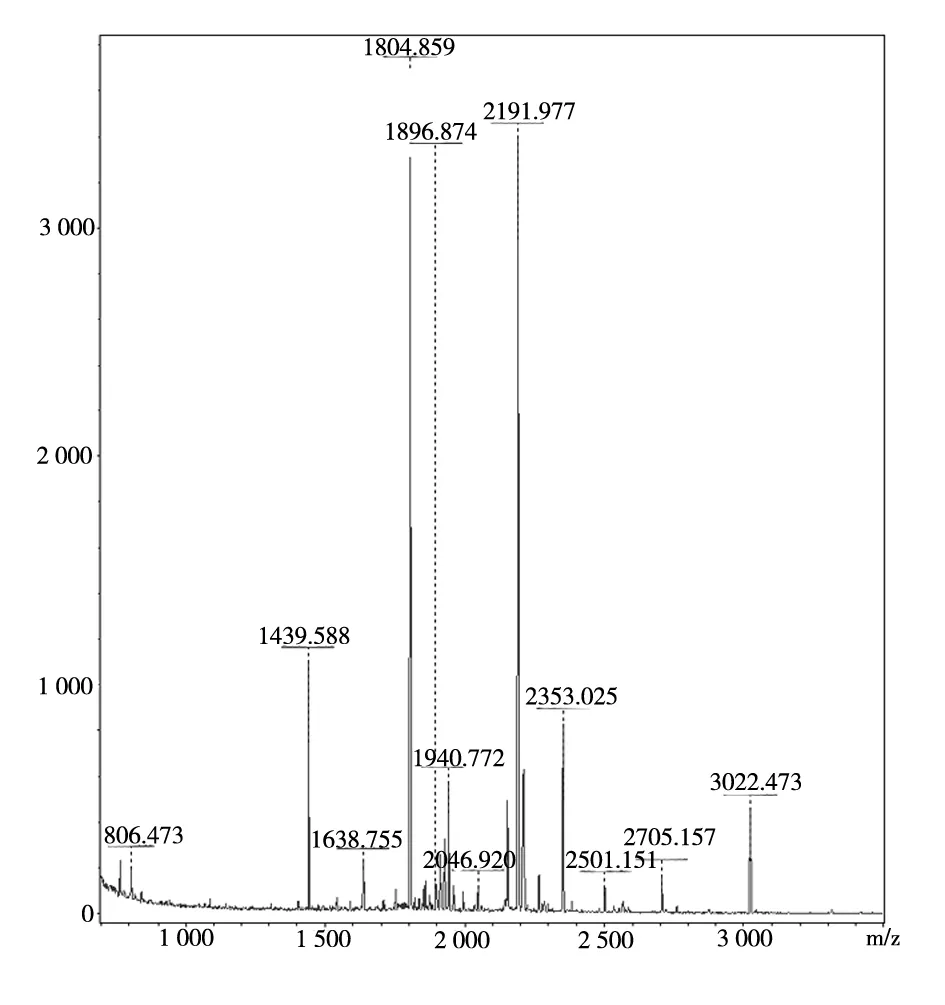
圖3 α-烯醇化酶差異蛋白質點的肽質量指紋圖譜
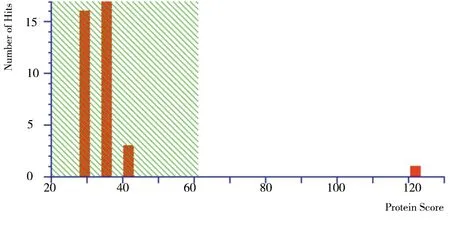
圖4 α-烯醇化酶差異蛋白質點的分數直方圖
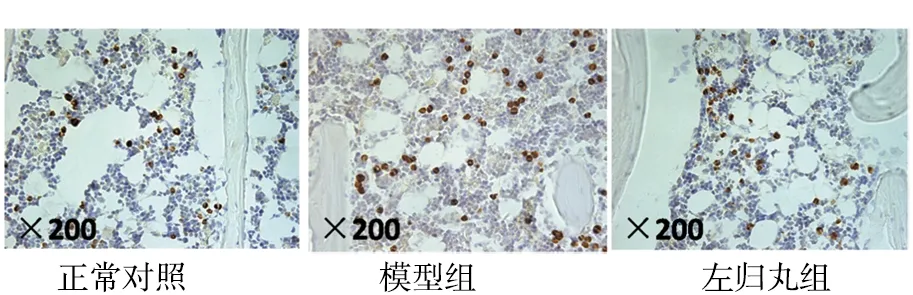
圖5 3組大鼠股骨骨髓中α-烯醇化酶的表達
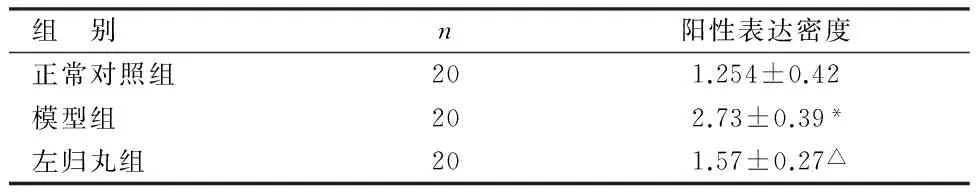
組 別n陽性表達密度正常對照組201.254±0.42模型組202.73±0.39*左歸丸組201.57±0.27△
與正常對照組比較,*P<0.05;與模型組比較,△P<0.05
3 討 論
PMOP是臨床常見的一種原發性骨質疏松癥,主要是由絕經以后雌激素水平急劇下降而引起,因骨量減少和骨組織微結構的異常改變,導致骨密度降低,骨脆性增高,從而表現為骨痛、身長縮短、駝背、骨折及活動障礙等癥狀,這大大增加了中老年婦女的傷殘率及病死率。蛋白質是生命現象的體現者,是生命活動的直接參與者,蛋白質組學是在蛋白質水平上把健康或病理條件下的生命活動規律與其蛋白質組聯系起來,以闡明疾病的發病機制、解釋藥物的作用機制、鑒定疾病分子標志物的一種重要方法[10-11]。
中醫學認為,腎藏精,主骨生髓,腎中精氣隨著年齡增長而由充盛逐漸衰退,骨骼也隨之由強健而轉為衰弱。PMOP的發生主要原因是腎精虧虛,精不生髓,其本在腎,補腎填精法為其根本大法。左歸丸是滋補腎陰的代表方劑,具有滋陰補腎、填精益髓的功效,并較為廣泛地應用于骨質疏松癥的臨床治療和基礎研究。研究表明,左歸丸可通過調節骨吸收和骨形成,控制和逆轉骨量的丟失,進而使骨量增加[12];能夠對血清中雌激素及雌激素靶器官起到直接的調節作用[13];通過促進成骨細胞分泌骨鈣素,直接抑制細胞核因子-κB受體活化因子配基(RANKL)的分泌,從而促進成骨細胞分泌骨保護素(OPG),并使之與RANKL的結合增多,進而使破骨細胞活性降低[14-15];更多的研究還發現,左歸丸可通過抑制成骨細胞白細胞介素(IL)-1、IL-6和前列腺素E2的分泌,發揮抑制破骨細胞的活性[16]。本實驗結果顯示,模型組大鼠脛骨TBV%水平明顯低于正常對照組(P<0.05),說明大鼠PMOP造模成功;左歸丸組大鼠脛骨TBV%水平明顯高于模型組(P<0.05),說明左歸丸治療PMOP療效確切。左歸丸對PMOP的干預也必然會影響到骨組織的相關蛋白。本實驗采用切除大鼠雙側卵巢的方法建立PMOP的動物模型,以蛋白質組學技術方法為主要研究手段,從股骨骨髓中的差異蛋白質來探索左歸丸對去卵巢所致大鼠骨質疏松癥的作用機制。本實驗結果顯示,相對于正常對照組,模型組大鼠骨髓中2、4號蛋白質表達受到抑制,1、3、5、6、7、8、9、10、11號蛋白質表達增多,而左歸丸對這些蛋白質的表達均有明顯調節作用。這些標志蛋白質主要涉及機體能量代謝、抗氧化、信號轉導及細胞分化、增殖、凋亡等方面的功能,說明左歸丸可通過調節骨髓細胞增殖、分化、代謝、凋亡及氧化反應等來達到對PMOP的治療作用。提示這些表達差異蛋白質可能既是藥物對PMOP進行預防和治療作用機制的體現,同樣也是PMOP發生發展機制的體現。
烯醇化酶是1934年Lohman和Mayerhof在研究肌肉提取物中磷酸甘油酸向丙酮酸轉換的過程中發現的,在細胞能量代謝的過程中起著重要的作用。烯醇化酶存在α、β及γ 3種同功酶。α-烯醇化酶在存在于許多組織中,β-烯醇化酶多見于肌肉組織,γ-烯醇化酶主要存在于神經元和神經內分泌組織中。根據分布和作用的不同,α-烯醇化酶又稱為非神經元烯醇化酶(NNE)、enolase1(eno1)、纖維蛋白溶酶原結合蛋白等[17]。烯醇化酶的表達水平和活性會隨著組織不同的生理或病理狀態而改變。α-烯醇化酶可以通過調節細胞的產能過程,維持細胞三磷酸腺苷(ATP)水平,為細胞的活動提供所需能量,保證細胞存活和正常功能。Poon HF等[18]通過研究發現,小鼠的腦組織中的α-烯醇化酶隨著年齡增加表達明顯增加,從而推出其與老年腦功能異常有關,因為糖酵解酶的增加可抑制脂肪酸的氧化,損害腦組織細胞的能量代謝。蘇友新等[19]研究也發現,中藥強骨寶1號可使PMOP模型大鼠股骨皮質骨中烯醇化酶蛋白表達上調。本實驗結果顯示,在模型組大鼠骨髓中α-烯醇化酶高表達,故推測α-烯醇化酶表達出現異常,損害了骨髓內細胞的能量代謝,影響了細胞的功能,從而誘發了去卵巢大鼠骨質疏松癥的發生。而左歸丸對α-烯醇化酶蛋白質的高表達有下調作用,這與雙向凝膠電泳圖譜分析和質譜鑒定結果一致。
綜上所述,左歸丸可能通過調節骨髓內與細胞增殖、分化、代謝、凋亡及氧化反應等相關蛋白質來實現對PMOP的防治作用。基于中醫理論對PMOP的認識,這些差異蛋白可能與PMOP的發生發展具有一定的相關性,從而也為闡明“腎主骨”理論的科學內涵提供了實驗依據。
[1]黃立莉,洪文,王立源,等.絕經后骨質疏松癥的臨床治療進展[J].中國醫藥導報,2011,8(18):7-10.
[2]陳晚嬌,張榮華,曾娟,等.絕經后骨質疏松癥中醫病機及治則探討[J].遼寧中醫雜志,2006,33(9):1105-1106.
[3]張治國,牛旭艷,劉梅潔,等.骨質疏松癥蛋白質相互作用網絡的構建和分子復合物通路預測[J].中國組織工程研究與臨床康復,2011,15(33):6090-6094.
[4]鞠大宏,趙宏艷,劉梅潔,等.左歸丸含藥血清對成骨細胞IL-1、IL-6和COX-2表達的影響[J].中國實驗動物學報,2006,14(2):96-99.
[5]洪志勇,劉愛平.大鼠骨質疏松模型建立Ⅱ卵巢切除術法[J].中國實驗動物學雜志,1994,4(2):95-96.
[6]鞠大宏,張麗坤,趙紅艷,等.滋陰補腎法對卵巢切除所致骨質疏松大鼠骨髓基質細胞IL-1和成骨細胞IL-6表達的影響[J].中國中醫基礎醫學雜志,2005,11(7):495-498.
[7]張榮華,陳可冀,陸大祥,等.補腎活血液對地塞米松誘導雄鼠骨質疏松的影響[J].中藥材,2003,26(5):347-349.
[8]李俊麗,李涢,劉銘福,等.基于方證相應學說探尋腎陰虛證的標志蛋白質[J].中國中醫基礎醫學雜志,2011,17(10):1084-1088.
[9]李俊麗,李涢,劉銘福,等.左歸飲與腎陰虛證方證相應機理的蛋白質組學研究[J].中國中醫基礎醫學雜志,2010,16(3):203-205,208.
[10]芮偉,湯健.蛋白質組及其在醫學研究中的應用[J].中華醫學雜志,2001,81(18):1146-1149.[11]蘇友新,李遠志,鄭良樸,等.強骨寶1號對去卵巢骨質疏松大鼠腰椎松質骨蛋白質組的影響[J].福建中醫藥,2012,43(1):52-54.
[12]鞠大宏,于福祿,張麗坤,等.滋陰補腎法對卵巢切除所致骨質疏松大鼠成骨細胞COX-2蛋白和
mRNA表達的影響[J].中國中醫基礎醫學雜志,2006,12(12):918-920.
[13]陸華,胡翔,王靜.左歸丸對去勢雌性大鼠子宮和陰道的影響[J].中醫雜志,2009,50(6):544-546.
[14]鞠大宏,吳萍,賈紅偉,等.左歸丸對卵巢切除所致骨質疏松大鼠骨鈣素和降鈣素含量的影響[J].中國中醫藥信息雜志,2003,10(1):16-17.
[15]鞠大宏,劉梅潔,趙宏艷,等.左歸丸含藥血清對成骨細胞OPG、RANKL mRNA表達的影響[J].北京中醫藥大學學報,2008,31(5):312-315.
[16]鄒軍,董苗淼,張麗,等.運動配合左歸丸對去卵巢大鼠骨質疏松的偶聯信號IL-1、IL-6及COX-2傳遞的影響[J].中國骨質疏松雜志,2010,16(6):407-411.
[17]朱理安,方寧遠.α烯醇化酶:古老的蛋白,嶄新的功能[J].國際病理科學與臨床雜志,2007,27(4):347-350.
[18]Poon HF,Vaishnav RA,Getchell TV,et al.Quantitative proteomics analysis of differential protein expression and oxidative modification of specific proteins in the brains of old mice[J].Neurobiol Aging,2006,27(7):1010-1019.
[19]蘇友新,李遠志,鄭良樸.強骨寶1號對去卵巢骨質疏松大鼠皮質骨蛋白質組的影響[J].福建中醫藥,2011,42(1):1-3.
(本文編輯:石康)
Action mechanism of Zuogui Pill in ovariectomized-induced osteoporotic rats based on proteomics techniques
ZHANGYing*,LIYun,ZHANGJie,etal.
*DepartmentofTraditionalChineseMedicine,BeijingLuheHospitalAffiliatedtoCapitalMedicalUniversity,Beijing101149
Objective To study the action mechanism of Zuogui Pill in ovariectomized-induced osteoporotic rats based on proteomics techniques, and to provide the experimental evidence of the theory of “Kidney dominating bone”. Methods 60 female Wistar rats were randomly divided into two groups, 20 in normal control group and 40 in molding group. Postmenopausal osteoporosis (PMOP) model was established by removing the bilateral ovaries in molding group, while only a little fatty tissue nearby the ovaries in normal control group were extirpated. Two weeks after operation, 40 rats in molding group were randomly divided into model and Zuogui pill group, 20 in each group. The Zuogui pill group received decoction of Zuogui pills by gavage, the normal control and model group received same dose distilled water by gavage. After three months administration, the percentage of trabecular bone volume (TBV %) of tibia were compared among three groups. The related proteins of Zuogui Pill intervention were selected from the femur bone by means of 2-DE and electrophoretogram, then use for mass spectrometry analysis. Results The TBV % of tibia in model and Zuogui pill groups were lower than that in normal control group (P<0.05), and its in Zuogui pill groups were higher than that in model group (P<0.05). 12 protein spots, which selected from total 23 differential protein spots of three groups, were unrecognized by reason of the protein scores without statistical difference, and other 11 protein spots obtain correct identification. Search databases showed that the NO.10 differential protein spot was alpha-enolase. The positive expression density of alpha-enolase which measured by mmunohistochemistry in model group was higher than that in normal control group (P<0.05), and its in Zuogui pill group was lower than that in model (P<0.05), and the result was in agreement with 2-DE map and mass spectrometry analysis. Conclusion Zuogui pill has preventive and therapeutic effects on PMOP which may be through the regulation of bone marrow's proteins relate to cell proliferation, differentiation, metabolism, apoptosis and oxidation reaction, such differential proteins may be have a positive correlation with occurrence and development of PMOP.
Osteoporosis; Post-menopause; Zuogui pills; Proteomics; Rats; Animals; Experiment
實 驗 研 究10.3969/j.issn.1002-2619.2016.07.018
△中國中醫科學院中醫基礎理論研究所,北京100700
張穎(1979—),女,主治醫師,博士。從事中醫藥防治骨質疏松癥的基礎研究以及中醫內科疾病的臨床與研究。
R285.5;R681.4
A
1002-2619(2016)07-1024-06
2016-05-05)
※ 項目來源:國家自然科學基金資助項目(編號:30973691)
1中國中醫科學院中醫基礎理論研究所,北京100700

