非甾體類孕酮受體激動劑Tanaproget對兔動脈硬化的抑制作用及其機制
李莉,肖莉麗,李志芳,張彥周
(鄭州大學第一附屬醫院,鄭州450000)
?
非甾體類孕酮受體激動劑Tanaproget對兔動脈硬化的抑制作用及其機制
李莉,肖莉麗,李志芳,張彥周
(鄭州大學第一附屬醫院,鄭州450000)
目的探討非甾體類孕酮受體激動劑Tanaproget對動脈硬化的影響及其可能的機制。方法 健康新西蘭大白兔24只隨機分為正常飼料(干草粉)喂養組(正常組)、高脂飼料(2%膽固醇+1%豬油+90%普通飼料)喂養組(模型組)、高脂飼料加Tanaproget喂養組(干預組),模型組及干預組于喂養第1周末,耳緣靜脈注射牛血清白蛋白250 mg/kg。實驗1周末和10周末,檢測血清甘油三脂(TG)、低密度脂蛋白膽固醇(LDL-C),ELISA法檢測血清白細胞介素8(IL-8)、腫瘤壞死因子α(TNF-α);實驗10周末隨機抽取每組中一只取主動脈做油紅O染色,其余取主動脈弓做石蠟包埋切片并行HE染色,提取血管組織蛋白,采用Western blotting法檢測核轉錄因子κB(NF-κB)和Toll樣受體4(TLR4)。結果實驗10周末模型組和干預組血清 TG、LDL-C水平較正常組升高(P均<0.01);實驗后模型組血清IL-8、TNF-α水平較正常組和干預組升高(P均<0.01);大體標本油紅O染色肉眼可見模型組斑塊明顯多于、大于正常組和干預組;HE染色后模型組主動脈內膜厚度明顯大于正常組和干預組。模型組NF-κB、TLR4表達明顯高于正常組和干預組(P均<0.01)。結論 Tanaproget通過特異性與孕酮受體結合后調節血脂代謝,同時抑制活化的TLR4/NF-κB信號通路,減少炎癥因子的轉錄與生成,從而發揮其抗動脈硬化作用。
動脈硬化;孕酮受體激動劑;血脂;核轉錄因子κB; Toll樣受體4;白細胞介素8;腫瘤壞死因子α;新西蘭大白兔
冠心病發生率逐年上升,發病人群也逐漸從中老年人群向中青年人群發展,且有一定程度的致殘率及致死率,嚴重威脅人類健康,動脈硬化(AS)是這種疾病發生發展的一個重要環節。研究顯示,絕經前女性冠心病發病率明顯低于絕經后女性及同齡男性,其原因與女性雌孕激素有關。孕酮受體激動劑對AS的抑制作用在國內外已有部分研究。Tanaproget(TNPR)是一種非甾體類孕酮受體激動劑,可特異性與孕酮受體結合,減少了一些非特異性結合帶來的不良作用,如子宮內膜癌、乳腺癌的發生。2015年6~9月,我們通過建立AS動物模型,探討了TNPR對AS的影響及其可能的機制。現報告如下。
1 材料與方法
1.1材料動物:健康雄性新西蘭大白兔24只,體質量2.3~2.7 kg,3~4月齡,來自河南省動物實驗中心,適應性飼養1周后進入實驗。試劑及儀器:普通飼料由河南省動物實驗中心提供,其余均購自南京奧多福尼生物科技有限公司,TNPR(上海交通大學提供),ELISA試劑盒(武漢博士德生物工程有限公司),Toll樣受體4(TLR4)、β-actin抗體購自武漢博士德生物工程有限公司,核轉錄因子κB(NF-κB)抗體購自北京博奧森生物技術有限公司。
1.2動物分組和模型建立健康雄性新西蘭大白兔24只隨機分為正常組8只、模型組8只、干預組8只。正常組普通飼料(干草粉)喂養。模型組喂養質量分數2%膽固醇+10%豬油+90%普通飼料,干預組喂養質量分數2%膽固醇+10%豬油+90%普通飼料喂養,飼養開始1周后給予TNPR干預,按10 mg/kg體質量灌胃,模型組及干預組在喂養飼料的基礎上,于喂養第1周末,耳緣靜脈一次性注射250 mg/kg的牛血清白蛋白,1次/周,連續注射四周[1],均自由飲水,10周后進行血脂測定,隨機各組挑選一只行主動脈油紅O染色有大量粥樣硬化斑塊形成確定AS模型建造成功。10周后,氣體栓塞處死,分離主動脈,10%甲醛浸泡24 h后油紅O染色,肉眼觀察動脈斑塊。主動脈內膜增厚或出現斑塊為模型成功。
1.3主動脈、肝臟組織形態的觀察兔飼養10周末取材,氣體栓塞處死,分離主動脈,生理鹽水沖凈,分為主動脈根部、主動脈弓至胸主動脈、腹主動脈3段,再取部分肝臟組織置入體積分數10%甲醛溶液固定,經脫水、透明、浸蠟、包埋與石蠟切片處理后,一部分行蘇木精-伊紅染色,光學顯微鏡觀察,另一部分冰箱保存待檢。
1.4血脂的檢測分別于實驗開始、飼養10周末采血。于清晨空腹(空腹大于12 h)從兔耳中動脈采集血液2 mL。注入不含抗凝劑的普通試管。全自動生化儀測定TG、LDL-C。
1.5血清IL-8、TNF-α的檢測采血時間及要求同上。注入含抗凝劑的普通試管,自動離心機離心取上清,采用ELISA法分別檢測血清中的IL-8、TNF-α水平。嚴格按照試劑盒說明書操作。每種因子均采用雙份檢測。檢測后應用酶標儀測定吸光值(OD值),繪制標準曲線,計算相關數值。
1.6主動脈弓部TLR4、NF-κB的檢測用Western blotting法。取-80 ℃冰箱冷凍保存組織,按0.1 g/50 μL比例加RIPA裂解液混勻,冰上裂解30 min,置于4 ℃恒溫離心機12 000 g/min離心25 min,吸取上清于EP管中,用微孔酶標儀法(CBA試劑盒)測定蛋白濃度,計算上樣量恒定為10 mg的蛋白溶液體積。制好膠(10%的分離膠,5%的積層膠)后上樣80 V電泳70 min,200 mA轉膜蛋白至PVDF膜上后,用30%的脫脂奶粉封閉2 h,1×TBST洗凈,一抗孵育(4 ℃過夜,一抗工作濃度β-actin 1∶3 000,TLR4 1∶800,NF-κB 1∶800),1 × TBST洗凈,二抗孵育(1∶1 000)2 h,1 × TBST洗凈后ECL顯色曝光。采用Alphariew軟件對進行灰度值分析,以目的條帶灰度值/β-actin條帶灰度值表示目的蛋白的相對表達量。
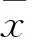
2 結果
2.1三組形態學觀察結果正常組無斑塊。模型組血管可見多處斑塊,干預組可見多處斑塊,但斑塊少于并小于模型組。HE染色示正常組主動脈內膜光滑,中膜結構清晰,內彈力板結構正常。模型組主動脈內膜明顯增厚,內彈力板結構破壞,有斑塊突向管腔,斑塊內壞死物質未染色。干預組可見內膜增厚,厚度小于模型組。
2.2三組不同時間血清TG、LDL-C、IL-8、TNF-α水平比較第1周末各組新西蘭大白兔血清TG、LDL-C、IL-8、TNF-α水平組間、組內差異無統計學意義,第10周末組內差異無統計學意義,組間有統計學差異,見表1。

表1 各組不同時間血清TG、LDL-C、IL-8、TNF-α水平比較
注:與正常組同時間比較,*P<0.01;與模型組同時間比較,#P<0.01。
2.3三組主動脈弓部TLR4、NF-κB相對表達量比較模型組TLR4、NF-κB表達高于正常組和干預組,差異有統計學意義(見圖1,表2)。

圖1 各組NF-κB、TLR4表達的電泳圖

組別nNF-κB/β-actinTLR4/β-actin正常組80.52±0.310.68±0.28模型組81.09±0.21*#1.32±0.18*#干預組80.76±0.420.94±0.32
注:與正常組比較,*P<0.01;與干預組比較,#P<0.01。
3 討論
AS與脂質代謝障礙有關,TG升高會導致動脈內膜損傷,并且在內膜下形成堆積,從而影響血液黏稠度。當血中TG升高時,肝臟合成LDL-C增強,同時HDL-C水平降低,進而加速了AS的形成和發展[2]。本研究中,TNPR干預后TG、LDL-C水平明顯降低,即 TNPR可以通過調節血脂代謝、降低血脂水平,抑制血管內膜受損而達到抑制AS進展的目的,但其具體如何調節血脂代謝的分子機制有待進一步研究。
在AS發生、發展中炎癥具有重要的病理作用,而炎癥是機體對于各種外源性或內源性損傷因子引起的組織或細胞損傷所產生的機體防御性反應,發生機制非常復雜,涉及多種細胞因子,如TNF-α、黏附因子、細胞因子、趨化因子等介導的細胞信號轉導通路都參與了機體炎癥反應的發生和發展過程。有研究顯示,TNPR對體內炎癥反應中的炎癥因子有明顯干預抑制作用[3]。
Toll樣受體(TLR)是參與非特異性免疫(天然免疫)的一類重要蛋白質分子,也是連接非特異性免疫和特異性免疫的橋梁。人類TLR家族成員已確認的有10個,他們分布于不同細胞表面,其中TLR4主要表達于單核巨噬細胞表面。TLR4的結構分為3個區域:胞外域、跨膜域、胞內域。胞外域是一段重復的亮氨酸序列,可與CD13結合,介導病原相關分子模式的識別。胞內域是一段高度保守的序列,該序列與IL-1受體胞內區具有同源性,故又稱為TIR區域,當TLR4與相應配體結合后,信號轉導至TIR區域,然后進一步激活NF-κB信號通路[4]。NF-κB是一個轉錄因子蛋白家族,作為早期轉錄因子,NF-κB的激活不需要新翻譯出的蛋白進行調控,使其可在第一時間對有害細胞的NF-κB信號通路刺激做出反應。參與免疫反應的早期和炎癥反應各階段的許多分子都受NF-κB的調控,包括TNF-α、IL-1、IL-2、IL-6、IL-8、IL-12等。
炎癥啟動首先是炎癥細胞的激活。內皮細胞、吞噬細胞、中性粒細胞等炎細胞可由各種物理、化學等因素刺激激活,激活后的炎細胞能產生多種促炎因子和趨化因子,如TNF-α、IL-1、IL-6、IL-8以及活性氧[5]。TLR4作為一種內源性配體,廣泛分布于單核巨噬細胞表面,非特異性TLR4激動劑激活TLR4,通過其下級信號通路激活I κB激酶,并進一步磷酸化NF-κB抑制性亞基(IκB)。激活的NF-κB與IκB解離后轉位入核與多種靶基因啟動子/增強子上的κB序列結合,從而誘導多種細胞因子(IL-6、IL-8、TNF-α等)的表達[6]。TNF-α作為一種炎癥因子刺激、損傷血管內膜細胞,趨化白細胞,吸附血管平滑肌細胞遷移并促其增殖,使血管腔狹窄,是形成AS的重要環節。TNF-α在炎癥反應中的主要作用為通過增加中性粒細胞CD18表面抗原來增強其對內皮細胞的黏附及抗體依賴性細胞毒反應,也能增加血小板活化因子(PAF)、花生四烯酸的合成與釋放;可促進內皮細胞黏附分子的表達和IL-8、PAF的釋放,使中性粒細胞游走與激活。TNF-α能促進間質性膠原酶和基質金屬蛋白酶的表達[7],降解大分子間質膠原和基質金屬蛋白,同時增加細胞外基質的降解,利于細胞遷移和增殖[8],增加斑塊不穩定性。本研究結果顯示,模型組在干預10周后,TNF-α、IL-8、TLR4、NF-κB均升高,而干預組各個指標均降低,且明顯低于模型組。提示TNPR通過抑制TLR4/NF-κB信號通路的激活,抑制 TNF-α、IL-8的基因激活及蛋白的轉錄,進而影響炎細胞的激活、活化,反過來再次干擾TLR4/NF-κB信號通路,最終減輕了機體的炎癥反應、延緩AS的發展。
綜上認為,TNPR通過特異性與孕酮受體[9]結合后調節了血脂代謝,同時抑制活化TLR4/NF-κB信號通路,減少炎癥因子的轉錄與生成,降低炎癥損傷、細胞外基質降解,減弱吸附、趨化白細胞和血管平滑肌細胞,延緩了AS的發生、發展,這其中涉及到信號通路的一些具體調節方式及方法有待進一步探討。
[1] 李琳,竇健霖.高脂飼料喂養加靜脈注射小牛血清白蛋白建立兔動脈粥樣硬化模[J].中國組織工程研究,2012,1(20):3690-3693.
[2] 谷占清,谷菲.超敏C反應蛋白聯合血脂檢測對診斷冠狀動脈硬化的意義[J].中國社區醫師,2015,17(67):106-108.
[3] Goddard LM , Ton AN, Qrq T, et al. Selective suppression of endothelial cytokine production by progesterone receptor[J]. Vasc Pharmacol, 2013,59(1-2):36-43.
[4] Yan ZQ. Regulation of TLR4 expression is a tale about tail[J]. Arterioscle Thromb Vasc Biol, 2006,26(12):2582-2584.
[5] Zhang Z, Olland AM, Zhu Y, et al. Molecular and pharmacological properties of a potent and selective novel nonsteroidal progesterone receptoragonist tanaproget[J]. J Biol Chem, 2005,280(31):28468-28475.
[6] 李桂源,吳偉康,歐陽靜萍,等.病理生理學[M].北京:人民衛生出版社,2005:64-65.
[7] Grandas OH, Mountain DJ, Kirkpatrick SS, et al.Effect of hormones on matrix metalloproteinases gene regulation in human aortic smooth muscle cells[J]. J Surg Res, 2008,148(1):94-99.
[8] Bruner-Tran KL, Zhang Z, Eisenberg E, et al. Down-regulation of endometrial matrix metalloproteinase-3 and -7 expression in vitro and therapeutic regressionof experimental endometriosis in vivo by a novel nonsteroidal progesterone receptor agonist, tanaproget[J].J Clin Endocrinel Metab, 2006,91(4):1554-1560.
[9] 胡平,任夢鶴.非甾體類孕酮受體配體構效關系的研究進展[J].中國新藥雜志,2008,17(11):905-910.
張彥周(E-mail:zhangyanzhou2050@sina.com)。
10.3969/j.issn.1002-266X.2016.17.011
R543
A
1002-266X(2016)17-0034-03
2015-11-15)

