瑞舒伐他汀對急性心肌梗死大鼠心肌細胞凋亡的抑制作用及其機制
楊蕾,劉海龍,張斌,湯建民
(鄭州大學第二附屬醫院,鄭州450000)
?
瑞舒伐他汀對急性心肌梗死大鼠心肌細胞凋亡的抑制作用及其機制
楊蕾,劉海龍,張斌,湯建民
(鄭州大學第二附屬醫院,鄭州450000)
目的探討瑞舒伐他汀對急性心肌梗死(AMI)大鼠心肌細胞凋亡的抑制作用及其機制。方法 從60只SD雄性大鼠中隨機抽取10只作為對照組,只分離不結扎前降支,余下的50只分別結扎其前降支制作AMI模型。24 h后存活的41只隨機分為3組,分別為AMI組13只、Statin1組14只、Statin2組14只。術后第1天起,Statin1、2組分別給予瑞舒伐他汀1.5、3.0 mg/(kg·d)灌胃,對照組及AMI組分別以等量的生理鹽水灌胃。4周后TUNEL法染色檢測心肌細胞凋亡指數(AI),免疫組化法檢測線粒體融合蛋白2(Mnf2)表達,免疫印跡法檢測磷酸化Akt(p-Akt)表達,并進行比較。結果與對照組相比,AMI組及Statin1、Statin2組心肌細胞AI升高,p-Akt表達下降,Mnf2表達增加(P均<0.05);與AMI組相比,Statin1、Statin2組心肌細胞AI和Mnf2表達均顯著降低(P均<0.05),而p-Akt表達增高(P<0.05),且Statin2組較Statin1組變化更為顯著(P<0.05)。結論 瑞舒伐他汀可抑制大鼠AMI后的細胞凋亡,其作用可能與下調Mnf2的表達有關,且呈一定劑量依賴性。
急性心肌梗死;細胞凋亡;線粒體融合蛋白2; Ras-PI3K/Akt;瑞舒伐他汀;大鼠
急性心肌梗死(AMI)后壞死心肌介導的炎癥反應,在促進壞死心肌修復愈合的同時,也加速心肌的重構并通過細胞因子的級聯效應導致心肌細胞凋亡。線粒體融合蛋白2(Mfn2)是線粒體外膜上的一種跨膜蛋白,其可能通過激活線粒體凋亡途徑,或抑制Ras-磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B (PKB)通路,誘導心肌細胞發生凋亡[1]。他汀類藥物除抑制甲羥戊酸合成,還可抑制類異戊二烯的生成,影響Ras-PI3K/Akt通路,發揮其調節細胞凋亡、改善血管內皮功能、抗血小板、調脂、抗動脈粥樣硬化等作用[2]。本實驗于2015年4~10月建立大鼠AMI模型,研究瑞舒伐他汀對AMI大鼠心肌細胞凋亡的抑制作用,并探討其作用機制。
1 材料與方法
1.1材料健康成年SPF級SD雄性大鼠60只,體質量250~300 g,購自山西醫科大學實驗動物中心。試劑及藥品:Mfn2兔多克隆抗體(武漢博士德生物工程有限公司);PV9000試劑盒、DAB試劑盒(北京中杉生物工程公司);凋亡試劑盒(德國roche公司);瑞舒伐他汀鈣片(10 mg/片),AstraZeneca公司。儀器:日本尼康顯微照像系統;微波爐(格蘭仕);溫箱(電熱恒溫水浴箱DHG-9031,上海);電子天平(BS224S,德國)。
1.2動物分組及模型建立健康成年SPF級SD雄性大鼠60只,適應性喂養7 d。隨機抽取10只為對照組,前降支下穿線不結扎;其余50只制作AMI模型:用10%的水合氯醛3 mL/kg腹腔注射麻醉大鼠,氣管切開插管,呼吸機輔助呼吸,潮氣量15 mL/kg,呼吸頻率70~80次/min,呼吸比2∶1,開胸后分離胸膜、心包,擠出心臟,以醫用縫線穿圓形塑料套管前結扎大鼠左前降支阻斷血流,造成AMI模型。24 h后存活41只大鼠,按照隨機數字表法分為3組,AMI組13只、Statin1組14只、Statin2組14只,術后第1天起Statin1、2組分別給予瑞舒伐他汀1.5、3.0 mg/(kg·d)灌胃,對照組及AMI組均以等量生理鹽水灌胃,每3天稱重1次并調整給藥劑量,共給藥4周。實驗結束時各組存活量分別為對照組10只、AMI組9只、Statin1組11只、Statin2組13只。
1.3心肌細胞凋亡指數(AI)的測算用轉移酶介導脫氧尿苷三磷酸缺口末端標記法(TUNEL)對組織石蠟切片行凋亡染色。凋亡細胞出現棕黃色顆粒為陽性,每張標本取3張切片,每張切片在心梗區域隨機取5個高倍鏡視野,記錄陽性細胞數,計算AI,AI=凋亡細胞核數/總細胞核數×100%。
1.4心肌組織中Mfn2表達的檢測采用免疫組化法。處死大鼠后取心臟標本,制作石蠟切片,選取梗死心肌組織邊緣區域(對照組在左室前壁)切片。依照試劑盒步驟檢測Mfn2。陽性切片作陽性對照,PBS切片作陰性對照,細胞內出現棕黃色顆粒為陽性,每張標本取3張,分析Mfn2蛋白陽性染色指數(陽性細胞數/視野細胞總數×100%)。
1.5心肌組織中p-Akt表達的檢測采用免疫印跡法。提取組織總蛋白,測定蛋白濃度。 蛋白上樣量為50 μg,經電泳、轉膜、封閉后,加入一抗(抗α-actin、抗p-Akt、抗Akt),4 ℃放置12 h以上,加入辣根過氧化物酶偶聯的二抗,平穩搖動,室溫放置2 h后檢測。
2 結果
2.1各組AI、Mfn2比較見表1。
2.2各組心肌組織 p-Akt 的表達比較與對照組比較,AMI組及Statin1、Statin2組心肌組織中p-Akt蛋白表達均降低(P均<0. 01);與AMI組比較,Statin1組、Statin2組p-Akt表達增加(P均<0.05) ,以Statin2組為著(P<0.05) ,見圖1、表1。

圖1 各組p-Akt表達的免疫印跡圖
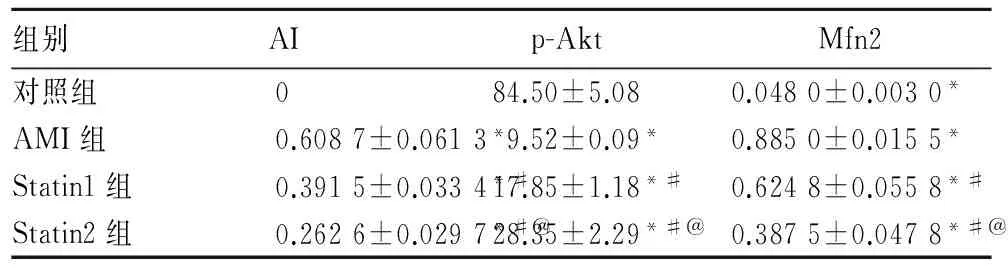
組別AIp-AktMfn2對照組084.50±5.080.0480±0.0030*AMI組0.6087±0.0613*9.52±0.09*0.8850±0.0155*Statin1組0.3915±0.0334*#17.85±1.18*#0.6248±0.0558*#Statin2組0.2626±0.0297*#@28.35±2.29*#@0.3875±0.0478*#@
注:與對照組比較,*P<0.05;與 AMI組比較,#P<0.05; 與Statin1組比較,@P<0.05。
3 討論
既往認為AMI時以心肌細胞壞死為主。近年來多項相關動物實驗證實,AMI后細胞凋亡才是心肌細胞死亡的主要方式[3]。Kajstura等[4]在AMI動物模型中發現,梗死后約6 h心肌細胞凋亡可達到高峰,7 d仍有大量的心肌細胞發生凋亡。Bardales等[5]用TUNEL法檢測85例AMI死亡患者尸解的心肌細胞,凋亡率超過90%。
AMI發生后,缺氧、缺血、再灌注等誘因激活各種凋亡因子,調控相關信號通路,誘導細胞凋亡[6]。細胞凋亡信號轉導為多途徑且相互影響,研究發現,Ras-PI3K/Akt 路徑是促使心肌細胞發生凋亡的主要通路[7]。本實驗結果顯示,AMI組較對照組細胞凋亡明顯增多,同時心肌組織中p-Akt表達較對照組也明顯降低。以上結果均表明AMI后大量心肌細胞凋亡,與Ras-PI3K/Akt通路激活密切相關。
原癌基因Ras不僅能調控PI3K/Akt 通路,誘導細胞凋亡,還可通過PI3K非依賴型途徑直接激活Akt[8]。研究表明,Mfn2在心肌、骨骼肌和腦組織中高表達,其可能參與心肌細胞凋亡的早期活化,加速線粒體分裂,促使線粒體體積減小[9]。Mfn2對Ras有直接負調控作用,能阻滯Ras-PI3K/Akt 通路,抑制Akt磷酸化,繼而使B淋巴細胞瘤-2基因表達減少,促凋亡基因Bax表達增加,通過線粒體相關途徑參與細胞凋亡[10]。本實驗結果顯示,大鼠AMI造模成功后,梗死及周圍心肌組織Mfn2表達明顯增高,p-Akt表達明顯降低,這表明梗死后損傷激活Mfn2的表達,弱化Akt 磷酸化從而促發心肌細胞凋亡。
大量的循證醫學證實,他汀類藥物在冠心病防治過程中占據著不可替代的地位。隨著臨床廣泛應用及研究的深入,人們發現他汀類藥物有重要的獨立于調脂外的多重作用[11]:他汀類藥物除抑制甲羥戊酸合成,阻斷Cho的生成過程,還可抑制類異戊二烯,可與一些單體G蛋白(如Ras,Rho等)偶聯,增加后者的親脂性,影響Ras-PI3K/Akt 及Rho/Rho激酶信號通路、RAAS系統和過氧化物酶增殖物激活受體的活性,發揮其抑制心肌細胞凋亡、改善血管內皮功能、調脂、抗動脈粥樣硬化等作用,降低心血管疾病的發病率和病死率[2]。本實驗結果顯示,瑞舒伐他汀可使Mfn2表達明顯下調,抑制Ras相關信號通路的活化,減少大鼠AMI后的細胞凋亡,其作用表現出一定的劑量依賴性。
綜上所述,筆者認為Ras介導的PI3K/Akt信號通路可能在AMI后心肌細胞凋亡發生發展過程中起重要作用,而瑞舒伐他汀通過下調Mfn2表達,上調p-Akt水平,最終減少AMI后心肌細胞凋亡,防止AMI范圍進一步擴大導致心肌細胞壞死,從而對心功能不全及心室重構有一定的治療作用。
[1] Guo XM, Chen KH, Guo YH, et al. Mitofusion2 triggers vascular smooth muscle cell apoptosis via mitochondrial death pathway[J].Circ Res, 2007,101(11):1113-1122.
[2] 趙艷,杜冠華,王少華.Rho/Rho激酶信號轉導通路與他汀類藥物[J].中國新藥與臨床雜志,2008,10(27):786-790.
[3] Prech M, MarszaIek A, Schroder J, et al. Apoptosis as a mechanism for the eIimination of cardiomyocytes after acute myocardiaI infarction [J]. Am J Cardiol, 2010,105(9):1240-1245.
[4] Kajstura J, Cheng W, Sarangarajan R, et al. Necrotic and apoptotic myocyte cell death in the aging heart of Fischer 344 rats[J]. Am J Physiol, 1996,271(3 Pt 2):1215-1228.
[5] Bardales RH, Hailey LS, Xie SS, et al. In situ apoptosis assay for the detection of early acute myocardial infarction[J]. Am J pathol,1996,149(3):821-829.
[6] 張麗娜,吳星恒.心肌細胞凋亡與PI 3K/Akt信號途徑表達及其調控機制的研究[J].南昌大學學報(醫學版),2010,50(5):119-121.
[7] Ishihara Y,Shimamoto N. Sulfaphenazole attenuates myocardial cell apoptosis accompanied with cardiac ischemia-reperfusion by suppressing the expression of BimEL and Noxa[J]. Pharmacol Sci, 2012,119(3):251-259.
[8] 袁向飛,陸敏.Ras/MAPK與PI3K/Akt信號轉導通路及其相互作用[J].國際檢驗醫學雜志,2006,156(3):4-5.
[9] Parra V, Eisner V, Chiong M, et al. Changes in mitochondrial dynamics during ceramide-induced cardiomyocyte early apoptosis[J]. Cardiovasc Res, 2008,77(2):387-397.
[10] Shen T, Zheng M, Cao CM, et al. Mitofusin-2 is a major determinant of oxidative stress-mediated heart muscle cell apoptosis[J]. J Biol Chem, 2007,282(8):23354-23361.
[11] 鄢華,高煒.他汀類藥物作用和作用機制的新認識[J].臨床內科雜志,2006,23(1):5-7.
湯建民(E-mail:tjmgrx@163.com)
10.3969/j.issn.1002-266X.2016.17.009
R541.4
A
1002-266X(2016)17-0028-03
2015-11-18)

