銀杏葉提取物對OSAS繼發性高血壓大鼠的治療作用及其機制
李艷紅,陳梅晞
(1 桂林醫學院,廣西桂林 541001;2 桂林醫學院附屬醫院)
?
銀杏葉提取物對OSAS繼發性高血壓大鼠的治療作用及其機制
李艷紅1,陳梅晞2
(1 桂林醫學院,廣西桂林 541001;2 桂林醫學院附屬醫院)
目的探討銀杏葉提取物(GBE)對阻塞性睡眠呼吸暫停綜合征(OSAS)繼發性高血壓大鼠的治療作用及其機制。方法 參考羅熒荃的經典造模方法設立大鼠間歇缺氧(IH)模型。將30只Wistar大鼠隨機分為常氧對照(NC)組、IH組、GBE治療(IH+GBE)組,實驗前及實驗后第3、6、9周監測血壓及生理狀態變化,9周后提取各組腎周前脂肪細胞并鑒定,用MTT法檢測12.5、25、50、100、200、400 mg/L的GBE作用3、6、12、24 h后的細胞活力及增殖率;提取IH組前脂肪細胞,將其分為缺氧對照組(IH組)、LPS刺激缺氧組(LPS組)、GBE治療缺氧組(GBE組),12 h后ELISA法檢測上清液中炎性因子TNF-α、IL-1β、IL-6。結果 ①IH組與NC組比較大鼠尾動脈血壓隨著缺氧時間而增加(P<0.05或<0.01),IH+GBE組隨著缺氧時間的延長血壓維持在正常水平;②GBE在一定程度上能促進大鼠前脂肪細胞生長, 呈劑量、時間依賴性(P均<0.05);③與IH組比較,LPS組上清液中TNF-α、IL-1β、IL-6水平明顯升高,GBE組顯著降低(P均<0.01)。結論 GBE對OSAS引起的高血壓大鼠有治療作用;其可能通過促進前脂肪細胞增殖、抑制脂肪細胞因子水平,改善OSAS炎癥程度而起作用的。
阻塞性睡眠呼吸暫停綜合征;高血壓;銀杏葉提取物;脂肪細胞;炎性因子;大鼠
阻塞性睡眠呼吸暫停綜合征(OSAS)作為難治的慢性呼吸系統炎性疾病[1],是繼發性高血壓的高危因素,其機制可能是反復間歇性缺氧(IH)引起細胞缺氧再灌注損傷,并觸發促炎基因的大量表達,加重血管內皮和功能損害,從而引起患者高血壓發生[2],目前臨床上尚無較好的治療方案。肥胖為OSAS和高血壓的危險因素,三者之間形成惡性循環,互相加重,嚴重威脅公眾健康。美國關于肥胖和高血壓的相關性統計分析指出肥胖是引起高血壓的重要因素[3]。新的研究[4]也表明脂肪細胞除了存儲能量,還具有內分泌及調節血壓的功能,如脂肪因子chemerin的過度合成可引起血管重構及炎癥反應,與高血壓的發生密切相關[5]。由此猜測脂肪細胞分泌的炎性因子可能參與了OSAS與高血壓的病理生理過程。銀杏葉提取物(GBE)現被廣泛用于治療多種心腦肺血管疾病,具有清除自由基、抗脂質過氧化等作用[6]。2014年11月~2015年1月,我們通過研究GBE對OSAS大鼠血壓的影響,并分析其對脂肪細胞生長及脂肪細胞因子的調控作用,以探討其治療作用及機制。現報告如下。
1 材料與方法
1.1材料SPF級Wistar大鼠30只,雄性,體質量120~150 g,由桂林醫學院實驗動物中心提供,許可證號SCXK桂2013-0001,前脂肪細胞由大鼠腎周脂肪組織提取;GBE(徐州恒凱銀杏制品有限公司); JXOC-12型低壓氧艙全自動控制儀,包括有機玻璃艙、XF-666型測氧儀、氮氣儲氣瓶、氧氣儲氣瓶四部分(南京新飛分析儀器制造有限公司);ALC-NIBP型大鼠尾動脈血壓測量儀(上海奧爾科特生物科技有限公司);氮氣、氧氣(桂林恒盛氣體有限公司);細胞培養基、胎牛血清(Hyclone公司);Ⅰ型膠原酶、胰蛋白酶(Gibco公司);MTT(Amresco公司);脂多糖(LPS)、DMSO、油紅O(索萊寶公司);IBXM紫外分光光度計(日本島津UV-2401PC);ELISA試劑盒(華美公司)。
1.2動物模型分組及建立參考羅熒荃等[7]的經典造模方法,取Wistar大鼠隨機分為常氧對照(NC)組、IH組、GBE治療(IH+GBE)組各10只,每天實驗前分別予以對照組和IH組生理鹽水灌胃,IH+GBE組給予1 mL/kg GBE水溶劑灌胃,1次/d,共9周。實驗期間IH組和IH+GBE組大鼠放置于密閉的玻璃容器中予以8 h循環向玻璃艙內充入氮氣、氧氣,即快速充入10 s的氮氣維持低氧(6%±0.5%) 30 s后10 s內快速充入氧氣維持氧濃度為(21%±0.5%) 30 s,最終以9周后尾動脈收縮壓≥150 mmHg提示OSAS合并高血壓造模成功。
1.3大鼠生理狀態的改變及血壓的監測實驗前及實驗后3、6、9周用無創血壓記錄儀分別監測各組尾動脈血壓的變化情況,并觀察大鼠鼻唇、呼吸等變化情況。
1.4前脂肪細胞的提取、培養及鑒定采用改良的von Heimburg等[8]方法提取原代前脂肪細胞:大鼠麻醉后無菌條件下取出腎周脂肪組織墊,仔細剔除肉眼可見的血管和纖維,用2 mg/mL的Ⅰ型膠原酶消化90 min至乳糜狀,過濾、離心收集并沉淀細胞用于接種培養。油紅O染色鑒定后,取狀態穩定的2、3代前脂肪細胞長至70%融合后,加入胰蛋白酶室溫下消化后制成細胞懸液,用于實驗。大鼠原代前脂肪細胞12 h即貼壁呈類圓形,2 d后呈梭形或多角形,5 d呈漩渦狀或魚群狀進入對數期生長。成脂誘導后倒置顯微鏡下細胞內可見反光顆粒,可被油紅O染為橘紅色,即可鑒定提取的細胞為前脂肪細胞。
1.5前脂肪細胞存活率的測算采用MTT比色法。取對數生長期的前脂肪細胞懸液,按1×104/孔均勻接種于96孔板中, 基礎培養基處理24 h后棄除廢液,換用無血清DMED/F 12培養液使細胞同步化。藥物組濃度梯度為12.5、25、50、100、200、400 mg/L,觀察時間點為3、6、12、24 h,并設置不給藥物的細胞作為對照組和不含細胞及藥物的孔作為空白組,每組6個復孔。實驗結束前4 h吸棄舊液,加入含10%的MTT(5 g/L)與無血清DMEM/F 12培養基混合液200 μL,孵育6 h后棄舊液,每孔加入DMSO 150 μL, 振蕩器上低速振蕩10 min,使結晶物充分溶解。通過分光光度計(492 nm)測定吸光度(A值),根據公式計算細胞存活率、繪制曲線。存活率=(藥物組A值-空白組A值)/(對照組A值-空白組A值)。
1.6脂肪細胞分泌的TNF-α、IL-1β、IL-6檢測提取IH組大鼠前脂肪細胞后分為3組:IH組、LPS組、GBE組,LPS組予以1 μg/mL LPS處理12 h,GBE組予以100 mg/L的GBE處理12 h。實驗結束后收集各組上清液,按ELISA試劑盒說明書操作檢測各組細胞分泌的TNF-α、IL-1β、IL-6水平。
2 結果
2.1各組生理狀態比較造模過程中發現IH組大鼠嗜睡,睡眠過程中可聞及類似貓喘聲,鼻唇較NC組稍發紺,并可見呼吸暫停,清醒期飲食及活動量減少。IH+GBE組給予GBE期間大鼠生理活動與NC組無明顯差異,飲食、活動量正常。
2.2各組不同時間尾動脈血壓比較見表1。

表1 各組不同時間尾動脈血壓比較±s)
注:與NC組比較,#P<0.05;與IH組比較,△P<0.01。
2.3不同時間不同濃度GBE對前脂肪細胞存活率的影響見表2。
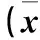
表2 不同時間不同濃度GBE對前脂肪細胞存活率的影響±s)
注:相同作用時間下與0 mg/L GBE比較,*P<0.05;相同藥物濃度下,與3 h比較,△P<0.05。
2.4各組TNF-α、IL-1β、IL-6水平比較見表3。
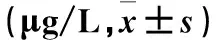
表3 各組TNF-α、IL-1β、IL-6水平比較
注:與IH組比較,*P<0.01;與LPS組比較,#P<0.01。
3 討論
脂肪細胞分泌的瘦素、TNF-α、IL-1等多種生物活性物質參與了機體正常的生命活動,缺氧可以刺激脂肪細胞因子的過度表達,引起血管內皮損傷、胰島素抵抗、炎癥反應等[9,10]。OSAS疾病進展中肥胖、缺氧、高血壓三者互相作用形成惡性循環[11],使臨床治療收效欠佳。有數據表明,高血壓患者中OSAS的發生率可達50%以上,而有30%的OSAS患者同時合并高血壓。因此,抑制脂肪細胞炎性物質的過度分泌是治療OSAS引起高血壓的重要途徑之一。
GBE主要有效成分是黃酮和萜類內酯,黃酮類可以清除自由基、抗脂質過氧化,萜類內酯與絲裂原活化蛋白激酶可以抑制炎癥反應[12]。趙外歐等[13]研究發現,GBE可以通過NF-κB信號通路抑制缺氧引起的血管內皮細胞損傷。Eckert等[14]研究發現,黃酮、銀杏內酯可以降低阿爾茨海默病的氧化應激反應。以上研究均提示,GBE可減輕氧化性損傷。本研究發現,OSAS動物模型給予GBE治療可以明顯降低高血壓的發生,在細胞水平給予GBE可以提高前脂肪細胞存活率,且呈劑量、時間依賴性;可顯著抑制脂肪細胞炎性因子TNF-α、IL-1β、IL-6的表達。提示GBE對OSAS引起的高血壓有一定的治療作用,這可能是與抑制脂肪細胞的炎性因子分泌有關。
[1] Costa C, Santos B, Severino D, et al. Obstructive sleep apnea syndrome: An important piece in the puzzle of cardiovascular risk factors[J]. Clin Investig Arterioscler, 2015,27(5):256-263.
[2] Fan JF, Fan WW, Gu YH, et al. The relationship between abdominal fat volume and obstructive sleep apnea hypopnea syndrome in obesity people[J]. Zhonghua Zheng Xing Wai Ke Za Zhi, 2013,29(1):37-39.
[3] Lewis L, Aronne LJ, Beilin LJ, et al. Obesity-related hypertension: pathogenesis, cardiovascular risk, and treatment: a position paper of The Obesity Society and the American Society of Hypertension[J]. Obesity, 2013,21(1):8-24.
[4] Lu J, Wu X, Teh BK. The regulatory roles of C1q[J]. Immunobiology, 2007,212(4-5):245-252.
[5] 李曉波,翁春艷,王建剛.脂肪因子chemerin與高血壓的關系[J].基礎醫學與臨床,2015,35(12):1691-1694.
[6] Isah T. Rethinking Ginkgo biloba L.: Medicinal uses and conservation[J]. Pharmacogn Rev, 2015,9(18):140-148.
[7] 羅熒荃,黃國慶,楊宇.慢性間歇低氧誘發大鼠高血壓模型的建立[J].中國新藥雜志,2006,15(22):1930-1933.
[8] Von Heimburg D, Kuberka M, Rendchen R, et al. Preadipocyte-loaded collagen scaffolds with enlarged pore size for improved soft tissue engineering[J]. Int J Artif Organs, 2003,26(12):1064-1076.
[9] 于進海,周林康,吳麗貞,等.肥胖的基礎研究[J].生命科學,2015,27(3):268-279.
[10] Waki H, Tontonoz P. Endocrine functions of adipose tissue[J]. Annu Rev Pathol, 2007,2(2):31-56.
[11] Jelic S, Jemtel TL. Inflammation, Oxidative stress, and the vascular endothelium in obstructive sleep apnea[J]. Trends Cardiovasc Med, 2008,18(7):253-260.
[12] Chu X, Ci X, He J, et al. A novel anti-inflammatory role for ginkgolide B in asthma via inhibition of the ERK/MAPK signaling pathway[J]. Molecules, 2011,16(9):7634-7648.
[13] 趙外歐,李相軍.NF-κB參與銀杏葉提取物保護血管內皮細胞的作用[J].中國老年學雜志,2015,35(1):178-179.
[14] Eckert A. Mitochondrial effects of Ginkgo biloba extract[J]. Int Psychogeriatr, 2012,24(Suppl 1):S18-S20.
Effect of Ginkgo biloba extract on OSAS rats with secondary hypertension
LIYanhong1,CHENMeixi
( 1GuilinMedicalUniversity,Guilin541001,China)
Objective To investigate the effect and mechanism of Ginkgo biloba extract (GBE) on the obstructive sleep apnea hypoxia syndrome (OSAS) rats with secondary hypertension. MethodsThe intermittent hypoxia (IH) rat models were established. Thirty Wistar rats were randomly divided into the normal oxygen group (NC group), IH group and GBE treatment group (IH+GBE group). We recorded the changes of blood pressure and physiological statement on week 3, 6 and 9. After 9 weeks, the preadipocytes near kidney of each group were extracted and identified, MTT was used to detect the cell viability and proliferation rates of rat preadipocytes which were cultured with 12.5, 25, 50, 100, 200 and 400 mg/L GBE for treatment of 3, 6, 12 and 24 hours. The preadipocytes in the IH groups were extracted and then were divided into the hypoxia control group, LPS-stimulated hypoxia group (LPS group) and GBE-treated hypoxia group (GBE group). After 12 hours, the inflammatory cytokines TNF-α, IL-1β and IL-6 contents in the cell supernatant were detected. Results ① The blood pressure of the IH group was gradually increased with the time of hypoxia as compared with that of the NC group (P<0.05 orP<0.01), and the blood pressure in the IH+GBE group maintained normal with the prolonged time of hypoxia. ② GBE could promote adipocyte′s growth with a dose-time relationship (allP<0.05). ③ The levels of TNF-α, IL-1β and IL-6 in the LSP group were significantly higher, but those were significantly lower in the GBE group (allP<0.01).ConclusionGBE has therapeutical effect on OSAS-induced hypertension, which may be achieved by promoting the proliferation of preadipocytes, inhibiting the levels of adipocytes and improving the degree of OSAS inflammation.
obstructive sleep apnea syndrome; hypertension; Ginkgo biloba extract; adipocyte; inflammatory factor
國家自然科學基金項目(81060009);廣西衛生廳重點科研項目(重 2010047);廣西自然科學基金項目(2013jjAA40386)。
李艷紅(1989-),女,碩士,主要從事呼吸睡眠研究。E-mail:591952247@qq.com
簡介:陳梅晞(1962-),女,副主任醫師,教授,主要從事睡眠呼吸疾病和慢性阻塞性肺疾病診治。E-mail:chenmx@glmc.edu.cn
10.3969/j.issn.1002-266X.2016.17.005
R562
A
1002-266X(2016)17-0016-03
2016-01-04)

