慢性阻塞性肺疾病合并肺癌與單純肺癌臨床特征差異的分析
杜建飛 崔立春 耿會生 蔣冬梅 白莉
?
慢性阻塞性肺疾病合并肺癌與單純肺癌臨床特征差異的分析
杜建飛1崔立春1耿會生1蔣冬梅1白莉2
710016 西安,長安醫院腫瘤科1
【摘要】目的探討慢性阻塞性肺疾病(COPD)合并肺癌與單純肺癌患者之間臨床特征的差異,為肺癌療效和預后判斷提供依據。方法選取我院98例COPD合并肺癌患者及62例單純肺癌患者為研究對象,分析二組的臨床癥狀、原發腫瘤位置、性別、年齡、吸煙史、病理類型及TNM分期等資料。結果主要癥狀如咳嗽、咳痰、呼吸困難及咯血在COPD合并肺癌組與單純肺癌組患者之間具有明顯統計學差異,而胸痛及骨轉移所致疼痛在兩組之間未見明顯統計學差異;COPD合并肺癌組患者一般以中央型、男性、吸煙為主,病理學以鱗狀細胞癌多見,而單純肺癌組患者則以周圍型、女性、不吸煙及腺癌為常見,二者之間存在明顯統計學差異,但是在年齡、TNM分期之間無明顯統計學差異。結論COPD合并肺癌與單純肺癌為相互獨立性疾病,臨床特征差異有利于二者的鑒別診斷,為療效和預后判斷提供依據。
【關鍵詞】支氣管肺癌;肺疾病,慢性阻塞性;臨床特征
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是以不完全阻塞性肺通氣障礙為臨床特征的呼吸系統常見病、高發病。原發性支氣管肺癌(簡稱肺癌)為呼吸系統最常見的惡性腫瘤。近年來隨著我國人口老齡化,煙草消耗增長和大氣嚴重污染,二者發病率均呈明顯升高趨勢。在臨床表現上二者均為咳嗽、咳痰、氣短等,無特異性表現,容易誤診及漏診而延誤診斷治療。大量循證醫學證據表明COPD與肺癌的發生存在著密切的聯系[1-4]。
資料與方法
一、 一般資料
收集我院2012年至2015年收治的98例COPD合并肺癌患者和62例單純肺癌患者,COPD診斷依據為中華醫學會呼吸病學分會制定的COPD診斷標準。所有患者均經病理學證實,病理分型和TNM分期依據為國際肺癌研究協會2009 年第七版分期標準。
二、研究方法
根據患者影像學及肺功能檢查結果將患者分為98例COPD合并肺癌組與62例單純肺癌組,分析患者性別、年齡、吸煙史、臨床表現、胸部CT表現、肺癌病理類型、TNM分期等。
三、統計學方法
采用SPSS 13.0 軟件對結果進行統計學分析。計數資料比較采用χ2檢驗,以P<0.05為差異有統計學意義。
結 果
一、2組患者臨床癥狀比較
咳嗽、咳痰、呼吸困難及咯血為COPD合并肺癌的常見臨床癥狀,其發病率與單純肺癌患者相比具有明顯統計學差異(P<0.05),而胸痛及骨轉移所致疼痛COPD組與單純肺癌組未見明顯統計學差異,見表1。
二、2組患者原發灶位置比較
胸部CT表現可見,COPD合并肺癌組患者原發腫塊以中央型常見,而單純肺癌組原發腫瘤則以周圍性為主,二者之間存在明顯統計學差異(P<0.05),見表2。
三、2組患者一般情況及病理類型比較
COPD合并肺癌患者一般以男性、吸煙為主,病理學以鱗狀細胞癌多見,而單純肺癌組患者則以女性、不吸煙及腺癌常見,二者之間存在明顯統計學差異,兩組患者在年齡、TNM分期之間未見明顯統計學差異(P>0.05), 表3。
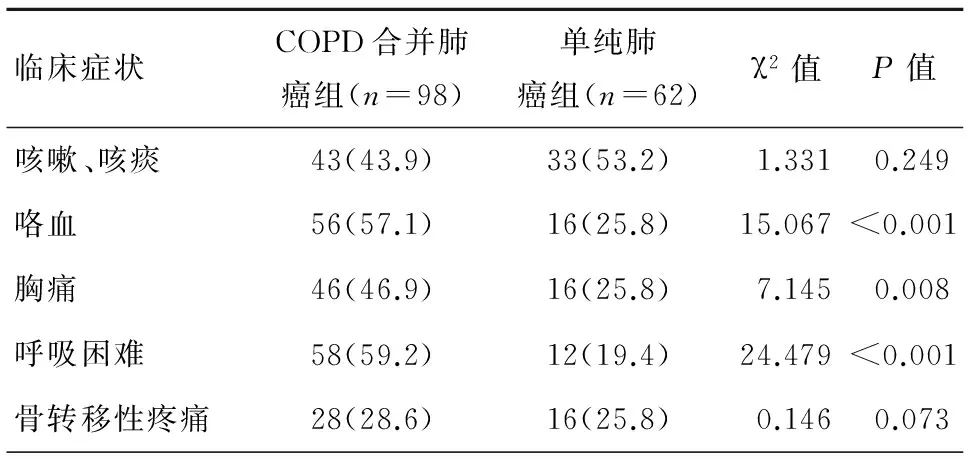
表1 2組患者臨床癥狀比較[n(%)]
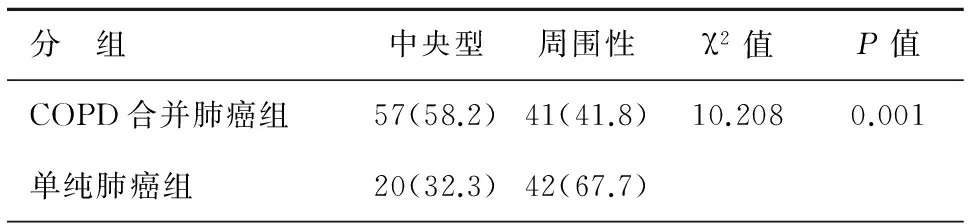
表2 2組患者肺癌原發病灶位置比較[n(%)]
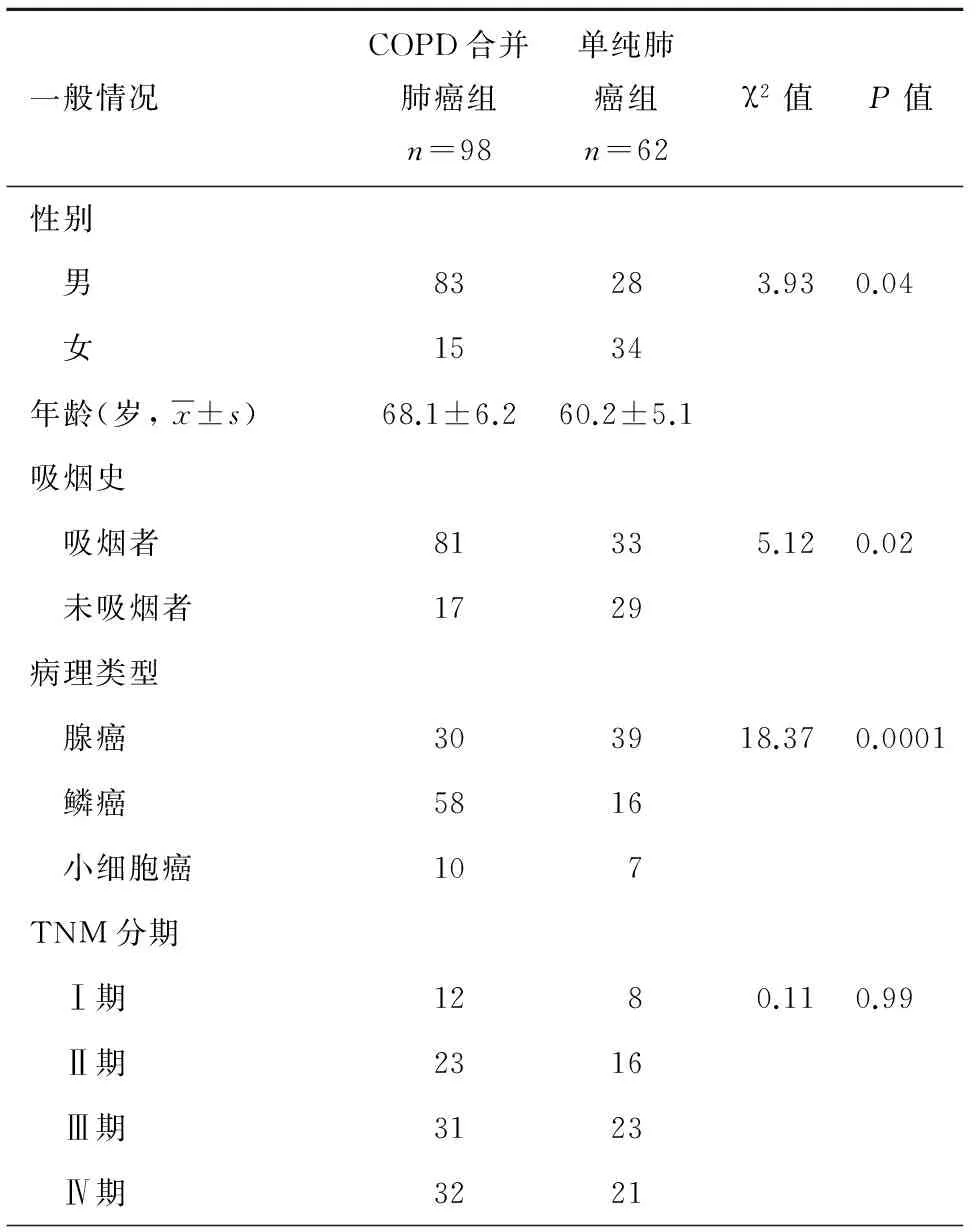
表3 2組患者一般情況及病理類型比較
討 論
COPD和肺癌同為呼吸系統高發性疾病和高致死性疾病。2010年COPD已成為全球常見死亡病因的第三位[5]。2011年,我國登記的新發肺癌患者約65萬人,而死于肺癌的患者約為52萬人[6]。吸煙為公認的COPD與肺癌的共同致病因素之一[7-8]。研究認為吸煙可以增加男、女性患肺癌的風險,分別為17.4%和11.6%;而不吸煙者患肺癌男、女的風險僅為1.3%和1.4 %[9]。COPD和肺癌的發病率與患者在煙霧中的暴露具有明顯的相關性[10-12]。煙草中尼古丁、焦油、亞硝胺、苯并芘等多種氧化劑刺激氣道上皮使纖毛運動減弱,吞噬細胞吞噬清除能力降低,使氣道凈化能力減弱,同時也刺激平滑肌細胞、中性粒細胞、巨噬細胞及多種基質細胞在肺內聚集與活化。活化后的細胞可以分泌金屬蛋白酶 、蛋白水解酶等降解、破壞肺泡和肺泡壁組織結構,進而導致肺組織失去原有結構和彈性,促進COPD的發生。另外,煙草中的有害成份作用于呼吸道黏膜上皮,導致細胞發育不良,化生、腺瘤樣增生、DNA損傷最終導致惡性改變[13-14]。大量的研究表明,與不吸煙者相比,吸煙者發生肺癌的危險性平均增高4~10倍,且吸煙量與肺癌之間存在著明顯的量-效關系,吸煙時間、吸煙量與肺癌的發生率呈正相關[15]。研究認為50%~70%肺癌患者發病與COPD有關,COPD患者支氣管黏膜清除功能障礙而使致癌有害物長期存留[16];氧化劑與抗氧化劑功能失調而使氧自由基損傷DNA[17];慢性炎癥持續刺激使DNA損傷轉變為DNA突變而誘發惡性改變等多種機制共同作用而導致肺癌發生。本研究中,COPD合并肺癌組中吸煙者明顯高于單純肺癌組,且差別具有統計學意義。COPD合并肺癌原發病灶以中央型為主,而單純肺癌組中則以周圍型為主。病理分類COPD合并肺癌組以鱗癌為主,單純肺癌組則以腺癌為主,二者之間存在明顯統計學差異。而在小細胞癌的發病率中兩組無明顯差別,本研究結果再次驗證了COPD為肺癌的獨立危險因素,特別是在肺鱗狀細胞癌患者中。對于氣道梗阻的吸煙患者其患肺癌的風險為肺功能正常患者的5倍[18],肺癌在COPD患者中的高發病率表明二者之間可能存在著共同的發病機制。
COPD與肺癌之間存在著共同的發病機制,目前較為廣泛認可的是慢性炎癥在COPD與肺癌這兩種疾病的發生中占據著重要的地位。活性氧[19]和氧自由基[20-21]是炎癥反應與腫瘤之間聯系的重要中介分子。正常肺臟內皮細胞凋亡需線粒體轉錄因子A調控,當患有COPD時線粒體轉錄因子A缺失,線粒體功能失調使正常肺臟內皮細胞凋亡失控而發生過度磷狀細胞增生,最終導致肺癌發生[18]。核因子NF-κB 同樣是慢性炎癥與腫瘤之間聯系的重要因子,慢性炎癥時組織可過度表達轉錄因子NF-κB。NF-κB可刺激IL-1、IL-6、IL-8 和TNF-α等多種細胞因子表達,而這些細胞因子均為細胞周期分子,參與細胞凋亡的調控[22]。盡管目前認為慢性炎癥在COPD與肺癌這兩種疾病發生中占據著重要的地位,但是其如何誘導COPD向肺癌轉變的機制仍不明確,未來的研究仍然應以二者的共同機制為主要研究方向。
參考文獻
1任成山, 白莉, 錢桂生. 慢性阻塞性肺疾病合并肺癌臨床特征及新理念[J/CD]. 中華肺部疾病雜志: 電子版, 2015, 8(2): 137-142.
2廖晨, 余祖濱, 張萍, 等. 慢性阻塞性肺疾病合并肺癌122例臨床特征分析[J/CD].中華肺部疾病雜志, 2015, 8(1): 25-29.
3de-Torres JP, Wilson DO, Sanchez-Salcedo P, et al. Lung cancer in patients with chronic obstructive pulmonary disease. Development and validation of the COPD Lung Cancer Screening Score[J]. Am J Respir Crit Care Med, 2015, 191(3): 285-291.
4Griffin JP, Tolley EA, Zaman MK, et al. Chronic obstructive pulmonary disease with lung cancer: Prevalence, severity, and common pathogenesis[J]. J Cancer Res Ther, 2016, 4(1): 1-6.
5Burney PG, Patel J, Newson R, et al. Global and regional trends in COPD mortality, 1990-2010[J]. Eur Respir J, 2015, 45(5): 1239-1247.
6陳萬青, 鄭榮壽, 曾紅梅, 等. 2011 年中國惡性腫瘤發病和死亡分析[J]. 中國腫瘤, 2015, 24(1): 1-10.
7Loeb LA. Tobacco Causes Human Cancers-A Concept Founded on Epidemiology and an Insightful Experiment Now Requires Translation Worldwide[J]. Cancer Res, 2016, 76(4): 765-766.
8Hecht SS, Carmella SG, Murphy SE, et al. Tobacco smoke toxicant and carcinogen biomarkers and lung cancer susceptibility in smokers[J]. J Thoracic Oncology, 2016, 11(2): S7-S8.
9Villeneuve PJ, Mao Y. Lifetime probability of developing lung cancer,by smoking status, Canada[J]. Can J Public Health, 1993, 85(6): 385-388.
10Mariani TJ. Respiratory disorders: Ironing out smoking-related airway disease[J]. Nature, 2016, 531(7596): 586-587.
11Terzikhan N, Verhamme KM, Hofman A, et al. Prevalence and incidence of COPD in smokers and non-smokers: the Rotterdam Study[J]. Eur J Epidemiol, 2016.
12Bastian LA, Gray KE, DeRycke E, et al. Differences in Active and Passive Smoking Exposures and Lung Cancer Incidence Between Veterans and Non-Veterans in the Women′s Health Initiative[J]. Gerontologist, 2016, 56 (Suppl 1): S102-S111.
13Tuder RM, Petrache I. Pathogenesis of chronic obstructive pulmonary disease[J]. J Clin Invest, 2012, 122(8): 2749-2755.
14Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics[M]. Lung Cancer and Personalized Medicine. Springer International Publishing, 2016: 1-19.
15Wang Z, Seow WJ, Shiraishi K, et al. Meta-analysis of genome-wide association studies identifies multiple lung cancer susceptibility loci in never-smoking Asian women[J]. Hum Mol Genet, 2016, 25(3): 620-629.
16Kiri VA, Soriano J, Visick G, et al. Recent trends in lung cancer and its association with COPD: an analysis using the UK GP Research Database[J]. Prim Care Respir J, 2010, 19(1): 57-61.
17Lennon FE, Salgia R. Mitochondrial dynamics: biology and therapy in lung cancer[J]. Expert Opin Investig Drugs, 2014, 23(5): 675-692.
18Young RP, Hopkins RJ. Link between COPD and lung cancer[J]. Respir Med, 2010, 104(5): 758-759.
19Kasiappan R, Safe SH. ROS-Inducing Agents for Cancer Chemotherapy [J]. Reactive Oxygen Species, 2016, 1(1): 22-37.
20Kuranaga Y, Yamada N, Kashiwaya M, et al. Anti-Oncogenic gem-Dihydroperoxides Induce Apoptosis in Cancer Cells by Trapping Reactive Oxygen Species[J]. Int J Mol Sci, 2016, 17(1): 71.
21Lo KY, Wu SY, Sun YS. A microfluidic device for studying the production of reactive oxygen species and the migration in lung cancer cells under single or coexisting chemical/electrical stimulation[J]. Microfluidics and Nanofluidics, 2016, 20(1): 1-11.
22Shen HM, Tergaonkar V. NF-κB signaling in carcinogenesis and as a potential molecular target for cancer therapy[J]. Apoptosis, 2009, 14(4): 348-363.
(本文編輯:王亞南)
杜建飛,崔立春,耿會生,等. 慢性阻塞性肺疾病合并肺癌與單純肺癌臨床特征差異的分析[J/CD]. 中華肺部疾病雜志: 電子版, 2016, 9(3): 275-277.
DOI:10.3877/cma.j.issn.1674-6902.2016.03.009
基金項目:國家自然科學基金資助項目(81370139)
通訊作者:白莉,Email:blpost@126.com
中圖法分類號:R563,R734.2
文獻標識碼:A
Corresponding author:Bai Li, Email:blpost@126.com
(收稿日期:2016-03-20)
Retrospective analysis of clinical features differences for lung cancer patients with or without chronic obstructive pulmonary disease
Dujianfei1,Cuilichun1,GengHuisheng1,JiangDongmei1,BaiLi2.1Desect1mentofOncology,ChanganHospital,Xi′an710016,China;2Desect1mentofRespiratoryDiseases,XinQiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China
【Abstract】ObjectiveTo investigate the difference of clinical features for lung cancer patients with or without chronic obstructive pulmonary disease (COPD) and explore some evidences of outcome evaluation and prognosis. Methods98 cases of lung cancer patients with COPD and 62 cases without COPD were treated in Changan hospital. The clinical features of both groups were collected, include clinical symptoms, tumor location, gender, age, smoking history, histological type and TNM staging. ResultAmong the evaluable patients of two groups, the incidence rate of cough, sputum, dyspnea and hemoptysis, significant higher in COPD group (P<0.05). There were no significant difference the clinical symptom of chest pain and pain caused by bone metastases between two groups. The cancer characteristics of patients with COPD were generally central location, male, smoking, and squamous histopathology. On the other hand, patients without COPD were more likely peripheral location, women, not-smoking and adenocarcinoma histopathology. There were no significant differences for age, TNM stage between two groups. ConclusionLung cancer with or without COPD were independence disease and had different clinical characteristics. It may be helpful to treatment outcome evaluation and prognosis.
【Key words】Bronchus lung cancer;Chronic obstructive pulmonary disease;Clinical features
400037 重慶,第三軍醫大學新橋醫院呼吸內科2

