干擾素-α治療慢性丙型肝炎的療效預測模型
陸曉梅,徐 銀,黃 鵬,陳明珠,王 潔,蘇 靜,喻榮彬
(1.南京醫科大學公共衛生學院 流行病學系,江蘇 南京,211166; 2.南京醫科大學護理學院,江蘇 南京,210029)
?
干擾素-α治療慢性丙型肝炎的療效預測模型
陸曉梅1,徐銀1,黃鵬1,陳明珠1,王潔2,蘇靜1,喻榮彬1
(1.南京醫科大學公共衛生學院 流行病學系,江蘇 南京,211166; 2.南京醫科大學護理學院,江蘇 南京,210029)
摘要:目的評價普通干擾素-α聯合利巴韋林治療慢性丙型肝炎的療效,探討其影響因素并建立預測模型。方法采用前瞻性隊列研究,對句容市人民醫院慢性丙型肝炎住院患者進行普通干擾素-α聯合利巴韋林治療48周并隨訪至治療結束后24周,觀察治療不良反應及應答情況。采用Logistics回歸分析其影響因素,并運用分類樹建立預測模型。結果216例慢性丙型肝炎患者完成了治療周期及隨訪,其持續病毒學應答率(SVR)為61.2%。SVR組與非SVR組基線病毒載量、白蛋白、血小板計數、甲胎蛋白及血糖存在顯著差異。多因素Logistics回歸分析顯示,基線病毒載量高(≥106 IU/mL)者或血糖含量較高者更不易獲得SVR。血小板計數較高者容易獲得SVR(OR=1.02,95%CI=1.00~1.04)。SVR預測模型顯示相對基線血小板計數低(<140×109/L)者,血小板計數高者獲得SVR的可能性增加17.9%。高血小板計數者中,基線HCV RNA低者(<106 IU/mL)更易獲得SVR(79.7%:57.9%)。治療過程中不良反應有早期感冒樣癥狀(51.9%)、胃腸道反應(14.8%)、血象的改變(58.8%)、血糖升高(18.1%)、精神癥狀(8.8%)、甲狀腺功能亢進(1.4%)、皮疹(14.8%)、脫發(6.5%)。結論普通干擾素聯合利巴韋林治療慢性丙型肝炎療效尚可,不良反應的程度較輕。基線病毒載量、血糖及血小板計數可能是丙型肝炎治療效果的影響因素。
關鍵詞:慢性丙型肝炎; 干擾素; 持續病毒應答; 不良反應
丙型肝炎是由丙型肝炎病毒(HCV)感染所致的血源性傳播疾病,目前呈現全球流行趨勢。最新統計數據[1]顯示全球HCV感染率約為1.6%,中國成人HCV感染率高達1.3%,屬于HCV中高度感染區。HCV感染后易慢性化,進而發展為肝硬化以及肝細胞癌的比例較高[2]。干擾素-α(IFN-α)是抗HCV的有效藥物,但仍超過50%的患者無法達到病毒持續應答(SVR)[3]。干擾素治療存在較多的副作用,如流感樣癥候群、疲勞、骨髓抑制(貧血、白細胞減少、中性粒細胞減少、血小板計數下降等)、誘發自身抗體(抗核抗體陽性、抗甲狀腺抗體陽性)、神經精神異常等[4-7]。本研究采用前瞻性隊列隨訪設計,觀察普通干擾素-α聯合利巴韋林的治療效果以及不良反應的發生情況,并進一步分析其影響因素,建立治療結局預測模型,現報告如下。
1資料與方法
1.1一般資料
選取句容市人民醫院感染科2012年3月—2013年10月臨床治療的慢性丙型肝炎患者,符合2004年《丙型肝炎防治指南》中慢性丙型肝炎的臨床診斷標準,并簽署知情同意書。納入標準:血清HCV抗體陽性超過6個月,HCV RNA持續陽性,且首次接受抗病毒治療。排除標準:① 年齡<18周歲; ② 合并HAV、HBV、HEV及HIV感染; ③ 合并腫瘤及其他自身免疫性疾病; ④ 合并酒精性肝病、藥物性肝病等肝損害性疾病、妊娠或哺乳期婦女; ⑤ 合并甲亢、抑郁癥、癲癇、嚴重心腎疾病,器官移植者等。
1.2治療方法
根據患者的體質量、耐受程度、年齡等給予IFN-α 3~5 μmol/L,隔天1次,皮下注射,聯合口服利巴韋林(RBV) 800~1 000 mg/d,療程為48周,停藥隨訪24周。停藥原則參照標準指南[8]。
1.3療效評價
1.3.1療程觀察:治療前,對所有研究對象進行流行病學問卷調查,包括年齡、性別、職業、家族史等可能的HCV暴露接觸史。血、尿、糞常規、肝腎功能、HCV RNA、甲狀腺功能及血糖等。治療開始后4、8、12、24、48、72周隨訪上述指標。
1.3.2不良反應觀察項目:① 早期感冒樣癥狀; ② 食欲下降、惡心、嘔吐等胃腸道反應; ③ 血常規異常:白細胞、中性粒細胞、血小板下降; ④ 精神癥狀:主要表現為興奮、失眠、頭暈、抑郁、注意力不集中等; ⑤ 甲狀腺疾病:甲狀腺功能減退或亢進; ⑥ 脫發及皮膚情況; ⑦ 糖代謝異常。
1.3.3療效評估:采用2004年《中國丙型肝炎防治指南》中療效判定標準。早期病毒學應答(EVR):治療12周后HCV RNA下降2個對數級以上或低于檢測下限。持續病毒性應答(SVR):治療48周,且隨訪24周后HCV RNA低于檢測下限。
1.4統計學方法
采用STATA 12.0統計學軟件,計量資料用均數±標準差表示,采用t檢驗、單因素方差分析;計數資料用率表示,采用χ2檢驗。治療結局與變量之間的關聯分析采用單因素及多因素Logistics回歸分析。持續病毒應答預測模型及變量篩選采用分類樹法。P<0.05為差異有統計學意義。
2結果
2.1人口學特征
本研究共納入216例完成治療及隨訪的慢性丙型肝炎患者,其中持續應答者133例 (61.2%)。持續應答組與非持續應答組基線病毒載量、白蛋白、血小板計數、甲胎蛋白及血糖存在顯著差異。見表1。持續應答組中基線病毒載量≥106IU/mL者比例、甲胎蛋白及血糖顯著低于未達到持續應答組(P=0.033、0.002、0.002),而基線白蛋白和血小板計數持續應答組顯著高于非持續應答組(P=0.001、0.037)。
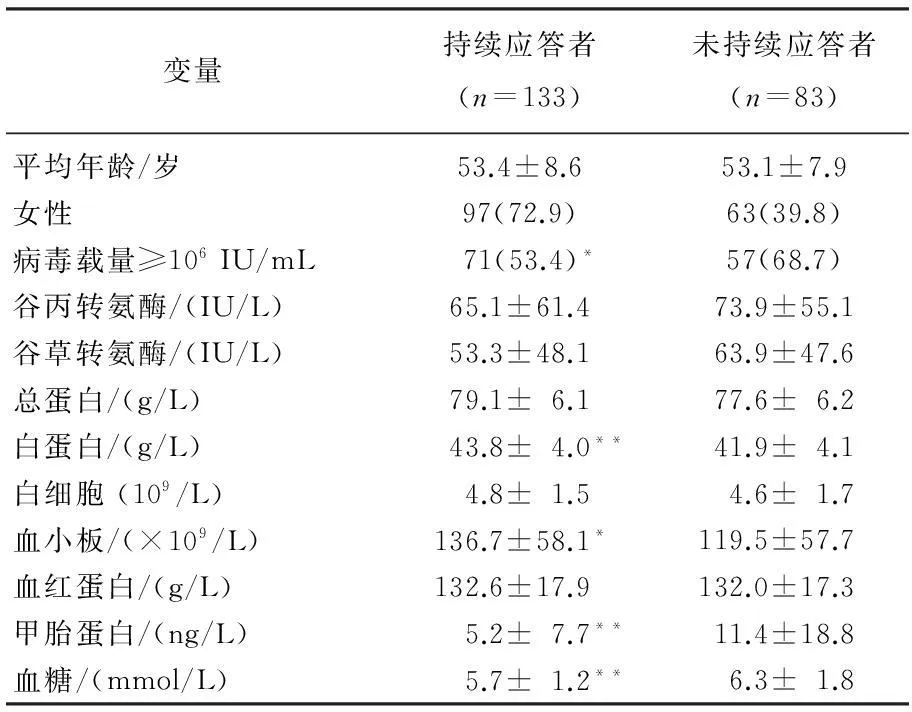
表1 慢性丙肝治療不同結局組間人口學特征及基線變量比較[n(%)]
與未持續應答者比較,*P<0.05,**P<0.01。
2.2持續病毒學應答影響因素
單因素Logistics回歸分析顯示,基線病毒載量、白蛋白量、血小板計數、甲胎蛋白及血糖量可影響丙肝抗病毒治療結局。調整這些因素后分析顯示,基線病毒載量≥106IU/mL者或血糖含量較高者更不易獲得持續應答,而血小板計數較高者容易獲得持續應答(OR=1.02,95% CI為1.00~1.04),見表2。
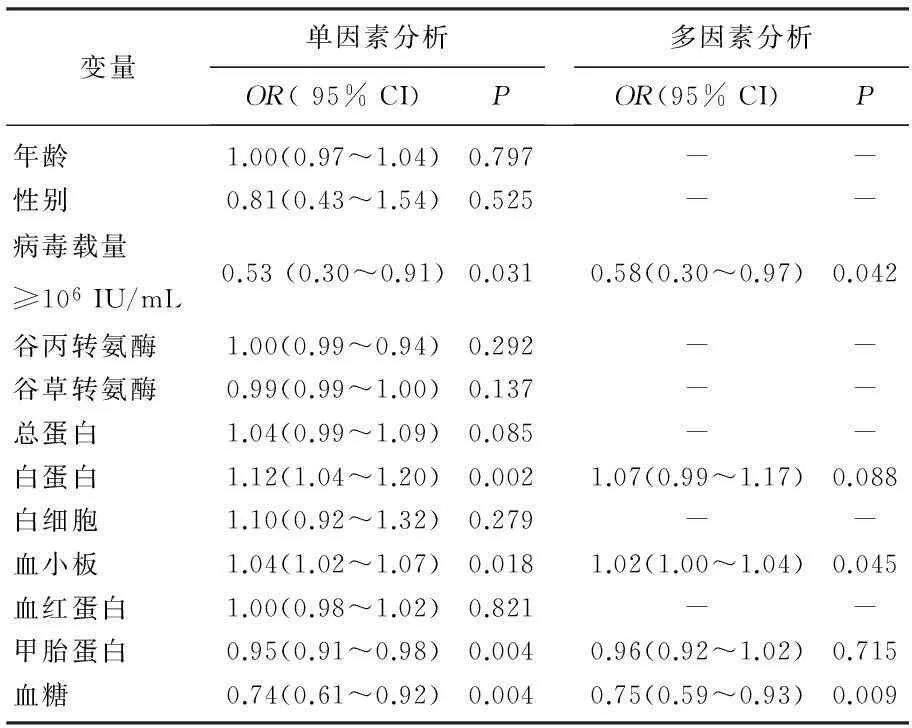
表2 丙型肝炎治療持續應答影響因素分析
2.3基線病毒載量影響丙型肝炎病毒清除
根據基線病毒載量是否大于106IU/mL,將研究對象分成2組。觀察2組治療后4、8、12、24、48周及隨訪24周HCV RNA陰轉率差別,結果顯示低基線病毒載量組HCV RNA陰轉率在各時間點上顯著高于高病毒載量組(P<0.05)。基線病毒載量對持續病毒應答產生有重要影響。見圖1。
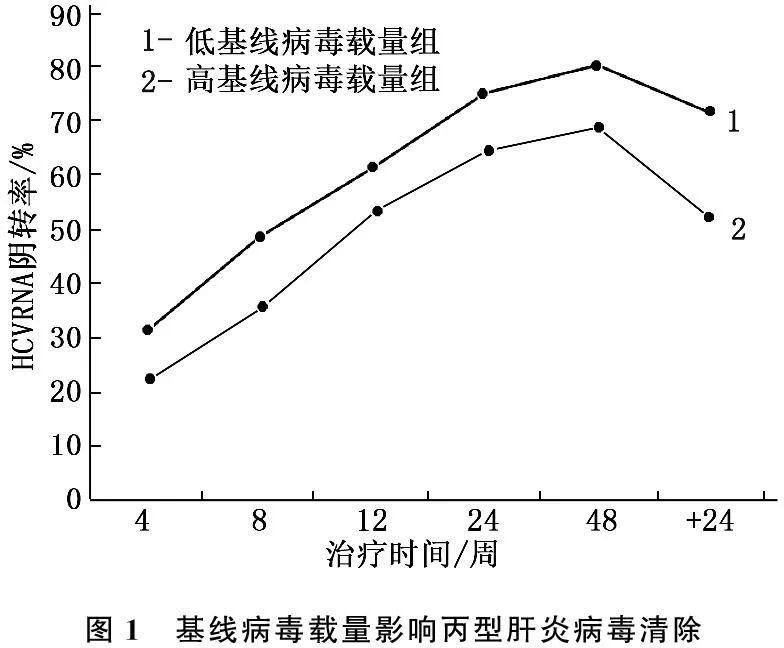
圖1 基線病毒載量影響丙型肝炎病毒清除
2.4預測治療結局模型
對數據進一步挖掘,建立持續病毒應答預測模型。選擇基線血小板計數和病毒載量2個參數,將研究對象分為3個亞組。相對血小板計數<140×109/L患者,基線血小板計數高者獲得SVR的可能性更大(分別為67.9%和50.0%)。經血小板計數分組后,基線HCV RNA低者(<106IU/mL)更易獲得SVR(分別為79.7%和57.9%)。該模型的靈敏度和特異度分別為79.5%和70.2%。
2.5不良反應的觀察
本組病例觀察發現,主要的不良反應有早期感冒樣癥狀、胃腸道反應、血象的改變、血糖升高、精神癥狀、甲狀腺功能亢進、皮疹、脫發等,見表3。血象改變發生率最高,其中127例患者均有不同程度白細胞、中性粒細胞、血小板計數下降,其中白細胞減少112例(51.9%),中心粒細胞減少120例(55.6%),血小板減少98例(45.4%)。主要發生于用藥早期,第2周明顯下降,12周開始回升,治療結束時可基本恢復到治療前水平。18.1%的患者發生血糖值升高,且治療結束時血糖≥7.00者由原來的14例上升為25例。3例因為發生甲亢而終止治療,均為女性,分別發生于用藥后第6、8、9個月。
3討論
慢性丙型肝炎治療是世界性難題,目前發達國家及國內部分發達地區已經推廣聚乙二醇干擾素,效果比普通干擾素好,但價格昂貴,難以在經濟條件不佳的地區普遍應用[9]。因此,在國內許多資源有限的地區,普通干擾素不可替代,研究普通干擾素的意義仍然重大。本研究納入216例普通干擾素-α治療慢性丙型肝炎患者,且進行前瞻性隊列隨訪72周。本研究中患者全部來自于句容地區既往有償獻血人群,這部分人群大多是在上世紀90年代初通過有償獻血方式感染HCV,感染時間較明確,病程均為20年左右,大多數人未患有其他免疫性疾病,因此相對于靜脈注射吸毒、腎透析等HCV高感染人群來說,該人群是研究丙肝治療效果最好人群樣本。另外,由于治療費用較高,藥物副反應大,且隨訪時間比較長,失訪難以避免。但該人群長期居住在戶籍地,流動性小,聯系便捷,有效地降低了失訪率。
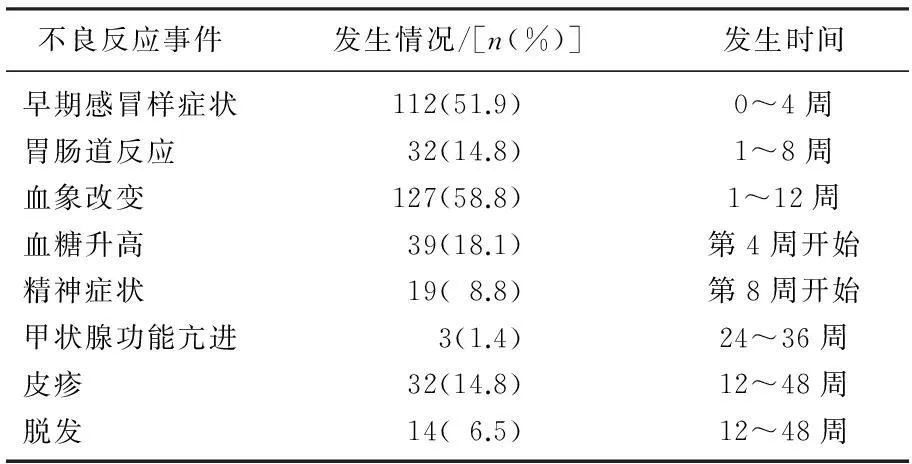
表3 丙型肝炎治療不良反應發生情況
本研究結果顯示,干擾素聯合利巴韋林的治療方案耐受性和安全性良好,大部分患者可以按預定方案完成治療,不良反應比較輕微,而且這些副作用在患者停藥之后都能迅速恢復。其中216例治療患者最終達到持續性病毒學應答者有133例,持續應答率為61.6%,與國內其他報道一致[10]。本研究發現患者具有較低的基線病毒載量、低血糖及高血小板計數可能更易獲得SVR,這與之前國內外的一些研究結果相一致[16-17]。分類樹模型預測提示基線血小板計數較高者(≥140×109/L)較低者SVR率增加17.9%。高血小板計數者中,基線病毒載量較低者獲得SVR的可能大大增加。這些均提示在抗病毒治療前盡量增加患者血小板計數,降低病毒載量。但本研究模型的建立仍然具有局限性,靈敏度和特異度不高。丙肝治療效果影響因素眾多,本研究只針對治療中常規檢測的生化指標數據進行了分析,而諸如病毒基因型以及宿主IL28B基因多態性等因素也對丙肝治療效果起著重要作用[18-19],但本研究未納入,進而降低了預測模型效果。
本次治療過程中血細胞下降發生率最高,58.8%的患者均有不同程度的白細胞、中性粒細胞、血小板計數下降,主要發生于用藥早期,第2周明顯下降,12周開始回升,治療結束時可基本恢復到治療前水平。其發生機制主要由于IFN有輕至中度的骨髓抑制,可逆性抑制粒系晚期前體細胞的增殖;使血小板生成素轉錄受阻,滯留于毛細血管引起血小板減少[11-12]。值得注意的是,本次治療中18.1%的患者發生血糖值升高,且治療結束時血糖≥7.00者由原來的14例上升為25例。更為嚴重的是有3例女性患者發生甲亢停止治療。IFN治療后發生糖代謝紊亂甚至糖尿病近來已有報道[13],但發生率較低。說明IFN治療有可能會導致胰島β細胞損傷,降低了組織利用胰島素。因此,在治療前要詳細了解患者的背景,對于年齡偏大、肥胖、有家族史者要密切注意血糖、尿糖等變化。IFN治療引起甲狀腺功能紊亂的報道多發生于治療的中后期,且認為女性是誘發甲狀腺炎的危險因素[14-15]。本研究異常者均為女性,與報道一致。醫師應密切觀察患者臨床表現,結合甲狀腺功能指標,在內分泌科醫生指導下,決定用藥。
參考文獻
[1]Gower E,Estes C,Blach S,et al.Global epidemiology and genotype distribution of the hepatitis C virus infection[J].J Hepatol,2014,61(1 Suppl):45-57.
[2]Lavanchy D.The global burden of hepatitis C[J].Liver Int,2009,29:4-81.
[3]Muir AJ.The rapid evolution of treatment strategies for hepatitis C[J].Am J Gastroenterol,2014,109(5):28-635.
[4]Sulkowski M S,Cooper C,Hunyady B,et al.Management of adverse effects of Peg-IFN and ribavirin therapy for hepatitis C[J].Nat Rev Gastroenterol Hepatol,2011,8(4):212-223.
[5]McHutchison J G,Lawitz E J,Shiffman M L,et al.Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection[J].N Engl J Med,2009,361(6):580-593.
[6]陳吐芬,周勤,江曉靜,等.干擾素聯合利巴韋林治療丙型肝炎不良反應的發病機制及處理[J].肝臟,2014(7):543-548.
[7]鄧培媛,裴振峨,朱素君,等.干擾素不良反應綜述[J].臨床藥物治療雜志,2003,1(4):57-59,32.
[8]中華醫學會肝病學分會,傳染病與寄生蟲病學分會.丙型肝炎防治指南[J].臨床肝膽病雜志,2004,20(4):197-203.
[9]Manns M P,McHutchison J G,Gordon S C,et al.Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C:a randomised trial[J].Lancet,2001,358(9286):958-965.
[10]趙文莉,胡勤明,王保春,等.干擾素聯合利巴韋林治療丙型肝炎臨床療效分析[J].中國藥師,2009,12(5):639-640.
[11]曹學琳,孔曉清,閆鳳英,等.干擾素不良反應機制[J].生物醫學工程與臨床,2010,14:340-342.
[12]吳金金,李成忠.干擾素不良反應及其處理[J].世界臨床藥物,2009,30(6):334-338.
[13]戴琳,周復元.干擾素治療慢性病毒性肝炎致糖尿病2例報告[J].第一軍醫大學學報,2001,21(10):752-752.
[14]桑艷紅.干擾素-α所致甲狀腺功能異常6例診治分析[J].中國現代醫生,2010,48(21):121-122.
[15]黃雁翔,陳新月,馬麗娜,等.慢炎抗病毒治療患者甲狀腺功能異常及其影響因素[J].中華肝臟病雜志,2012,20(3):216-220.
[16]Kurosaki M,Tanaka Y,Nishida N,et al.Pre-treatment prediction of response to pegylated-interferon plus ribavirin for chronic hepatitis C using genetic polymorphism in IL28B and viral factors[J].J Hepatol,2011,54(3):439-448.
[17]Romero-Gómez M,Fernández-Rodríguez C M,Andrade R J,et al.Effect of sustained virological response to treatment on the incidence of abnormal glucose values in chronic hepatitis C[J].J Hepatol,2008,48(5):721-727.
[18]Tanaka Y,Nishida N,Sugiyama M,et al.Genome-wide association of IL28B with response to pegylated interferon-[alpha] and ribavirin therapy for chronic hepatitis C[J].Nat Genet,2009,41(10):1105-1109.
[19]Wohnsland A,Hofmann WP,Sarrazin C.Viral determinants of resistance to treatment in patients with hepatitis C[J].Clin Microbiol Rev,2007,20(1):23-38.
收稿日期:2016-01-13
基金項目:國家自然科學基金面上項目(81473029,81273146); 江蘇高校優勢學科建設工程資助項目(PAPD)
通信作者:喻榮彬,E-mail:rongbinyu@njmu.edu.cn
中圖分類號:R 512.6; R 453
文獻標志碼:A
文章編號:1672-2353(2016)15-005-04
DOI:10.7619/jcmp.201615002
Efficacy prediction model of interferon-α treatment for chronic hepatitis C
LU Xiaomei1,XU Yin1,HUANG Peng1,CHEN Mingzhu1, WANG Jie2,SU Jing1,YU Rongbin1
(1.Department of Epidemiology,School of Public Health of Nanjing Medical University,Nanjing,Jiangsu,211166; 2.Nuring College of Nanjing Medical University,Nanjing,Jiangsu,210029)
ABSTRACT:ObjectiveTo evaluate the curative effect of common interferon-α combined with ribavirin on the treatment of patients with chronic hepatitis C and to explore its influencing factors and establish the prediction model.MethodsThe patients with chronic hepatitis C were recruited from Jurong People′s Hospital.Prospective cohort study was used,and all the patients were treated with common interferon-α for 48 weeks,and were followed up at 24 weeks to observe the rate of sustained virological response (SVR) and adverse reactions.Effect factors were studied by Logistic regression analysis,and predication model was established by classification tree.ResultsTotally 216 patients completed the treatment and follow-up,and the SVR rate was 61.2%.There were significant differences in baseline viral load,albumin,platelet count,AFP (alpha fetoprotein) and blood glucose between SVR and non-SVR groups.Patients with higher baseline HCV RNA level (≥106 IU/mL) or blood glucose were less likely to get SVR.Patients with higher baseline platelet count (<140×109/L) were more likely to acquire SVR.The classification tree predication model of SVR showed that the probability of SVR increased by 17.9% in patients with higher baseline platelet count.In similar patients with high platelet count,those with lower baseline HCV RNA level (<106 IU/mL) were more likely to obtain SVR (OR=1.02,95%CI=1.00~1.04).Common adverse reactions were early flu-like symptoms (51.9%),gastrointestinal tract reaction (14.8%),hemogram changes (58.8%),hyperglycemia (18.1%),psychiatric symptoms (8.8%),hyperthyroidism (1.4%),rashes (14.8%) and alopecia (6.5%).ConclusionThe baseline HCV RNA level,blood glucose and platelet count may be associated with SVR of chronic hepatitis C.
KEYWORDS:chronic hepatitis C; interferon; sustained virological response; adverse reactions

