聚唾液酸-透明質酸接枝聚合物的合成及其在藥物緩釋載體中的應用
付 浩, 馮昌雨, 詹曉北, 朱 莉, 吳劍榮
(江南大學 生物工程學院 糖化學與生物技術教育部重點實驗室,江蘇 無錫 214122)
?
·研究論文·
聚唾液酸-透明質酸接枝聚合物的合成及其在藥物緩釋載體中的應用
付浩, 馮昌雨, 詹曉北, 朱莉, 吳劍榮*
(江南大學 生物工程學院 糖化學與生物技術教育部重點實驗室,江蘇 無錫214122)
摘要:聚唾液酸(PSA)經環氧氯丙烷活化后,與透明質酸(HA)在堿性條件下反應合成了系列PSA-HA接枝聚合物(P1~P5, PSA與HA質量比分別為1 ∶1~5 ∶1),合成率40%~89%,其結構經FT-IR,元素分析和SEM表征。以胰島素為模型藥物,將P2與胰島素按2 ∶1(m/m)混合時,包封率和載藥率分別為85%和38%,平均粒徑為3.2 μm。體外釋藥試驗結果表明: P2對胰島素有一定的體外緩釋能力,在6 h內釋藥89%;在pH 1.2條件下的釋藥速度大于pH 7.4條件下的釋藥速度。
關鍵詞:聚唾液酸; 透明質酸; 接枝聚合物; 合成; 胰島素; 藥物緩釋
聚唾液酸(PSA)是由N-乙酰神經氨酸(唾液酸的一種)以α-2,8或α-2,9糖苷鍵連接的同型聚合物,具有非免疫原性、優良的生物相容性和生物可降解性,是一種優良的生物材料[1-2]。目前,PSA經修飾后廣泛應用于蛋白藥物的緩釋包埋材料和神經修復手術中的支架材料[3-4]。此外,PSA還具有誘導和支持神經原細胞再生的功能,可以加速神經創傷的愈合,也用作神經細胞組織工程材料[5-6]。
透明質酸(HA)是一種存在于高等動物機體內多種組織器官中的天然大分子多聚糖,主要成分是葡糖醛酸和N-乙酰氨基葡糖,具有良好的生物相容性和高粘彈性[7],以其獨特的分子結構和理化性質在機體內顯示出多種重要的生理功能[8]。但HA屬于糖胺多糖(GAGs),在體內易被酶降解,而HA可修飾位點較多,因此通過合成改性后的HA聚合物穩定性將得到提高[9]。目前,與HA接枝合成的聚合物包括羧甲基纖維素鈉、葡聚糖、聚乙二醇、海藻酸鈉、殼聚糖及明膠等[10-15]。此外,HA還具有與細胞表面特異受體專一性結合的能力,以達到藥物增稠、藥物緩釋、促進藥物透皮吸收及靶向性的目的,使得HA及其衍生物常作為藥物緩釋基材[16]。例如,Jederstrom等[17]利用HA作為多肽類藥物胰島素的載體進行動物實驗,研究發現血液中葡萄糖濃度明顯降低,證實HA對胰島素進入機體起到很好的保護作用。
胰島素是臨床上治療Ι型糖尿病的一線藥物[18],但是胰島素自身穩定性差,口服易被胃腸道酶水解,且對腸道粘膜通透性低,口服生物利用度一直較低[19]。
鑒于此,本研究結合PSA和HA的優點,以PSA和HA為基質材料,將PSA經環氧氯丙烷活化后,與HA在堿性條件下合成了系列PSA-HA接枝聚合物(P1~P5, PSA與HA質量比分別為1 ∶1~5 ∶1, Scheme 1),合成率40%~89%,其結構經FT-IR、元素分析和SEM表征。
以胰島素為酸性多肽模型藥物,用接枝聚合物包埋胰島素,使其兼具PSA的抗免疫識別和HA的與細胞表面特異受體專一性結合的能力,促進藥物吸收,提高藥物穩定性和半衰期。并通過體外釋放試驗測定接枝聚合物對胰島素的體外緩釋能力。
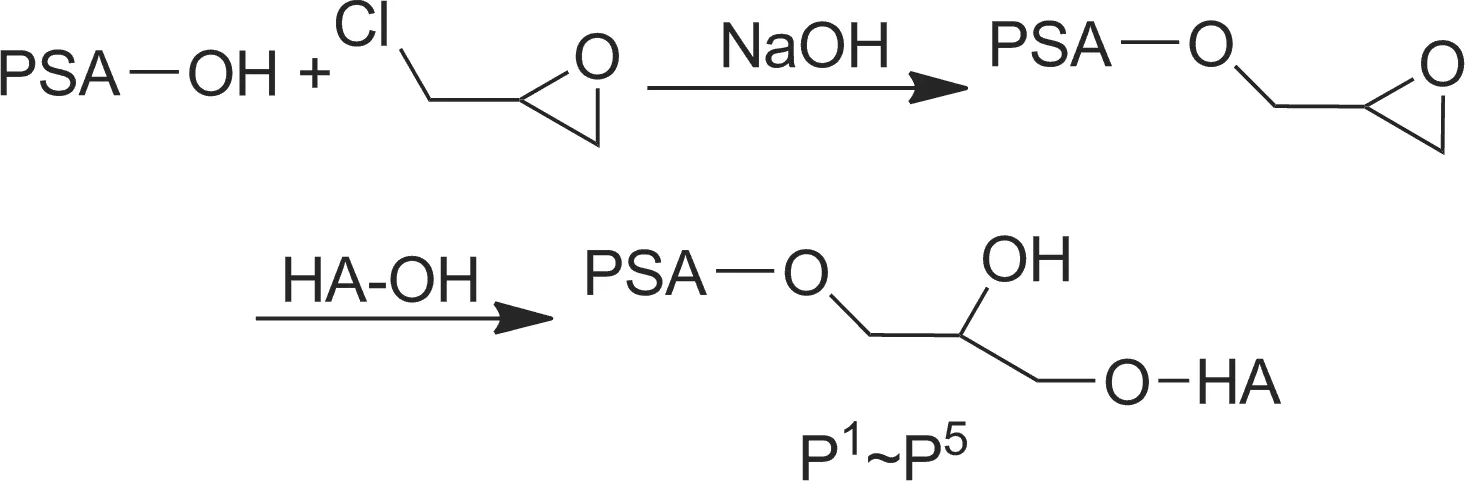
Scheme 1
1實驗部分
1.1儀器與試劑
Thermo Nicolet NEXUS型紅外光譜儀(KBr壓片);Vario EL Ⅲ型元素分析儀;Agilent 1100型高效液相色譜儀[色譜柱:InertSustain C18(4.6 mm×250 mm i.d, 5 μm),柱溫:40 ℃,流動相:0.2 mol·L-1硫酸鹽緩沖液,流速:1 mL·min-1,進樣體積:20 μL;檢測波長:214 nm]; FEI Quanta 200型掃描電鏡。
PSA(α-2,8糖苷鍵連接,相對分子質量為10萬Da),自制;HA,山東福瑞達生物醫藥有限公司;胰島素(28.2 U·mg-1),徐州萬邦金橋制藥有限公司;其余所用試劑均為分析純。
1.2P1~P5的制備
將PSA 1.5 g溶于10 mL水中,加入環氧氯丙烷0.4 mL和NaOH 0.05 g,攪拌下于30 ℃反應3 h。旋蒸除去環氧氯丙烷,以水/乙醇(V/V=1/4)為溶劑采用離心-溶劑沉淀法制得活化的PSA(采用硫代硫酸鈉滴定法[20]測定PSA的環氧基修飾密度)。
取活化的PSA 1.5 g加至1.5%(w/V)的HA溶液(100 mL)中,攪拌下于30 ℃反應56 h。減壓濃縮后用分子截留量為50萬Da的透析袋透析,利用間苯二酚法[21]檢測透析液中的PSA,直至溶液中未檢測出PSA,將透析袋內溶液經冷凍干燥得P1(PSA與HA質量比為1 ∶1)。
改變PSA與HA質量比,用類似方法制得P2, P3, P4和P5(PSA與HA質量比分別為2 ∶1, 3 ∶1, 4 ∶1和5 ∶1)。
1.3藥物包埋
將P 0.5 g凍干粉末溶于1 mol·L-1Na2SO4溶液中(P終濃度為8.5 mg·mL-1),靜置過夜,用1 mol·L-1鹽酸調至pH 2.0。另取胰島素60 mg溶于0.01 mol·L-1鹽酸(3 mL)中,依據P與胰島素的質量比分別為6 ∶1, 6 ∶2, 6 ∶3, 6 ∶4, 6 ∶5和6 ∶6,將兩溶液混合反應1 h。置于Tris緩沖液(0.5 mmol·L-1, pH 6.5)中透析48 h,其間更換透析液一次,袋內懸濁液于20 000 r·min-1離心30 min,沉淀冷凍干燥后得P/胰島素粉末。
1.4包封率與載藥率測定
采用HPLC檢測上述透析液及離心所得上清液中的胰島素含量。按下式計算胰島素包封率和載胰島素率:


1.5P/胰島素體外釋放試驗
將P/胰島素分別置于pH 1.2鹽酸溶液10 mL和pH 7.4 PBS緩沖溶液10 mL中,于37 ℃恒溫水浴中振蕩(100 r·min-1),每隔30 min移取1 mL釋放介質,用HPLC檢測樣品中胰島素含量,同時補充同溫同體積的釋放介質。
2結果與討論
2.1反應條件優化
(1) PSA的活化
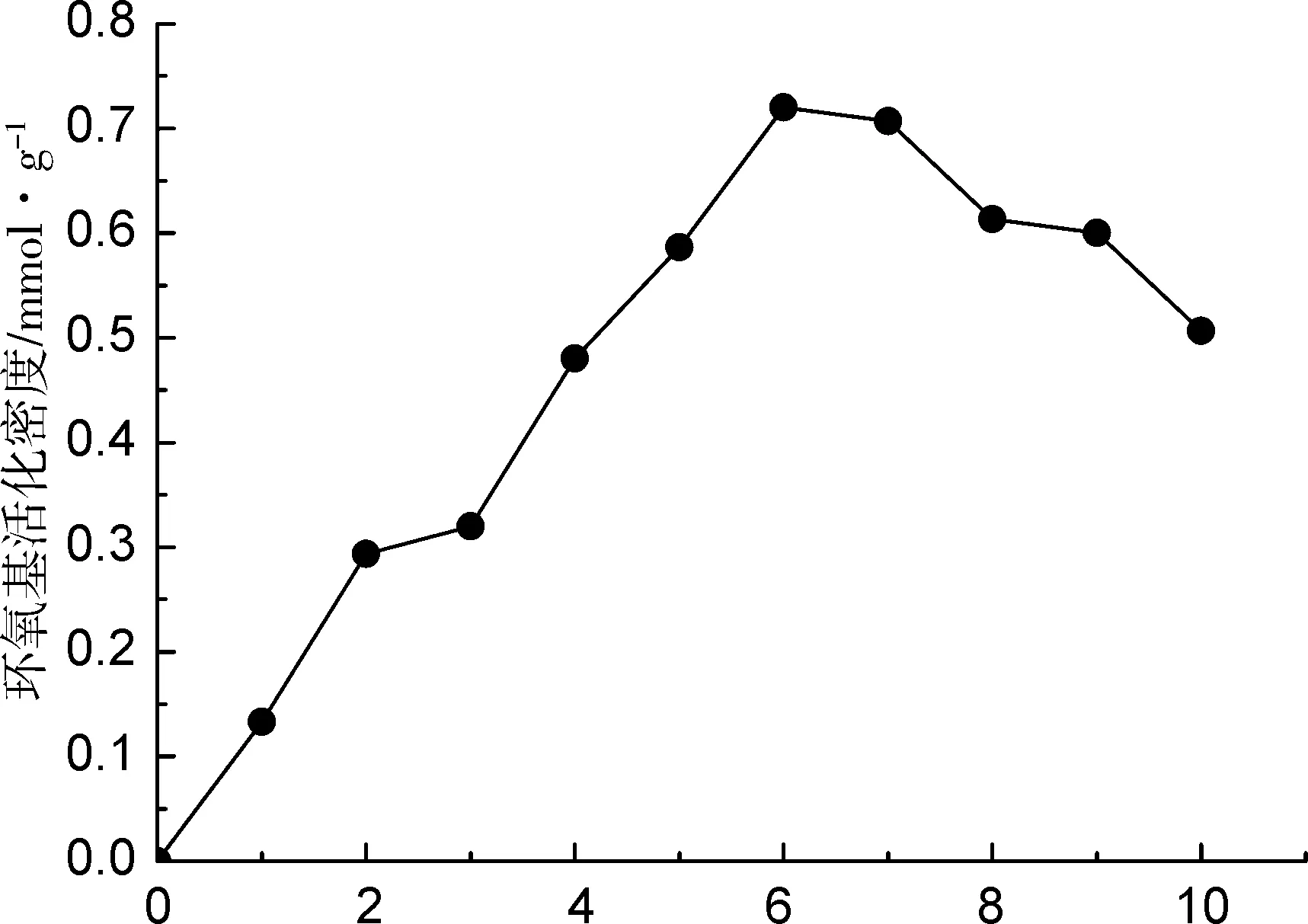
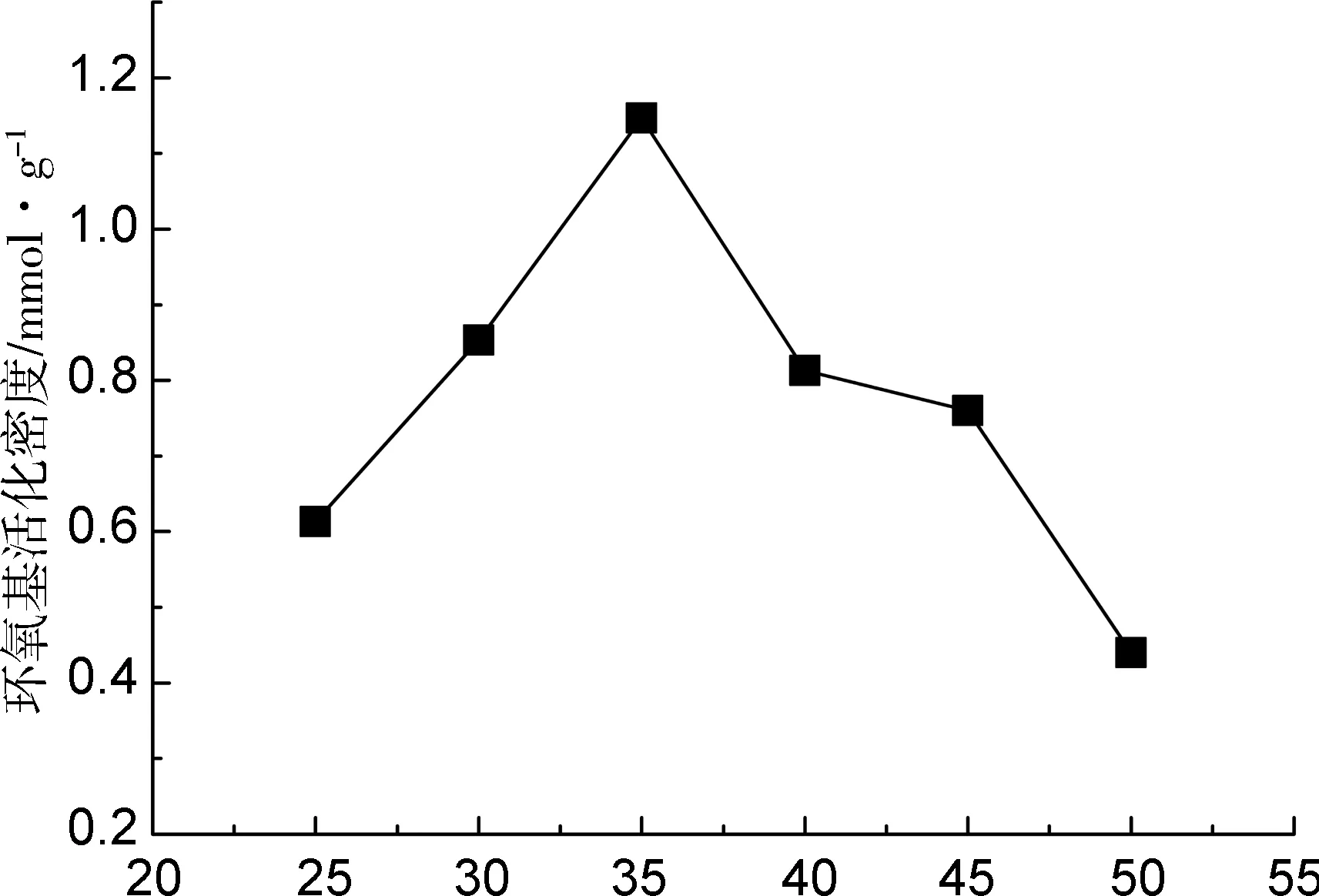
環氧氯丙烷分子中含有高活性易于進行取代反應的氯離子以及易于開環聚合的環氧結構,在聚合物合成、介質交聯中具有方便、快速、活化率高、毒性低等特點而得到廣泛應用。本研究采用環氧氯丙烷活化PSA,進行單因素試驗,分別考察了環氧氯丙烷濃度、氫氧化鈉濃度、活化時間和活化溫度對PSA上環氧基活化密度的影響,結果見圖1。由圖1可以看出,基于獲得高環氧基活化密度為目標,綜合考慮各因素的影響,得出最佳反應條件為:環氧氯丙烷濃度6%(V/V),氫氧化鈉濃度0.7%(w/V),活化時間4 h,活化溫度35 ℃,其環氧基活化密度可以達到1.5 mmol·g-1。
該方法制得的活化PSA沒有發現不溶物,但由于PSA是大分子,本身活化過程不易進行,且活化反應的產物因帶有環氧基可以繼續與PSA上的羥基反應生成交聯反應的產物,生成的交聯產物又可與活化產物或環氧氯丙烷發生反應生成更進一步的交聯產物,因此活化的時間不宜過長,已活化的PSA需盡快進行下一步反應。
(2) P的合成
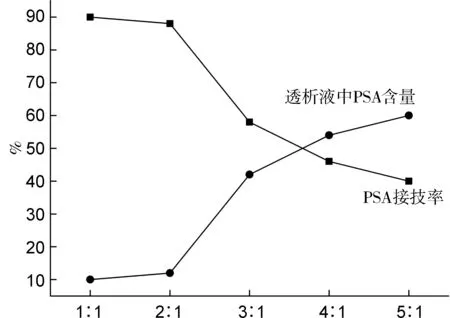
將已活化PSA與HA反應合成PSA-HA聚合物P, PSA與HA的質量比[x=m(PSA) ∶m(HA)]對透析液中PSA含量和P接枝率的影響見圖2。由圖2可見,P的接枝率為40%~89%;當x=1 ∶1~2 ∶1時,PSA得到高效利用,接枝率高達87%~89%;而當x>2 ∶1后,PSA的利用率逐漸下降。這是由于HA的量固定,提高PSA的量,并不能增加HA上連接的PSA量。但由于HA分子量較大,在體內降解速率較快,如聚合物中HA所占比例越大,其降解速度越快。因此選擇x=2 ∶1制備PSA-HA聚合物(P2)進行下一步反應,以期提高PSA的量,降低聚合物的降解速率和提高藥物的附載量。
環氧氯丙烷濃度/(V/V)

NaOH/(w/V)
活化溫度/℃
m(PSA) ∶m(HA)
2.2表征
(1) SEM
PSA, HA和P2的掃描電鏡分析結果見圖3。從圖3可以看出,PSA為片狀;HA為枝狀,形狀規則,結構疏松,易和PSA發生接枝合成反應;P2中可以看到交錯枝狀分子上包裹有片狀物質,推測其為PSA,交錯枝狀分子為HA,可初步判斷PSA與HA發生了接枝合成反應。

PSAHA

P2
(2) FT-IR
圖4為PSA, HA和P2的IR譜圖。由圖4可見,HA和PSA在3 450 cm-1處出現O—H與N—H的伸縮振動吸收峰重疊而成的寬峰,說明羥基和氨基之間存在著強弱不同的分子內或分子間氫鍵,峰寬的差異反映了氫鍵的強弱。P2在3 385 cm-1處強而寬的吸收峰,可能是由于PSA與HA結合后增強了羥基和氨基之間的氫鍵,使吸收加強;2 892 cm-1處吸收峰為HA和PSA上的甲基和次甲基的C—H伸縮振動吸收峰;1 738 cm-1和1 616處的吸收峰分別為HA上的(COO-)和酰胺帶Ⅲ的特征吸收峰,表明P2上有HA的特征吸收峰;PSA上的1 433 cm-1處吸收峰消失,1 102 cm-1處吸收峰發生遷移,HA上1 151 cm-1處吸收峰發生遷移。上述分析表明PSA和HA發生了有效的接枝合成反應。
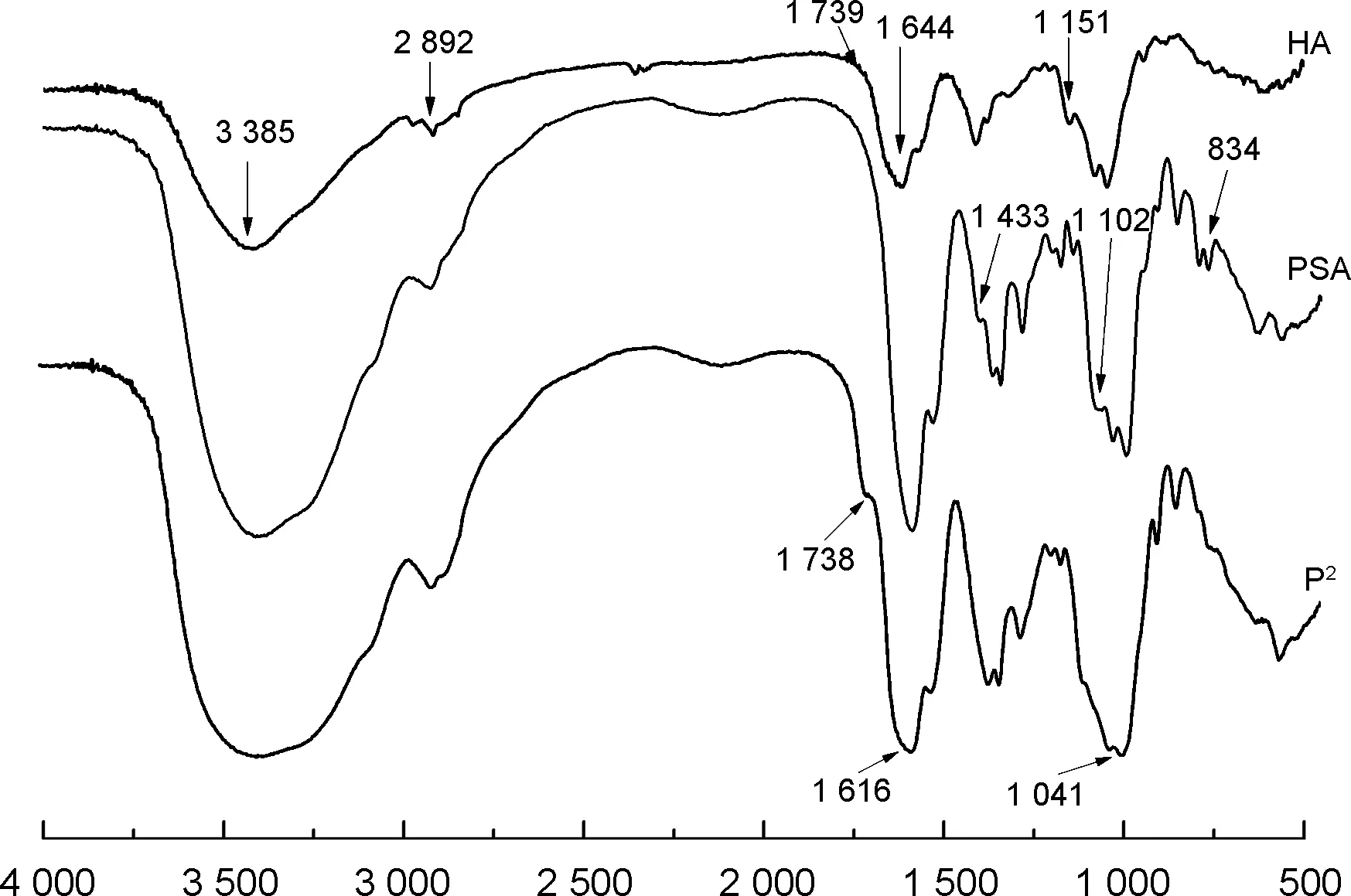
ν/cm-1
(3) 元素分析
PSA, HA和P2的元素分析結果見表1。由表1可以看出,PSA的N和C含量相對較少,而純HA的N和C含量分別為3.87%與39.79%, P2的N和C含量介于兩者之間,進一步證明PSA與HA接枝合成成功。通過C和N含量利用元素分析法[22]計算得P2的接枝率為88%。
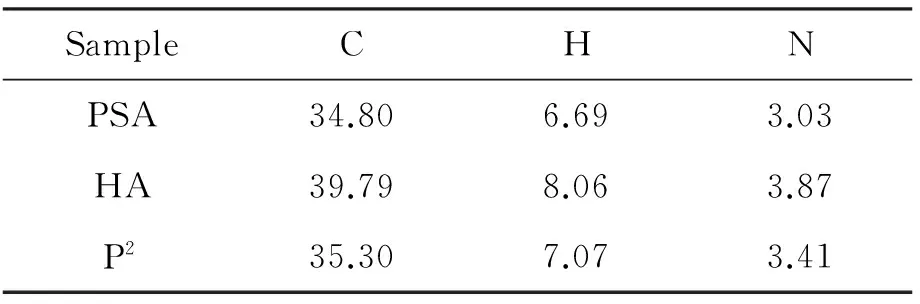
表1 PSA, HA和P2的CHN元素分析結果
(4) Zeta電位
PSA, HA和P2的電位分布測試結果見圖5。由圖5可以看出,當pH<3時,P2帶正電荷;當pH>3時,P2帶負電,隨著pH增大,出現了電荷由正到負的轉變。對比HA和PSA發現,P2的電荷介于兩者之間,這是由于在低pH環境下,HA上的基團質子化程度較大,使得P2的凈電荷為正,Zeta電位值為正。隨著pH值升高,HA上的羧酸根電離程度增大,使得Zeta電位值遞減較PSA的快,進而P2的Zeta電位值也逐漸遞減,從帶正電荷轉變為帶負電荷,而由于HA與PSA存在相互作用,受PSA的影響,P2的電位值小于HA的電位。因而,當pH>3時,P2由于所帶負電荷逐漸增加,利用靜電作用,P2可作為帶相反電荷多肽類藥物的載體。
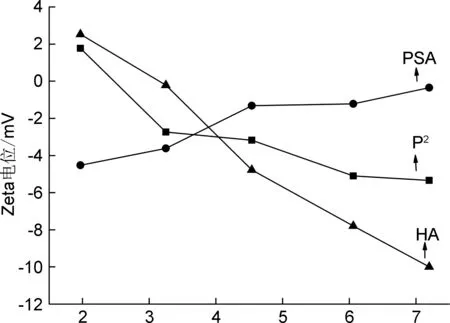
pH
2.3P2包埋胰島素及表征
為了考察P2對多肽類藥物的緩釋能力,以胰島素為模型蛋白進行包埋實驗。胰島素的羧基隨pH升高而逐漸電離,只要pH低于其等電點(等電點為5.4),胰島素分子始終帶正電。因此,選擇pH在3.0~5.4之間,通過改變P2與胰島素的質量比,考察P2的包封率和載藥率的變化,結果見圖6。由圖6可以看出,P2的包封率和載藥率與胰島素的添加量有關,當二者質量比小于6 ∶3時,包封率增加,載藥率上升,說明P2與胰島素具有良好的親和力;隨著胰島素添加量的增加,質量比高于6 ∶3時,載藥率上升緩慢,包封率下降。這是因為聚合物對于胰島素的負載能力是有一定限度的,即呈現飽和性。綜合考慮包封率與載藥率,當P2與胰島素質量比為6 ∶3時,包封率較高(≥85%),同時載藥率也較高(≥38%),效果最佳。因此,選擇P2與胰島素質量比為6 ∶3進行后續試驗。

m(P2) ∶m(胰島素)
對P2載胰島素進行電鏡掃描,結果見圖7。由圖7可以看出,P2粒子大小為1~10 μm。通過Zeta電位儀檢測粒度平均大小為3.2 μm,屬于小腸有效吸收的范圍。2004年,Jederstrom等[16]曾用HA和重組生長激素(rhGH)在低pH(<3)下混合制備成了小于1 nm的粒子;用HA復合胰島素后得到了2~10 nm大小的復合物,溶液澄清透明。而本實驗中P2/胰島素復合物簇擁成團,這可能是在透析過程中,由于透析袋內溶液(初始pH為2.0)與Tris緩沖液(初始pH為6.5)中和,使得透析袋內溶液pH值不斷升高,胰島素的羧基逐漸電離,只要pH值低于其等電點5.4,胰島素分子始終帶正電;P2在pH 3.0以上時,帶負電。從而在pH 3.0~5.4間,P2與胰島素之間的電荷吸引力成為主導,而HA分子量大導致形成了聚離子復合物。


圖7 P2載胰島素掃描電鏡圖
2.4P2包埋胰島素體外釋放試驗
以pH 1.2鹽酸溶液、pH 7.4 PBS緩沖液分別模擬胃液和腸液pH環境,考察P2載胰島素在不同pH介質中釋放胰島素的情況,結果見圖8。由圖8可以看出,在pH 1.2鹽酸溶液中,胰島素的釋藥速度大于在pH 7.4的PBS緩沖液中的釋藥速度,在6 h內逐漸釋放率為89%。聚離子復合物主要靠聚離子與兩性大分子上電荷基團相互靜電引力形成,當外界環境pH偏離等電點時,電荷性質發生變化,導致復合物解離,胰島素釋放出來。在pH 1.2條件下的釋藥速度較快,一方面可能是由于PSA在酸性條件下較活潑,容易從聚合物上解離下來,導致聚合物的性質發生變化,另一方面與介質的pH值遠遠偏離等電點有關,當介質在pH 2.0以下時,P2帶正電荷(如圖5所示),而胰島素在介質pH低于5.4時也帶正電荷。所以在pH 1.2 的介質中,P2很快解離,胰島素釋放較快。

時間/h
利用聚唾液酸(PSA)和透明質酸(HA)為基質材料,通過環氧氯丙烷合成了系列PSA-HA聚合物(P1~P5, PSA與HA質量比分別為1 ∶1~5 ∶1),合成率40%~89%。最佳合成條件為:環氧氯丙烷濃度6%(V/V),氫氧化鈉濃度0.7%(w/V),活化時間4 h,活化溫度35 ℃, PSA與HA質量比為2 ∶1時合成達到飽和。
以胰島素為模型藥物,將PSA-HA聚合物與胰島素混合,當PSA-HA ∶胰島素質量比為2 ∶1時,既能達到較高的包封率(≥85%)又可達到較高的載藥率(≥38%),平均粒徑為3.2 μm。體外釋放試驗表明:包封胰島素在6 h內釋藥89%;由于在pH 1.2的介質中,復合物很快解離,胰島素釋放較快,使得在pH 1.2條件下的釋藥速度大于pH 7.4條件下的釋藥速度。因此,PSA-HA作為新的聚合物有望成為多肽類藥物的緩釋載體。
參考文獻
[1]Zhang N, Bader R A. Synthesis and characterization of polysialic acid-N-trimethyl chitosan nanoparticles for drug delivery[J].Nano LIFE,2012,2(3):1-11.
[2]Krieg A, Weber C, Hoogenboom R,etal. Block copolymers of poly(2-oxazoline)s and poly(meth) acrylates:A crossover between cationic ring-opening polymerization (CROP) and reversible addition-fragmentation chain transfer(RAFT)[J].ACS Macro Letters,2012,1(6):776-779.
[3]Gregoriadis G, Jain S, Papaioannou I,etal. Improving the therapeutic efficacy of peptides and proteins:A role for polysialic acids[J].International Journal of Pharmaceutics,2005,300(1-2):125-130.
[4]Steinhaus S, Stark Y, Bruns S,etal. Polysialic acid immobilized on silanized glass surfaces:A test ase for its use as a biomaterial for nerve regeneration [J]. Journal of Materials Science:Materials in Medicine,2010,21(4):1371-1378.
[5]El Maarouf A, Petridis A K, Rutishauser U. Use of polysialic acid in repair of the central nervous system[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(45):16989-16994.
[6]Gascon E, Vutskits L, Kiss J Z. Polysialic acid-neural cell adhesion molecule in brain plasticity:From synapses to integration of new neurons[J].Brain Research Reviews,2007,56(1):101-118.
[7]俞晨潔,張莉,李紅玫,等. 透明質酸及其衍生物用作藥物載體的研究進展[J].藥學進展,2011,(12):543-549.[8]Kufelt O, EI-Tamer A, Sehring C,etal. Hyaluronic acid based materials for scaffolding via two-photon polymerization[J].Biomacromolecules,2014,15(2):650-659.
[9]張偉,閆崔娥. 透明質酸及其衍生物用作藥物載體[J].化學進展,2006,18(12):1684-1690.
[10]Liu L, Liu D R, Wang M,etal. Preparation and characterization of sponge-like composites by cross-linking hyaluronic acid and carboxymethylcellulose sodium with adipicdihydrazide[J].European Polymer Journal,2007,43(6):2672-2681.
[11]陳鵬. 葡聚糖接枝透明質酸共聚物作為皮膚敷料的研究[D].廣州:暨南大學,2013.
[12]Byron H J, Choy S H, Choy J S,etal. Four-arm PEG cross-linked hyaluronic acid hydrogels containing PEG ylatedapoptotic TRAIL protein for treating pancreatic cancer[J].Acta Biomaterialia,2014,10(1):142-150.
[13]De Santis S, Diociaiuti M, Cametti C,etal. Hyaluronic acid and alginate covalent nanogels by template cross-linking in polyion complex micelle nanoreactors[J].Carbohydrate Polymers,2014,101:96-103.
[14]Li L, Wang N, Jin X,etal. Biodegradable and injectable in situ cross-linking chitosan-hyaluronic acid based hydrogels for postoperative adhesion prevention[J].Biomaterials,2014,35(12):3903-3917.
[15]Zhou Z H, Chen J H, Peng C,etal. Fabrication and physical properties of gelatin/sodium alginate/hyaluronic acid composite wound dressing hydrogen[J].Journal of Macromolecular Science,Part A:Pure and Applied Chemistry,2014,51:318-325.
[16]李琦,王鳳山,凌沛學,等. 玻璃酸作為藥物媒介在醫藥研發中的應用[J].中國藥學雜志,2005,40(7):485-488.
[17]Jederstrom G, Andersson A, Grasjo J,etal. Formulating insulin for oral administration:Preparation of hyaluronan insulin complex[J].Pharmaceutical Research,2004,21(8):2040-2047.
[18]Sonia T A, Sharma C P. An over view of natural polymers for oral insulin delivery[J].Drug Discovery Today,2012,17(13-14):784-792.
[19]Chaturvedi K, Ganguly K, Nadagouda M N,etal. Polymeric hydrogels for oral insulin delivery[J].Journal of Controlled Release,2013,165(2):129-138.
[20]史清洪,彭冠英,孫舒,等. 環氧氯丙烷活化瓊脂糖凝膠過程強化及性能評價 [J].過程工程學報,2007,7(4):743-746.
[21]劉金龍,吳劍榮,申鳳丹, 等. 基于發酵液特性的聚唾液酸提純工藝的研究 [J].食品與生物技術學報,2010,29(6):931-936.
[22]孫玉晴,王明珍,王德林. 元素分析法在聚合物研究中的應用[J].陜西師大學報,1993,21(2):93-94.
收稿日期:2015-08-25;
修訂日期:2016-02-25
基金項目:江蘇省自然科學基金資助項目(BK2011158)
作者簡介:付浩(1990-),男,漢族,貴州遵義人,碩士研究生,主要從事糖生物工程的研究。 E-mail: fhao005@163.com 通信聯系人: 吳劍榮,碩士生導師, E-mail: kinowu@jiangnan.edu.cn
中圖分類號:O63; R318.08
文獻標志碼:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.07.15299
Preparation and Application of Polysialic Acid-Hyaluronan Grafted Polymer as Drug Delivery Carrier
FU Hao,FENG Chang-yu,ZHAN Xiao-bei,ZHU Li,WU Jian-rong*
(The Key Laboratory of Carbohydrate Chemistry and Biotechnology,Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
Abstract:The grafted polymers(P1~P5) with different mass ratio(1 ∶1~1 ∶5) of hyaluronic acid with polysialic acid were prepared by reaction of hyaluronic acid(HA) with activated polysialic acid(PSA) by epichlorohydrin under alkaline conditions. The synthetic ratio was about 40%~89%. The structures were characterized by FT-IR, elemental analysis and SEM. Taking insulin as a model drug, when the P2and insulin were mixed by the ratio of 2 ∶1(m/m), the encapsulation efficiency and drug loading was 85% and 38%, respectively. The average particle size was 3.2 μm. In vitro release test showed a slow-release capability of the embedding insulin by P2. The drug release rate reached 89% within 6 h. The drug release rate was faster in pH 1.2 than that in pH 7.4.
Keywords:polysialic acid; hyaluronan; grafted polymer; preparation; insulin; drug delivery

