肝細胞癌ARF-BP1基因治療影響HepG2細胞凋亡的相關性分析
張法標 方哲平★
肝細胞癌ARF-BP1基因治療影響HepG2細胞凋亡的相關性分析
張法標 方哲平★
目的 探討肝細胞癌ARF-BP1基因對HepG2細胞凋亡的影響。方法 隨機將對數生長期的HepG2細胞分為細胞轉染組、脂質體對照組、陰性對照組和空白對照組,將100nmol/L ARF-BP1 siRNA采用脂質體包裹計數,轉染至HepG2細胞;脂質體對照組不加siRNA片段,只加脂質體;轉染陰性siRNA片段為陰性對照組;空白對照組加入等量培養基,不加siRNA片段和脂質體。各組ARF-BP1干擾后不同時間HepG2細胞的增殖情況采用四甲基偶氮哇藍光吸收法測定,各組轉染72h后HepG2細胞周期及細胞凋亡采用流式細胞術檢測,RF-BP1 siRNA轉染組和空白對照組不同時間點ARF-BP1 mRNA、p53 mRNA、mcl-1 mRNA表達水平采用RT-PCR法檢測。結果 在24h、48h和72h,ARF-BP1對轉染組的HepG2細胞抑制效率逐漸增強(P<0.05);各時間點細胞增殖情況轉染組<脂質體對照組<陰性對照組<空白對照組(P<0.05)。轉染72h后,HepG2細胞凋亡率為轉染組>脂質體對照組>陰性對照組>空白對照組;G1期細胞轉染組<脂質體對照組<陰性對照組<空白對照組,G2期細胞轉染組>脂質體對照組>陰性對照組>空白對照組(P<0.05)。在ARF-BP1 siRNA轉染72h后,p53mRNA和mcl-1 mRNA的相對表達低于空白對照組(P<0.05)。結論 ARF-BP1基因在HepG2中被降低表達可促進HepG2凋亡。
肝細胞癌 ARF-BP1基因 HepG2細胞
近年來研究證實,細胞周期調控、細胞增殖或凋亡的調節異常參與惡性腫瘤的發生發展過程,多數學者認為部分細胞因子的異常表達導致的細胞凋亡及細胞增殖信號通路的激活,顯著參與肝癌的發展演變過程中[1]。而ARF-BP1基因作為HECT結構域家族的泛素連接酶,顯著參與DNA損傷修復、細胞周期調控及促進相關受損細胞凋亡等過程[2]。2013年8月至2015年1月作者通過實驗分析ARF-BP1 siRNA轉染肝細胞癌HepG2細胞株后相應的細胞增殖、凋亡以及相關基因轉錄水平的表達,揭示ARF-BP1基因在肝細胞癌發生發展中的作用。報道如下。
1 材料和方法
1.1 主要試劑和儀器 肝細胞癌HepG2細胞株購自中國科學院上海細胞生物學研究所;脂質體LipofectamineTM2000、Control siRNA和帶熒光標記的特異性siRNA 片段購自美國Invitrogen公司;凱基AnneXinV-FITC細胞凋亡檢測試劑盒、碘化丙啶(PI) 試劑盒、胰蛋白酶(TryPsin)購自上海吉瑪制藥技術有限公司。 流式細胞儀(美國BD公司),全自動酶標儀(美國BioTek公司),倒置相差顯微鏡(日本Olympus公司),臺式低溫離心機(德國 Eppendorf公司),電子恒溫CO2培養箱(美國 SHELLAB 公司),小型高速離心機(美國Thermo公司)。
1.2 細胞檢測方法 細胞增殖檢測 肝細胞癌HepG2細胞生長至融合度為90%時,用胰蛋白酶EDTA消化液消化細胞,加入適當培養基,吹勻后細胞計數,使細胞最終密度為1×105/ml,96孔板每孔加入100μl吹勻后的細胞,置于37℃、5%CO2飽和濕度的培養箱中培養,并設置6復孔,在37℃、5%CO2飽和濕度的培養箱中共培養,24h后每孔加入10 μl新型細胞增殖及毒性檢測溶液CCK-8(南京凱基生物科技有限公司),置于37℃培養箱中孵育2h,酶標儀在450 nm波長處檢測每孔的吸光度OD值。(1)細胞周期以及凋亡檢測:肝細胞癌HepG2細胞培養至融合度為50%時,用胰蛋白酶消化液(不含EDTA)消化細胞,離心收集細胞后用PBS洗滌細胞1次(2000r/min,離心5min),300μl的1×Binding Buffer懸浮細胞,之后加入5μl Annexin V-FITC混勻后,避光,室溫孵育15min,上機前5min再加入5μl的PI染色,避光放置10min,流式細胞儀檢測各組凋亡率。細胞周期檢測:收集細胞,用PBS洗滌細胞1次(2000r/min,離心5min),收集1×106細胞,加入70%的冷乙醇500μl固定,4℃過夜,染色前用PBS洗去固定液,加入100μl RNase A 37℃水浴30min,再加入400μl PI染色混勻,4℃避光30min,上機檢測,記錄繼發波長488nm處紅色熒光。分別統計各組細胞的死亡率(PI+,%)和細胞周期(G0/G1期,S期和G2/M期)。(2)熒光定量PCR檢測:采用南京凱基生物科技有限公司生產的RNA提取試劑盒提取,takara試劑盒逆轉錄為cDNA(引物體系2μl),takaraSYBN熒光定量PCR試劑盒擴增mRNA。PCR反應條件:預變性95℃30s;PCR反應95℃5s,60℃30s,循環40次,溶解曲線:95℃5s,60℃1min,95℃0s,降溫:40℃30s。
1.3 統計學方法 采用SPSS 23.0軟件。計量資料以(±s)表示,用t檢驗;P<0.05為差異有統計學意義。
2 結果
2.1 ARF-BP1干擾后不同時間HepG2細胞的增殖情況 在24h、48h和72h,ARF-BP1對轉染組的HepG2細胞抑制效率逐漸增強(P<0.05);各時間點細胞增殖情況轉染組<脂質體對照組<陰性對照組<空白對照組(P<0.05)。見表1。
表1 ARF-BP1干擾后不同時間HepG2細胞的增殖情況(±s)

表1 ARF-BP1干擾后不同時間HepG2細胞的增殖情況(±s)
注:與脂質體對照組比較,aP<0.05;與陰性對照組比較,bP<0.05;與空白對照組比較,cP<0.05;與組內前一時間點比較,dP<0.05
組別 24h 48h 72h A值 抑制率(%) A值 抑制率(%) A值 抑制率(%)轉染組 0.14±0.03abc 36.36d 0.16±0.05 abcd 55.56d 0.20±0.05 abcd 60.78d脂質體對照組 0.17±0.05bc 13.64 0.31±0.08bcd 13.89 0.41±0.07bcd 19.61陰性對照組 0.20±0.03c 9.09 0.33±0.05cd 8.33 0.43±0.08cd 15.69空白對照組 0.22±0.04 0.00 0.36±0.07d 0.00 0.51±0.04d 0.00
2.2 轉染72h后HepG2細胞周期及細胞凋亡比較 轉染72h后,HepG2細胞凋亡率為轉染組>脂質體對照組>陰性對照組>空白對照組;G1期細胞轉染組<脂質體對照組<陰性對照組<空白對照組,G2期細胞轉染組>脂質體對照組>陰性對照組>空白對照組,(P<0.05)。見表2。
表2 轉染72h后HepG2細胞周期及細胞凋亡比較(±s)

表2 轉染72h后HepG2細胞周期及細胞凋亡比較(±s)
注:與脂質體對照組比較,aP<0.05;與陰性對照組比較,bP<0.05;與空白對照組比較,cP<0.05
組別 G1期 S期 G2期 凋亡率(%)轉染組 26.90±2.28 abc 38.76±0.92 32.36±2.38 abc 26.21±1.32 abc脂質體對照組 38.46±3.71 bc 38.20±1.14 20.24±1.74 bc 4.38±0.53bc陰性對照組 40.59±2.93 c 37.91±0.99 18.25±0.43 c 3.17±0.35c空白對照組 44.75±1.07 38.42±1.68 17.10±0.85 1.54±0.16
2.3 ARF-BP1 siRNA轉染后不同時間點ARF-BP1 mRNA、p53 mRNA、mcl-1 mRNA表達水平比較 在ARF-BP1 siRNA轉染 72h后,p53mRNA和 mcl-1 mRNA的相對表達低于空白對照組(P<0.05)。見表3。
表3 ARF-BP1 siRNA轉染后不同時間點ARF-BP1 mRNA、p53mRNA、mcl-1 mRNA表達水平比較(±s)
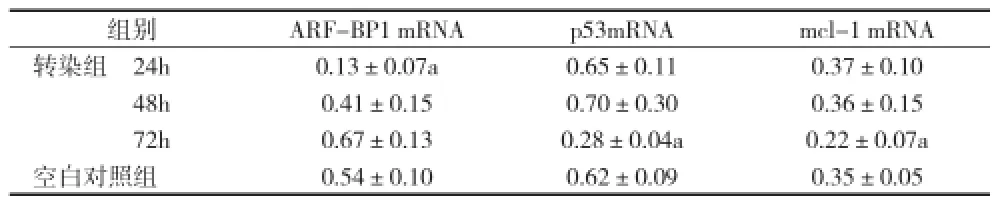
表3 ARF-BP1 siRNA轉染后不同時間點ARF-BP1 mRNA、p53mRNA、mcl-1 mRNA表達水平比較(±s)
注:與空白對照組比較,aP<0.05
組別 ARF-BP1 mRNA p53mRNA mcl-1 mRNA轉染組 24h 0.13±0.07a 0.65±0.11 0.37±0.10 48h 0.41±0.15 0.70±0.30 0.36±0.15 72h 0.67±0.13 0.28±0.04a 0.22±0.07a空白對照組 0.54±0.10 0.62±0.09 0.35±0.05
3 討論
近年來,惡性腫瘤基礎性理論研究認為信號通路異常以及相關細胞早期調控異常顯著參與惡性腫瘤的發生發展過程,當細胞水平發生增殖或者凋亡異常時,相關細胞的癌變以及自身免疫性疾病的發生顯著升高[3]。 而泛素連接酶被多數學者認為參與惡性腫瘤如肝細胞肝癌的發生發展過程。Zhu X等[4]學者認為,MDM2泛素通過抑制P53mRNA水平的表達減少P53蛋白的翻譯,進而促進細胞增殖、抑制細胞凋亡,而Kang F等[5]學者通過siRNA技術干擾肝細胞癌HepG2細胞株后發現,PI3K/AKT/CMYC信號通路異常活化,同時還發現,轉染MDM2泛素基因后,肝癌HepG2細胞株內Notch信號通路內活性區域(NICD)蛋白水平表達顯著升高,而下游相關轉錄調節因子HES-1異常活化,從而導致細胞增殖、凋亡抑制等效應。但迄今為止,對于ARF-BP1 泛素基因的研究較少,賈中芝等[6]發現,在部分肝細胞肝癌特別是小肝癌以及結節型肝癌病例中,ARF-BP1 泛素基因的表達相比于正常肝細胞平均升高(3.76±0.45)倍,李玉梅等[7]認為ARF-BP1 泛素基因翻譯后蛋白水平的表達能顯著升高,并認為ARF-BP1 泛素蛋白水平的表達能作為預測肝細胞癌術后<5年復發率及無瘤生存率的獨立風險因素。
本資料顯示,24h、48h和72h,ARF-BP1對轉染組的HepG2細胞抑制效率逐漸增強,各時間點細胞增殖情況轉染組<脂質體對照組<陰性對照組<空白對照組,提示本試驗成功轉染ARF-BP1-siRNA,相關細胞活力檢測結果提示轉染ARF-BP1-siRNA后,細胞增殖明顯被抑制,這與Izzo F等[8]認識一致,Izzo F等在肝膽管細胞癌中干擾ARF-BP1基因后,采用MTT法測定細胞增殖活力,結果提示隨著干擾劑量的增加,相關細胞凋亡水平顯著升高,并體現出了一定的劑量依賴性;而本資料對于轉染ARF-BP1-siRNA后,HepG2細胞凋亡率檢測提示轉染組>脂質體對照組>陰性對照組>空白對照組,進一步證實該結論。Izzo F等進一步研究后發現,ARF-BP1抑制細胞凋亡的途徑可能與交錯連接至P53抑癌基因mRNA轉錄水平的啟動子區域有關,ARF-BP1通過干擾P53基因上游啟動子區域與其他調節性細胞因子的的結合來抑制P53基因以及相關蛋白翻譯水平的表達,而劉瑞磊等[9]學者發現,轉染ARF-BP1-siRNA后,肝細胞癌細胞株HepG2細胞周期G2期比例顯著上升,而G1期細胞比例顯著下降,這與本資料結論一致,提示ARF-BP1可能通過PI3K/AKT信號通路或者抑制P53基因的表達來促進細胞停滯于G2期,并顯著減緩細胞由G1期進入S期的速率[10,11]。另外突變型P53以及mcl-1 的表達顯著降低,提示ARF-BP1-siRNA成功轉染后,相關抗腫瘤細胞凋亡因子表達呈現不同程度以及不同時間節點的下降,提示ARF-BP1可能與突變型P53基因以及BCL-2家族基因mcl-1 具有協調作用[10,12]。
1 江穎,周信達,劉銀坤,等. 選擇性阻斷異常Wnt信號通路對肝癌細胞生長及侵襲的影響. 復旦學報(醫學版),2010,23(02):146~152.
2 王子豪,段菲,江翰,等.抑制Hedgehog信號通路對肝細胞癌細胞生長和遷移的影響. 中華實用診斷與治療雜志,2014,32(10):979~982.
3 覃新干,羅殿中,呂自力,等.ARF-BP1基因對肝癌HepG2細胞凋亡的影響及其機制探討. 山東醫藥,2014,37(32):4~6.
4 Zhu X, Wu L, Yao J, et al. MicroRNA let-7c Inhibits Cell Proliferation and Induces Cell Cycle Arrest by Targeting CDC25A in Human Hepatocellular Carcinoma. PLOS ONE,2015,10(4):242~266.
5 Kang F, Wang L, Jia H, et al. B7-H3 promotes aggression and invasion of hepatocellular carcinoma by targeting epithelial-to-mesenchymal transition via JAK2/STAT3/Slug signaling pathway. Cancer Cell Intern ational,2015,15(1):112~132.
6 賈中芝,馮耀良. p53基因在肝細胞癌治療中的現狀與展望. 國際醫學放射學雜志,2009,21(2):157~159.
7 李玉梅,汪蕊,歐玉榮,等.PTEN和p53在肝細胞癌中的表達及其相關性. 蚌埠醫學院學報,2013,34(12):1551~1554.
8 Izzo F, Palaia R, Albino V, et al. Hepatocellular carcinoma and liver metastases: clinical data on a new dual-lumen catheter kit for surgical sealant infusion to prevent perihepatic bleeding and dissemination of cancer cells following biopsy and loco-regional treatments. Infectious Agents and Cancer,2015,10(1):114~132.
9 劉瑞磊,王佳妮,張鵬,等. SIAH2蛋白在肝細胞癌發生、發展中的作用研究. 中華肝臟外科手術學電子雜志,2014,21(3):189~193.
10 余元龍,周仕海,陳宏,等.高遷移率族蛋白HMGA1在肝細胞癌及膽管細胞癌中的表達差異及臨床意義.中華普通外科學文獻(電子版),2013,11(02):91~95.
11 覃新干,羅殿中,呂自力,等. ARF-BP1基因對肝癌HepG2細胞凋亡的影響及其機制探討. 山東醫藥,2014,53(32):4~6.
12 徐軍,王健,胡勇,等. 肝細胞癌組織中FoxP3~+調節性T細胞與上皮間質轉化和患者預后的關系. 中國癌癥雜志,2014,25(12):914~919.
Objective To investigate the effect of ARF-BP1 gene on apoptosis of HepG2 in hepatocellular carcinoma. Method s A randomized logarithmic growth phase cells transfected HepG2 cells were divided into cell transfection group,liposome control group and negative control group and the control group. the 100nmol / L ARF-BP1 siRNA using liposome count,transfected into HepG2 cells; liposome control group without siRNA fragments,just add liposome; transfected with siRNA fragment negative to negative control group; blank control group with the same amount of media,without siRNA fragments and liposomes. The proliferation of HepG2 cells at different times after each group using the interference tetramethyl ARF-BP1 Blu-ray absorptiometry azo wow,each group after transfection 72h HepG2 cell cycle and apoptosis by fl ow cytometry,RF-BP1 siRNA transfection group and control group at different time points ARF-BP1 mRNA,p53 mRNA,mcl-1 mRNA expression levels were detected by RT-PCR. Results 24h,48h and 72h,ARF-BP1 on transfected HepG2 cells inhibit effi ciency gradually increased(P<0.05). At each time point,transfected cell transfection grouP<liposome grouP<negative control grouP<blank group(P<0.05). 72h after transfection,for the HepG2 cell apoptosis rate,cell transfection group> liposome group> negative control group>control group. G1 phase cell transfection grouP<liposome grouP<negative control grouP<blank control group. G2 phase cell transfection group> liposome group> negative control group> blank control group(P<0.05). After the ARFBP1 siRNA transfection 72h,p53mRNA relative mcl-1 mRNA expression and lower than the control group(P<0.05). Conclusion ARF-BP1 gene expression in HepG2 cells is reduced can promote apoptosis of HepG2.
Hepatocellular carcinoma ARF-BP1 gene HepG2 cells
浙江省科技廳計劃項目(2009C33096),浙江省臺州市科技局資助項目(121ky08)
317000 浙江省臺州醫院肝膽外科
*

