淺析藥品注冊人員在藥品生命周期中的作用
朱精兵(浙江圣兆藥物科技股份有限公司,浙江杭州310051)
淺析藥品注冊人員在藥品生命周期中的作用
朱精兵
(浙江圣兆藥物科技股份有限公司,浙江杭州310051)
查閱藥品注冊相關的監管法規,檢索醫藥法規事務協會相關網站信息以及期刊文獻,分析藥品注冊人員在藥品上市前研究、上市過程中及上市后的整個藥品生命周期中所發揮的作用,并探討增強其作用發揮的途徑和方法。藥品注冊人員在藥品生命周期中發揮舉足輕重的作用,需借鑒國外的實踐經驗及模式,增強其作用的發揮。
藥品注冊;法規事務;藥品注冊專員;藥品生命周期;作用
藥品注冊是藥物研發的最后一環,狹義的藥品注冊是針對藥品上市許可申請,其完整定義見2007年頒布的《藥品注冊管理辦法》[1],廣義的藥品注冊包含藥品上市過程中相關的審評審批以及再注冊申請、針對已注冊事項改變的補充申請。絕大部分制藥企業和藥物研發機構都設置注冊部門,配備必要的注冊申報人員。
由于國情和發展水平的不同,我國的藥品注冊人員素質、能力和水平與人用藥品注冊技術要求國際協調會(ICH)成員國的藥品注冊申報人員差距很大。隨著我國藥品監管制度的發展完善、健全,藥品注冊法規、指導原則不斷的修訂、增加,藥品注冊管理工作也越來越向美國食品藥品監督管理局(FDA)、歐洲藥品管理局(EMA)、歐洲藥品質量管理局(EDQM)、日本藥品與醫療器械管理局(PMDA)等發達國家藥監機構看齊,由粗放型管理模式向精密型管理模式轉變。在藥品的整個生命周期(從早期調研、研究和開發到上市批準后臨床應用直至退市終止),藥品注冊人員都發揮著舉足輕重的作用。成立于1976年的美國醫療法規事務學會提出了藥品注冊人員的職業活動范圍框架模型(見圖1),全面展示了藥品注冊人員的執業范圍。
1 藥品注冊人員應具備的條件
在我國藥物研發尚處于仿制的早期,很多人對注冊人員工作的理解也僅僅是“整資料、跑腿、拉關系、拿批文”,原因在于企業對于研發不夠重視,在注冊法規不健全的情況下,相關工作制度和流程欠缺,注冊申報工作的目的就是拿批文,忽視了研發的投入和研發注冊團隊的建設。
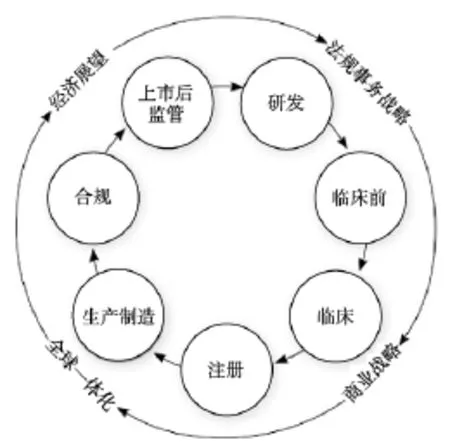
圖1 藥品注冊人員職業活動范圍框架
從2003年開始實施的《藥品注冊管理辦法》中有明確規定:“辦理藥品注冊申請事務的人員應當是相應的專業技術人員,并熟悉藥品注冊管理法律、法規和技術要求。”2005年修訂和2007年修訂的《藥品注冊管理辦法》亦有同樣的要求。根據該要求,很多省的食品藥品監督管理局都出臺了相關規定,建立了藥品注冊申報人員備案制度,對藥品注冊申報人員的資格進行確認并定期培訓,確保其履行相應的職責。藥品注冊專員亦成為一種職業和崗位。2006年出臺的《北京市藥品注冊專員登記辦法》規定“熟悉藥品注冊的管理法律法規和各種規定要求,熟練掌握藥品注冊申報程序的、從事藥品注冊申報工作的專業人員,即藥品注冊專員”[2]。2012年的《福建省藥品注冊專員管理規定》(試行)對藥品注冊專員應具備的條件進行了詳細的規定,共有五條要求,從專業背景、工作年限和工作經歷、知識能力結構、思想素質等方面作了具體的規定[3]。2010年開始執行的《廣東省食品藥品監督管理局關于藥品注冊申報人員的管理規定》列出了注冊專員應具備的六條要求[4]。還有其他一些省份的藥監機構也出臺了類似的制度。
總而言之,藥品注冊申報人員應具有醫藥相關專業大專以上的學歷,具有藥物研發和藥品注冊方面的工作經驗,應熟悉藥品注冊的法律法規和指導原則,熟悉申報品種的情況,具備良好的組織、溝通協調能力,能處理注冊過程中遇到的各種問題,具有較強的學習能力,能及時掌握藥品注冊政策和品種最新動態信息,誠實守信、遵紀守法、保守企業秘密。
2 藥品注冊人員的崗位職責
藥品注冊可分為新藥申報臨床、新藥申報生產、仿制藥申報生產、進口藥品注冊申請、藥品注冊補充申請、藥品再注冊申請,藥品注冊專員的英文名稱為 regulatory affairs specialist,簡稱為 RA specialists,亦稱法規事務專員,在外資藥企較為常見,國內早些年一般稱為藥品注冊員,根據從事的業務領域可分為國內藥品注冊、進口藥品注冊、國際藥品注冊、原料藥注冊、制劑注冊等。從行政級別和管理序列上劃分,高級別依次有高級藥品注冊專員、藥品注冊主管、藥品注冊經理、藥品注冊總監等。作為一種新興職業,已被列入《100個最具前景的職業》(理科版)一書。
其崗位職責每個公司根據職能劃分會有所不同,有所側重,一般應具有以下職責:跟蹤項目研發及申報進度,解決研究及申報過程中遇到的問題;注冊申報資料撰寫、翻譯、整理及遞交;根據公司研發計劃協助或獨立制定項目注冊計劃并執行;參與項目立項,管理與注冊申報相關的檔案資料;及時傳達藥品注冊相關的政策、法規及技術指導原則,聯絡藥監部門的相關人員;負責藥品注冊現場核查的準備及接待工作;負責藥品研發過程合規性的檢查及企業內部注冊相關的培訓。
3 藥品生命周期概述
產品生命周期理論是近年來研究較為深入的熱門話題,該理論試圖揭示產品不同階段的特征及應采取的市場策略。藥品是一種特殊的商品,安全、有效、質量可控是核心要求,其生命周期有自身的規律性,ICH質量部分指南“藥物開發”(第2版)(Q8(R2))對生命周期的定義為:“一個產品從開始研發到上市,直至產品終止的所有階段。”在不同階段有具體的目標要求,ICH質量部分指南“制藥質量體系”(Q10)提出了藥品生命周期四個階段及每個階段的目標,包括“藥品研發、技術轉移、商業化生產和產品終止”,圍繞每個階段的目標,有不同的監管要求,各種活動應遵循一定的規范,如表1所示。ICH質量部分指南“藥品生命周期管理的技術和法規考慮”(Q12)已經發布概念稿。歷史上有很多藥品因為安全性問題而被撤市從而終止使用,而有些則是因科技進步、產品更新換代而自然停止使用。
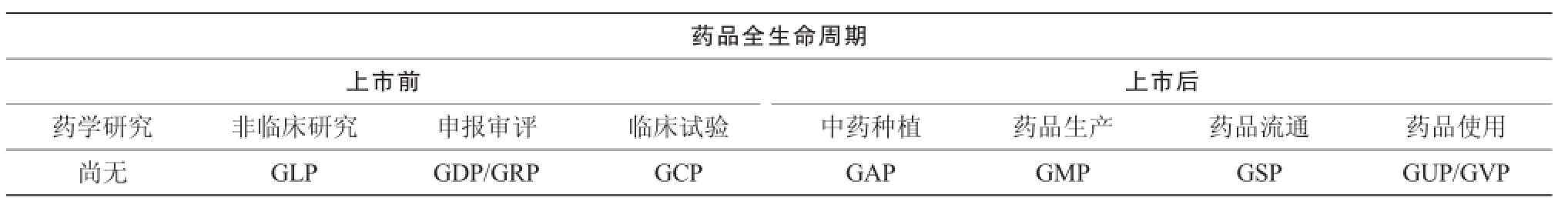
表1 藥品生命周期過程中遵循的規范
4 藥品注冊人員在藥品上市過程中的作用
藥品誕生過程是藥品生命周期的起始,是進入市場服務民眾生命健康的開始,絕大多數國家對藥品市場準入實行嚴格的許可制度,即藥品注冊審評審批制度,只有經過技術審評和行政審批才能獲得藥品批準文號。
藥品上市之前的藥物研發過程是不斷提出假設并加以驗證、設計試驗方案通過實施獲得有用信息的過程,不論是新藥上市,還是仿制藥上市,均需經歷一定周期的研發過程。此過程需要研發人員和注冊人員的共同努力。無論是設計產品及生產工藝的藥學研究還是初步證明安全性和有效性的臨床前藥理毒理研究,直至獲批臨床后的臨床試驗,各種方案的設計、試驗的實施、結果及數據真實性、完整性復核、原始記錄規范性填寫的自查、申報資料的撰寫與整理、申請表格填寫和申報流程的執行均有注冊人員的參與。
藥物研發最直接的目的是收集和獲得藥品注冊相關證據和信息,以支持藥物上市,發揮其臨床效益。研發過程中的信息是異常繁雜的,注冊人員應盡可能保證研發人員獲得的信息是注冊可用的,也是符合相關技術指導原則要求的,研發的起始就應明確研發的目標和注冊的要求,并在研發過程中貫徹落實各種技術要求,所以注冊不是被動的等待試驗結果,應與研發負責人員一起用注冊的標準規劃和指導研發[5]。
4.1注冊人員在立項階段的作用
藥品研發項目總是從立項開始,很多企業都有專門的信息調研和專利分析人員,注冊人員應在此階段就參與其中,對可行性研究報告中的注冊可行性進行充分的分析論證。注冊工作接觸面廣、信息量大,注冊人員通過細心、踏實的工作以及觀察、總結和提煉,進行必要的風險評估,能給企業決策提供有益的參考。當前仿制藥無序申報、過度重復申報情況嚴重,產品存在無法通過審批及上市后競爭激烈的風險,作為藥品注冊人員應時刻關注國家宏觀政策導向,關注監管部門發布的警示信息,為研發準備階段的選題、項目調研、立項論證提供合理化建議。
立題目的與依據的撰寫是藥品注冊人員的基本功,藥品研發工作應遵循“新、優、同、實”的原則開展,承擔藥品監管相關政策法規宣傳任務。藥品注冊人員與藥品監管部門接觸最多,是企業了解和掌握藥品監管法規的重要“載體”,因此,藥品注冊人員承擔著藥品監管政策法規宣傳和咨詢任務。在立項前藥品注冊人員就要為企業的領導和各部門提供藥品監管的政策法規信息,為企業決策做好參謀,同時對企業出現的違法違規行為要及時制止。
4.2注冊人員在研發實施過程中的作用
項目啟動后,注冊人員雖然不用親自動手操作實驗,但應對研發方案加以了解,并能提出合理性的建議,因為任何方案和計劃的制訂均需依據和滿足法規要求,研究是永無止境的,但研發有度,目標、目的明確,探索性的研究屬于基礎研究及學術研究范疇,注冊人員應協助研發人員提升方案計劃的嚴肅性、嚴謹性和科學性,并參與項目管理過程,對階段性成果進行驗收。藥物研發過程不確定性因素較多,常有變更發生,實驗也是逐步向前推進,為確保實驗的質量、效率及實驗數據的完整性、可追溯性,引入GMP的理念和管理要求是非常有必要的,我國2010年版GMP第九條明確規定“質量保證系統應當確保藥品的設計與研發體現本規范的要求”[6],尤其到了產品中試、試生產階段,預防差錯發生和防止混淆、降低污染的要求特別迫切,注冊人員通過各種記錄的檢查、物料平衡的核算,確保樣品試制、注冊批生產過程的合規性。
仿制藥研發過程主要是建立可大生產的工藝、建立符合可接受標準的質量控制分析方法,新藥的研發過程在臨床前研究階段除了藥學研究試驗外,還需進行動物藥理毒理實驗,注冊人員應關注委外研究單位的資質。QbD(quality by design,質量源于設計)的理念在研發過程中越來越重要,注冊人員應協助研發人員建立各種控制策略和措施,增強源頭控制、過程控制和終點控制相結合的意識。
注冊人員應參與藥學研究質量管理規范的建立和實施,通過文件管理和項目管理手段保證藥學研究工作的質量和效率。同時還應了解GLP和GCP的要求,保證非臨床研究及臨床試驗符合相關的規范要求。
4.3注冊人員在藥品注冊申報過程中的作用
毋容置疑,注冊申報是注冊人員工作的重頭戲,也是將階段性成果和試驗結論遞交藥品注冊監管部門的過程。申報資料的撰寫尤其重要,需貫徹GDP(good dossier practice,良好申報資料撰寫規范)的理念,注冊人員應對注冊法規、流程、文件編寫要求非常熟悉,與審評人員立足點和思考方式一致,即保證產品研發結果能支持生產出符合預期用途和質量標準的藥品。申請過程中應確保符合程序要求,及時補充相關的資料,執行監管部門出臺的《藥品注冊申請受理要求》及《藥品注冊申請良好規范》。審評過程中,注冊人員與藥品監管注冊審評部門進行必要的溝通協調,并積極咨詢,對需要補充資料或補充研究的及時反饋研發負責人員,通過對GRP(good review practice,良好審評規范)的了解關注藥物評價的要求與要點,保證產品順利獲批臨床或生產。
熟悉藥品注冊分類、注冊要求、注冊申報流程是注冊人員工作的基本要求。注冊過程需要按照流程填寫藥品注冊申請表并遞交資料,與注冊受理人員溝通確保通過形式審查,并與藥檢部門協調注冊檢驗和質量標準復核事宜,積極咨詢、緊密關注審評審批進展情況。
批準前現場檢查(pre-approval inspection,PAI)工作是藥品注冊和審評環節非常重要的一步,藥品注冊人員協調檢查的時間及要求,配合研發各參與方準備、迎接檢查,跟進督促問題的整改落實,確保順利通過研制現場、生產現場及臨床試驗現場的核查。
藥品注冊人員在藥品上市過程中通過參與各種研發活動、協助建立各種規范化流程、貫徹傳達法規指導原則要求、自查并督促試驗的實施,作為關鍵的角色對內起到溝通協調的作用,對外則起到橋梁紐帶的作用,通過跟蹤法規的要求和注冊進度,及時獲取重要信息并實時傳達,保證服務工作的到位、前瞻和優質,防止因信息不對稱造成判斷、決策失誤。藥品注冊是藥物從研發階段走到生產線最終走向市場產生價值過程中必不可少的重要一環,藥品注冊人員是一座溝通研發機構、生產車間、監管部門的橋梁,是一條整合企業內部各個環節、各種資源的紐帶。
藥品注冊人員不僅是法規的執行者,而且應該對法規環境的發展趨勢等方面進行思考和計劃,在藥品開發的漫長過程中,充分利用有效的法規智慧和正確預測趨勢將在藥品開發過程中更有效率,從而比競爭者更快速地將產品推向市場。
藥品注冊人員要通過多種途徑,掌握藥品注冊政策和注冊品種的最新動態,及時辦理藥品注冊,避免因政策變化或滯后注冊給企業造成損失。同時,對不公正的審批結論,要及時提出行政復議或行政訴訟,維護企業的合法利益。
5 藥品注冊人員在藥品上市后的作用
新藥上市后根據要求尚需進行Ⅳ期臨床試驗研究及不良反應監測等再評價工作,注冊人員應關注不良反應上報情況,并進行“定期安全性更新報告”的撰寫和提交工作。在歐美國家原料藥備案登記后還需每年提交年度報告。同時藥品上市后會涉及原料藥來源、處方工藝、生產場地、包裝、說明書和標簽的改變等與已批準事項發生變化的情況,需進行補充申請準備和遞交工作。注冊人員是產品上市的先鋒,因為沒有注冊就沒有銷售,同時也是企業保駕護航者,因為藥品上市后的不良事件以及產品召回的良好處理可以為企業避免不必要的商業和聲譽方面的損失。
藥品上市后的再評價是從藥物安全性、藥物經濟學、藥物流行病學等角度對藥品價值的再審視,藥品注冊人員應關注相關信息,為市場人員進行招標、醫保等工作提供支持。
藥品注冊批件到期前需進行再注冊,注冊人員需關注批件的有效期截止時間,以免影響藥品的銷售工作。應與質量管理部門及銷售部門溝通,準備再注冊申報資料并及時遞交。隨著生產工藝和技術的變革,技術升級、設備更新、生產成本降低和質量提高的要求越來越普遍,注冊人員應配合技術部門進行必要的驗證工作,并進行相關變更的補充申請,確保已上市藥品變更研究和變更申請符合法規要求。藥品上市后二次開發也越來越普遍,注冊人員根據風險評估和藥品國內外臨床使用信息能為藥品劑型和適應證方面的開發提供決策參考。隨著市場競爭的加劇,產品線和產品組合的管理越來越重要,注冊人員協助市場人員進行相關調研和研發項目規劃工作,以不斷地推陳出新,滿足臨床應用需求。
藥品注冊人員對申報品種的情況較為了解,可以及時將申報品種與市場同類品種的比較情況向企業市場部反饋,以幫助企業制定銷售政策。配合營銷部門制定市場推廣和定價策略,可以延長藥品的生命周期,維護企業合法利益。同時,藥品注冊人員還要配合市場部對宣傳資料中的藥學部分和上市產品的說明書、包裝材料進行修訂和完善。
在產品終止階段或撤市后,應根據監管要求,對諸如文件記錄、樣品保存以及后續的藥品不良反應收集與評價及報告等活動進行有效的控制。
6 我國與發達國家藥品注冊人員作用的比較
美國、日本、歐盟等發達國家藥物研發水平很高,研發規范性程度高,審評人員力量強大,創新藥特別是具有突破意義的原創新藥獲批數量多,藥品注冊人員受到重視程度高,發揮的作用也較大,一些跨國藥企的注冊部門具有全球市場戰略規劃的職責,為戰略開拓、業務開展和內部運營提供法規支持,一般由資深科學家或律師擔當,另外發達國家從事專門注冊服務咨詢工作的機構也較多,此類服務中介稱之為 CRAO(Contract Regulatory Affairs Organization,合同法規事務組織),而我國從事藥品注冊工作的人員大多處于文件整理、資料遞交的階段,尚不能在整個研發活動中的關鍵環節發揮更大的作用。歐美國家的法規事務工作者與我國的藥品注冊人員在密切跟蹤目標市場的法規變化并向藥品監管部門遞交注冊申請文件,開展后續溝通協調,獲得并保持相關產品的上市銷售許可方面的工作內容大致相同,但歐美國家的法規事務人員還需收集、整理并評估研發同時生成的科學數據,就法律和科學的限制和要求向公司決策層及相關部門提出建議,他們在向公司提出有價值的策略和技術性建議,為開發計劃和公司的整體成功做出商業和科學方面的重要貢獻等方面發揮了更多的作用。
7 藥品注冊人員的職業規劃與發展
作為兼有技術人員和管理人員特性的藥品注冊人員,根據水平和資歷的不同可以劃分為初級、中級、高級三個層次,初級主要從事較為簡單的資料整理與翻譯、資料遞交與跟進工作,中級會涉及到產品生命周期過程中的注冊相關事項,確保注冊批件等相關資料符合法規的要求,高級則具有國際視野和前瞻、規劃、戰略思維,能制定產品注冊策略和規劃,并推動實施[7]。
就個人發展而言,注冊人員應加強自身素質和責任心的培養,提高信息獲取、評價和利用能力,樹立踏實、認真、仔細的工作態度,增強對問題的敏銳度和敏感性,提高分析、解決問題的能力。在實踐中建立相關的工作標準體系,進行產品的生命周期和品種的有序管理,提高企業產品的競爭力,同時應增強知識管理、項目管理知識和技能,不斷學習ICH指南和QbD的思路方法,提高總結、計劃管理能力,提高觀察能力、判斷能力、對重大事項和關鍵信息審核把關和督促的能力,增強風險管理意識,學習FDA基于問題的審評(questionbased review,QbR)、立卷審查(filing review)及我國立卷審查技術要求、電子化通用技術文件(eCTD)相關知識。
醫藥行業的競爭已進入全球化時代,參與國際競爭必須了解和熟悉國際市場準入規則,作為新時期的藥品注冊人員,應熟悉國際藥事法規,了解國外藥品注冊申報要求。
8 增強藥品注冊人員作用的對策與建議
8.1國家政府層面
通過入選國家職業分類大典、制定職業標準提高職業認知度,在高校醫藥專業開設注冊申報課程和案例分析,建立注冊人員動態管理制度、資質審查制度、職業準入制度等,推動注冊人員群體的健康發展。藥品注冊人員作為藥品注冊申請人的受權代表,其能力素養與行為體現了企業藥品注冊活動的水平,監管部門應通過建立注冊人員誠信檔案、繼續教育登記備案、黑名單制度、違規責任劃分與追究制度,幫助藥品注冊人員樹立正確的職業價值觀和制訂合適的職業生涯規劃,從而為我國藥物研發規范化水平的提高以及藥品質量安全事業貢獻一份力量。
8.2行業組織層面
可以成立藥品注冊專員聯盟、協會等行業自律組織,不斷加強注冊人員的交流與培訓學習。通過制定藥品注冊職業行為準則、執業流程,規范藥品注冊申報行為,進而提高藥物研發水平。可由學術聯盟、行業協會組織承擔藥品注冊水平評價類職業資格認定,如美國醫療法規事務學會(Regulatory Affairs Professional Society,RAPS)、英國法規事務專家組織(The Organisation for Professionals in Regulatory Affairs,TOPRA),通過建立在線大學、實施法規事務專業認證,研討職業標準、培訓職業人才、交流職業規劃和發展[8-9]。
8.3企業層面
作為藥品上市的主體和藥品質量安全的第一責任人,企業應建立適宜的制度和激勵措施,充分發揮注冊申報人員的積極性和能動性,作為研發團隊的一員,注冊人員不應該是用時想到、不用時靠邊站,在保障研發活動規范性的同時亦應積極參與研發創新實踐,應建立和完善注冊人員參與各項研發活動的程序、機制。企業應探索建立管理通道和專業通道兩種不同路徑的Y型職業發展雙通道,幫助藥品注冊人員更好地成長,更好地進行職業生涯規劃。
8.4個人層面
作為藥學事業從業者,藥品注冊人員基本上都學習過藥學相關基礎知識,掌握藥物研發及藥品生產的基本技能,應在工作中不斷梳理知識結構,完善補充各種規范流程、技術要求、申報要求及監管要求等知識,通過執業藥師資格考試及繼續教育等途徑加以提升,積極參加藥監部門和社會組織舉辦的培訓、論壇、交流活動。
9 結語
國內已有從事藥品注冊申報的同仁歸納總結過藥品注冊申報人員在藥物研究機構、制藥企業中的作用[10-12],以及開展過相關的藥品注冊職業準入制度研究,隨著監管要求和藥物研發認識的提高,注冊專員備案已成為一種有效的監管手段。保護和促進人民的生命健康是我國藥學事業發展的任務,藥品注冊人員與執業藥師一樣擔負著藥品安全與可及性的責任。本文換一種視角,以提升我國藥物研發水平、適應全球化競爭的要求,從藥品全生命周期角度來分析藥品注冊申報人員應發揮的作用,并提出職業發展的期待和展望,以期促進我國藥學事業的發展。
[1]國家食品藥品監督管理局.藥品注冊管理辦法[S].國家食品藥品監督管理局令第28號,2007-07-10.
[2]北京市藥品監督管理局.北京市藥品注冊專員登記辦法[S].京藥監〔2005〕101號,2005-11-18.
[3]福建省食品藥品監督管理局.福建省藥品注冊專員管理規定(試行)[S].閩食藥監注〔2012〕255號,2012-12-18.
[4]廣東省食品藥品監督管理局.廣東省食品藥品監督管理局關于藥品注冊申報人員的管理規定[S].粵食藥監法〔2010〕79號,2010-05-19.
[5]白毅.合同注冊組織作用顯露[N].中國醫藥報,2014-03-18.
[6]衛生部.藥品生產質量管理規范 (2010年版)[S].衛生部令第79號,2011-01-17.
[7]叢駱駱,張建武,吳彬.藥品注冊職業準入制度研究 [J].中國藥事,2013,27(7):669-673.
[8]Regulatory Affairs Professional Society[EB/OL].http://www.raps. org.
[9]The Organisation for Professionals in Regulatory Affairs[EB/OL]. http://www.topra.org.
[10]付麗紅,曹麗蒙,于魯海,等.藥品注冊申報人員在藥物研究機構中的作用[J].中國藥事,2007,21(6):396-397.
[11]朱晶,陳靜,畢爽.藥品注冊在新藥研發中的作用[J].北方藥學,2011,8(4):67-68.
[12]王曼,謝愛芳,鞠明燕,等.藥品注冊申報人員在制藥企業中的作用[J].齊魯藥事,2011,30(10):612-613.
Brief Analysis on Role of Drug Registration Specialists in Drug Lifecycle
Zhu Jingbing(Zhejiang Sundoc Pharmaceutical Science and Tech Co.,Ltd.,Zhejiang Hangzhou 310051,China)
The role of drug registration(RA)specialists in the whole drug lifecycle stage including R&D and post-market was analyzed by reviewing the relevant drug regulations,retrieving website information and literature in journals,and the ways to enhance the role was discussed.RA specialists play an important role in drug lifecycle,of whom the effect should be given full play by learning the experience and mode in other countries or regions.
Drug Registration;Regulatory Affairs;Regulatory Affairs Specialists;Drug Lifecycle;Role
10.3969/j.issn.1672-5433.2016.01.010
朱精兵,男,工程師。主要從事藥品注冊及藥品質量管理工作。E-mail:zjbfuture@126.com
2015-08-12)

