陽離子抗癌肽Temporin-1CEa脂質體的構建及其體外抗乳腺癌活性評價
吳迪,趙穎,任會丹,司新紅,張琳,王澈,2Δ
(1.遼寧師范大學 化學與化工學院,遼寧 大連 116029;2.遼寧省生物技術與分子藥物研發重點實驗室,遼寧 大連 116081)
陽離子抗癌肽Temporin-1CEa脂質體的構建及其體外抗乳腺癌活性評價
吳迪1?,趙穎1?,任會丹1,司新紅1,張琳1,王澈1,2Δ
(1.遼寧師范大學 化學與化工學院,遼寧 大連 116029;2.遼寧省生物技術與分子藥物研發重點實驗室,遼寧 大連 116081)
目的 建立陽離子抗癌肽Temporin-1CEa藥物載體系統,并評價其體外抗乳腺癌活性。方法 本文選用陽離子抗癌肽Temporin-1CEa利用逆向蒸發法構建聚乙二醇(polyethylene glycol,PEG)修飾的脂質體(Temporion-1CEa-liposomes, Temporin-1CEa-LIP),并對其包封率、粒徑和Zeta電位進行表征,同時對其體外血清穩定性及其對人乳腺癌MCF-7細胞的體外活細胞毒性進行初步評價。結果 采用逆向蒸發法制備PEG修飾的Temporin-1CEa-LIP,其包封率為(55.57±1.56)%,粒徑為(105.3±1.37)nm,Zeta電位為(-16.17±0.964)mV。Temporin-1CEa-LIP具有良好的血清穩定性,能夠被人乳腺癌MCF-7細胞有效攝取,并在作用細胞24 h后與Temporin-1CEa具有相近的抑癌活性。結論 PEG修飾的脂質體是一種很好的新型多肽類抗癌藥物遞送系統,Temporin-1CEa-LIP有望成為新型的抗癌制劑用于臨床。
抗癌肽;乳腺癌;脂質體;聚乙二醇
乳腺癌是女性常見的惡性腫瘤之一,嚴重威脅人類健康[1]。傳統化療藥物由于靶向性差和多藥耐藥現象的發生,往往導致乳腺癌臨床療效欠佳甚至治療失敗[2]。近年來,隨著對肽類抗癌藥物研究的不斷深入,發現某些陽離子抗癌肽(cationic anticancer peptide,CAPs)具有獨特的作用機制和良好的抑癌作用,且不易產生耐藥性,因此逐漸成為目前新型抗癌藥物研究的熱點。但是由于陽離子抗癌肽在體內易水解,穩定性較差等不足限制了其臨床使用。對陽離子抗癌肽進行藥學修飾并建立藥物載體系統以克服上述缺點并促進其臨床轉化已經成為目前亟待解決的問題。
CAPs分子量較小,帶有正電荷,對腫瘤細胞有較好的選擇性[3-4]。與正常非腫瘤細胞相比,腫瘤細胞的細胞膜表面通常帶有較多的負電荷,CAP能夠通過靜電作用結合到腫瘤細胞的細胞膜上,從而達到靶向性的抗癌作用[5]。本文選取的Temporin-1CEa是從中國林蛙皮膚分泌物中提取的的天然CAP,由17個氨基酸組成,帶3個凈正電荷。本課題組已經證明Temporin-1CEa具有良好的選擇性抗癌作用,能有效殺傷腫瘤細胞的同時對正常細胞無明顯毒副作用[6-7]。但是CAPs無論是口服或是靜脈注射,在體內均具有易水解、穩定性較差等性質,所以迫切需要借助藥物載體將CAPs運輸到體內避免其水解破壞,使其穩定的靶向地作用于腫瘤,從而達到治療的效果[8-10]。
在眾多載藥系統中,脂質體是最先應用于臨床的藥物載體,主要由天然成分組成,具有良好的相容性和靶向性,且體內降解無毒性[11]。聚乙二醇(polyethylene glycols,PEG)可以顯著延長藥物載體在體內的循環時間,PEG修飾的脂質體不易被體內網狀內皮系統作為異物吞噬、清除,并且能夠通過實體瘤的高通透性和滯留效應(enhanced permeability and retention, EPR)[12-14],將藥物有效地靶向腫瘤部位發揮治療作用。
本實驗旨在構建PEG-脂質體藥物載體系統,在保留抗癌肽Temporin-1CEa良好的抑癌效果的基礎上,改善Temporin-1CEa在體內易水解,穩定性較差等缺點,提高抗癌肽Temporin-1CEa在腫瘤細胞內的攝取效率,為今后肽類抗癌新藥制劑的研究和臨床應用研究提供參考。
1 材料與方法
1.1 材料
1.1.1 試劑:葡聚糖凝膠(Sephadex G-50)(Biosharp,日本);MTT(Sigma公司);DMSO(聯邦試劑公司);96孔細胞培養板(Corning公司);DSPE-PEG2000(上海艾偉特醫藥科技有限公司);膽固醇(沈陽市醫藥公司化玻站試劑分廠);乙腈(色譜純)、氯仿、冰乙醚(天津市科密歐化學試劑);Temporin-1CEa(上海吉爾生化有限公司);人乳腺癌細胞MCF-7(凱基生物有限公司);1640培養液、胎牛血清(Gibco公司,美國)。
1.1.2 儀器:DF-101S 恒溫加熱磁力攪拌器(鞏義市予華儀器有限責任公司);JY92-2D 超聲波細胞粉碎機(寧波新芝生物科技股份責任公司);KQ5200B型高功率數控超聲波清洗器(昆明市超聲儀器有限公司);SC-05離心機(安徽中科中佳科學儀器有限公司);SPD-M20A 230V CN 高效液相色譜儀(SHIMADZU,日本);NANO-ZS90激光粒度儀/Zeta電位分析儀;FACSAriaⅡ流式細胞儀;UV-7504PC型紫外可見分光光度儀。
1.2 方法
1.2.1 細胞培養:人乳腺癌MCF-7細胞(凱基生物有限公司)用含10%胎牛血清(Gibco公司,美國)的1640培養液(Gibco公司,美國)。
1.2.2 Temporin-1CEa-LIP制備:分別精密稱取S100磷脂、膽固醇、DSPE-PEG2000適量溶于無水乙醚,加入抗癌肽Temporin-1CEa的水溶液,2者相互混合至500 mL茄形瓶中,進行超聲波振蕩至形成穩定的W/O型乳劑,在冰水浴條件下旋轉蒸發除去有機溶劑至形成薄膜。加入pH7.4 PBS溶液水化,在冰浴條件下探頭超聲(200W 2 min、400W 2 min、600W 2 min)。所形成的脂質體于4 ℃條件下保存備用[15]。
1.2.3 HPLC法測定Temporin-1CEa-LIP包封率:色譜條件:色譜柱為 Diamonsil C15柱(200 mm×4.6 mm, 5 μm);流動相為乙腈:水(7:3, v/v);檢測波長220 nm;柱溫25 ℃;流速1 mL/min;進樣量10 μL。以抗癌肽Temporin-1CEa峰面積(A)對其濃度(C, mg/mL) 線性回歸得標準曲線。精密量取100 μL載藥過柱子脂質體和100 μL載藥未過柱脂質體,加入乳化劑破乳,過膜(0.22 μm),進樣測定。根據線性回歸方程得出藥物濃度,計算包封率EE%(entrapment efficiency, EE%)。包封率=(載藥過柱子脂質體中含藥物的濃度)/(載藥未過柱脂質體中含藥物的濃度)×100%。共檢測3次。
1.2.4 不同時間Temporin-1CEa-LIP的藥物泄露量:精密吸取Temporin-1CEa-LIP 100 μL,分別于0、3、5、9、24和48 h過葡聚糖凝膠柱去除游離藥物。加入破乳劑,用HPLC法測定(默認0 h藥物含量為100%)。共檢測3次。
1.2.5 Temporin-1CEa-LIP粒徑和電位考察:取Temporin-1CE-LIP 100 μL,用超純水稀釋至1 mL,采用激光粒度儀/Zeta電位分析儀對其粒徑與Zeta電位進行測定。共檢測2次。
1.2.6 Temporin-1CEa-LIP體外血清穩定性考察:取Temporin-1CE-LIP與濾過的胎牛血清等體積1:1(v/v)混合,分別于0.5、1、2、4、8和24 h取100 μL,用超純水稀釋至1 mL,采用激光粒度儀/Zeta電位分析儀對其粒度進行測定。共檢測3次。
1.2.7 Temporin-1CEa-LIP細胞攝取考察:將人乳腺癌MCF-7細胞以2×105個/mL的密度分瓶,37 ℃、5% CO2過夜培養。根據包封率計算加藥濃度,設置實驗組和對照組,實驗組為FITC標記的Temporin-1CE-LIP,對照組為FITC標記的Temporin-1CE抗菌肽,設每空加藥濃度為0、10、30、50 μM,分別作用4、24 h,將原培養液吸出后,用PBS漂洗3次,胰酶消化,離心后用500 μL PBS重懸細胞,采用流式細胞儀檢測細胞對Temporin-1CE-LIP的攝取強度。共檢測3次。
1.2.8 Temporin-1CEa-LIP對人乳腺癌MCF-7細胞的細胞毒性考察:將人乳腺癌MCF-7細胞,以5×104個/mL接種于96孔板中,在37 ℃、5% CO2培養箱中培養。根據包封率計算加藥濃度,設10、20、40、60、80和100 μL濃度梯度。24 h后加入MTT溶液繼續培養,4 h后吸掉上清液,加入二甲基亞砜,用酶標儀測定,波長吸光度值492 nm。共檢測3次。

2 結果
2.1 Temporin-1CEa-LIP包封率 脂質體的藥物包封率是對載藥脂質體的一個重要評價。根據線性回歸方程:Y=3.8E+6X+7743.6,R2=0.9964,推導藥物濃度,計算Temporin-1CEa-Lip的包封率。結果發現,本實驗室制備的Temporin-1CEa-LIP包封率為(55.57±1.56)%。
2.2 不同時間Temporin-1CEa-LIP的藥物泄露量 脂質體的磷脂雙分子層將抗癌肽Temporin-1CEa包封在脂質體內水腔,由于抗癌肽Temporin-1CEa本身的性質,可能會使脂質體膜材料對其包封率產生影響。因此探究Temporin-1CE-LIP不同時間點藥物泄漏量,評價其穩定性。由圖1可見,Temporin-1CE-LIP在48h后,藥物含量仍然在60%左右,說明PEG修飾后的抗癌肽Temporin-1CEa脂質體具有良好的穩定性。
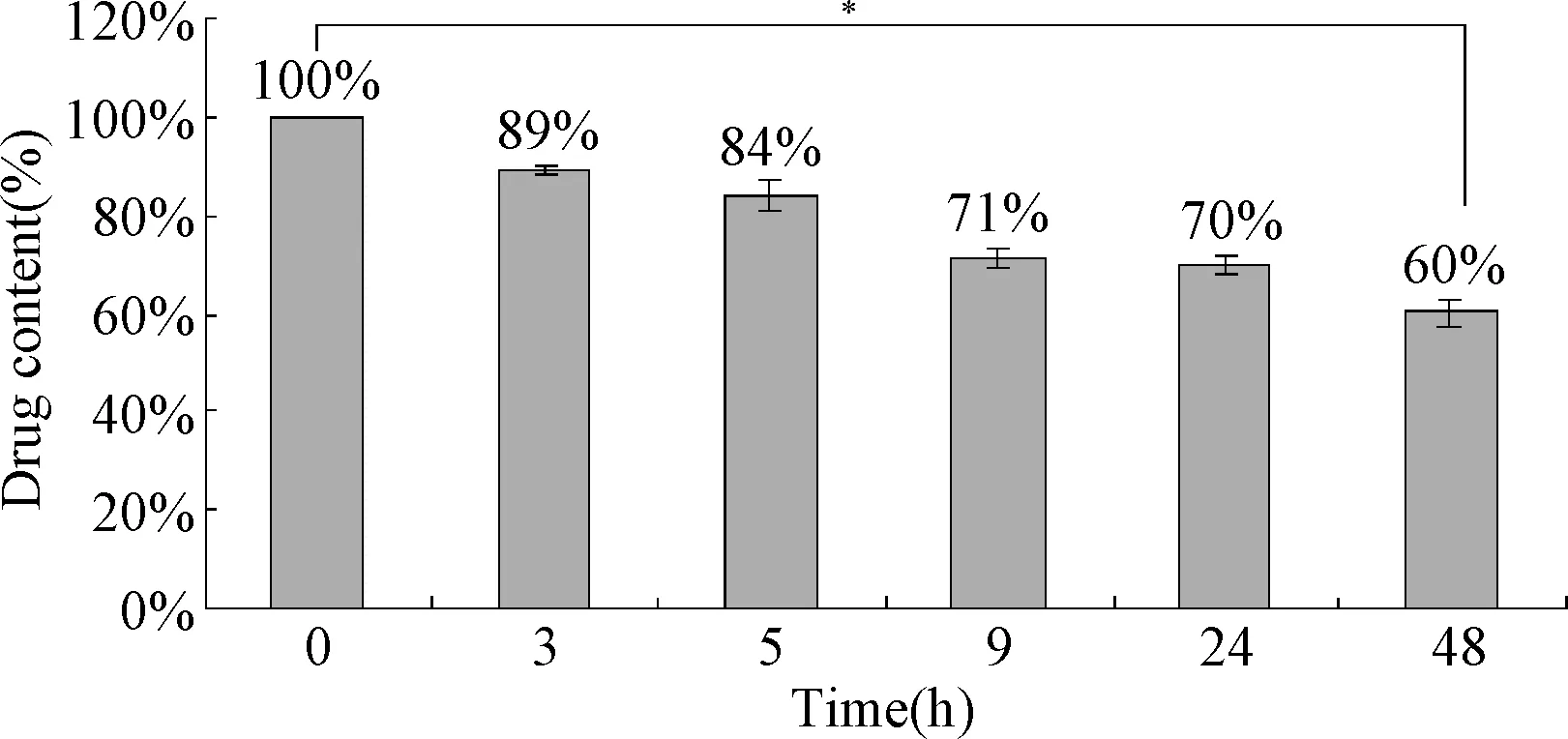
圖1 不同時間點Temporin-1CE-LIP藥物含量*P<0.05,1h與48h比較Fig.1 The drug content of Temporin-1CE-LIP at different time points( ±s,n=3)*P<0.05,compared 1h with 48 h
2.3 Temporin-1CEa-LIP粒徑和zeta電位 為了使Temporin-1 CE-LIP可以有效地遞送到腫瘤部位,對其粒徑和電位進行測定。由表1和圖2可見,Temporin-1CE-LIP的粒徑為(105.3±1.37)nm,PDI為(0.215±0.0586),表明Temporin-1CE-LIP具有良好的均一性。Temporin-1CE-LIP的Zeta電位為(-16.17±0.964)mV,由原來的正值變為負值,且絕對值增大。
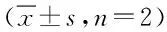
表1 Temporin-1CE-LIP的Size 和Zeta電位Tab.1 Size and Zeta potential of Temporin-1CE-LIP ±s,n=2)
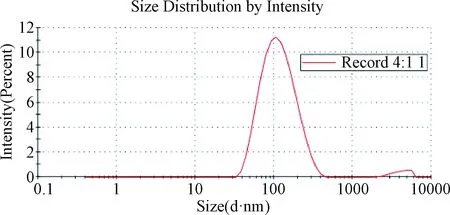
圖2 Temporin-1CE-LIP粒徑Fig.2 Size of Temporin-1CE-LIP
2.4 Temporin-1CEa-LIP體外血清穩定性 為了模擬體內環境,考察Temporin-1CE-LIP進入體內的血清穩定性,本課題將脂質體與胎牛血清混合孵育,并在不同時間點對其粒徑進行測定,考察其血清穩定性。由圖3可見,Temporin-1CE-LIP在不同的時間點,粒徑均在110 nm左右,且保持穩定,說明該脂質體具有良好的血清穩定性。
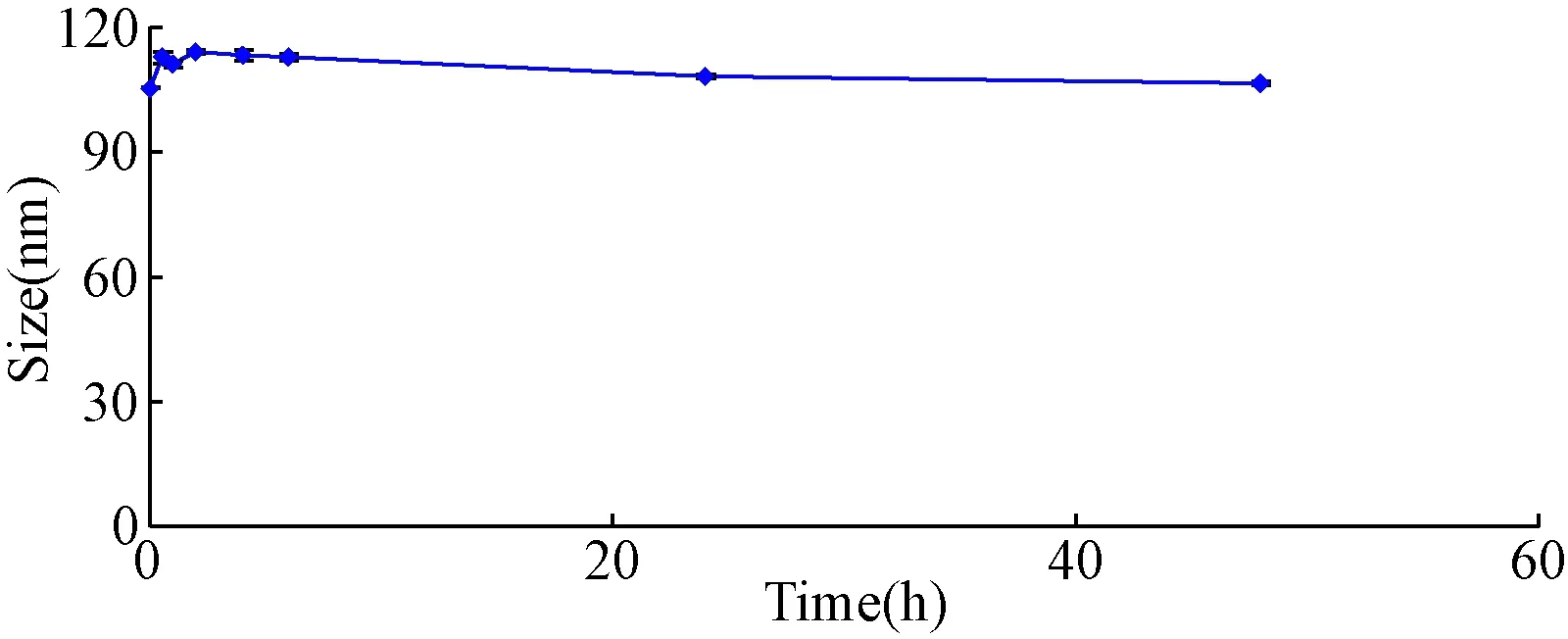
圖3 Temporin-1CE-LIP不同時間點在血清中粒徑大小Fig.3 Particle size of Temporin-1CE-LIP at various time points
2.5 Temporin-1CEa-LIP的細胞攝取 為了探究PEG修飾的Temporin-1CE-LIP能否被人乳腺癌MCF-7細胞攝取,本研究進一步考察了4 h和24 h不同時間點的細胞攝取。由圖4、5可見,在相同時間條件下,隨著孵育濃度的增加,細胞對脂質體的攝取強度顯著性增強;在相同濃度條件下,隨著孵育時間的增加,細胞對脂質體的攝取強度顯著性增強,此結果表明,MCF-7細胞對Temporin-1CE-LIP的攝取呈時間和濃度依賴性。
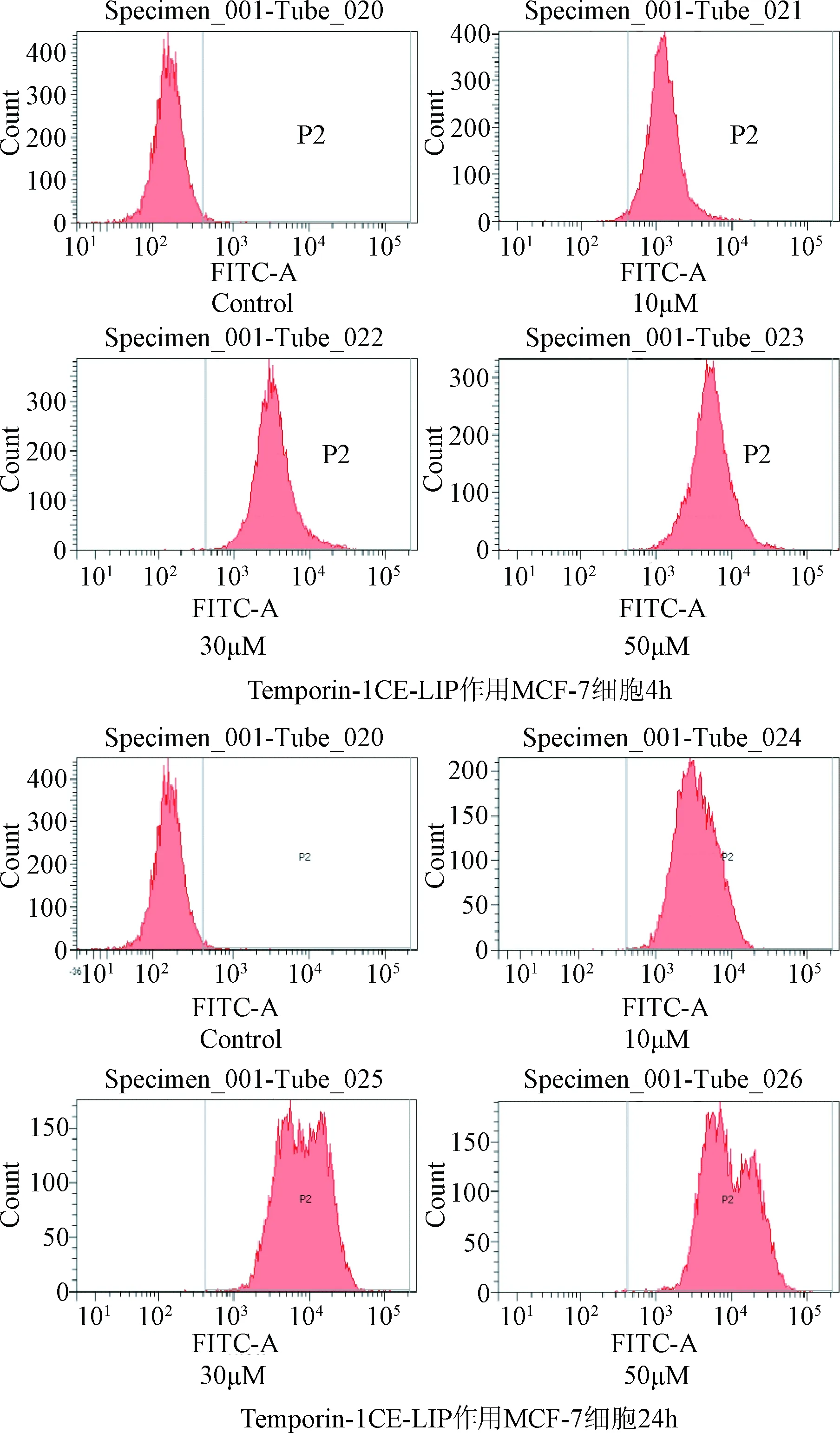
圖4 MCF-7細胞對Temporin-1CE-LIP攝取的流式圖Fig.4 The flow cytometry of MCF-7 cell uptake of Temporin-1CE-LIP
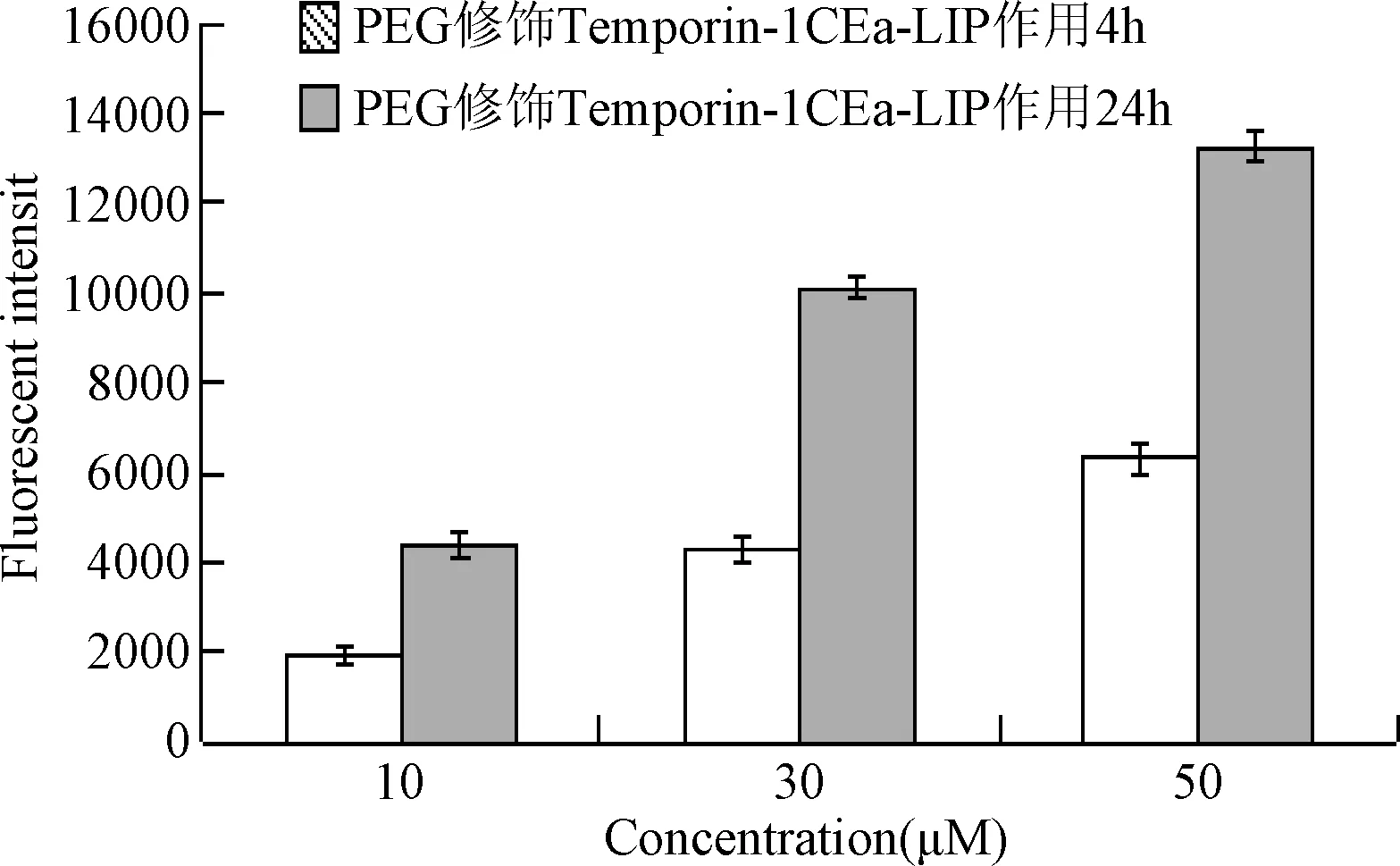
圖5 MCF-7細胞對Temporin-1CE-LIP攝取量Fig.
2.6 Temporin-1CEa-LIP對人乳腺癌MCF-7細胞的細胞毒性 為了驗證Temporin-1CE-LIP抑癌效果與Temporin-1CEa抗癌肽是否一致,效果是否顯著,本研究進行了Temporin-1CE-LIP對人乳腺癌MCF-7細胞的細胞毒性考察。由圖6可見,Temporin-1CEa抗癌肽對人乳腺癌MCF-7細胞IC50值為25.98 μM;Temporin-1CE-LIP對人乳腺癌MCF-7細胞IC50值為29.32 μM,表明Temporin-1CE-LIP作用MCF-7細胞24h與Temporin1-CEa抗癌肽抑癌效果一致。
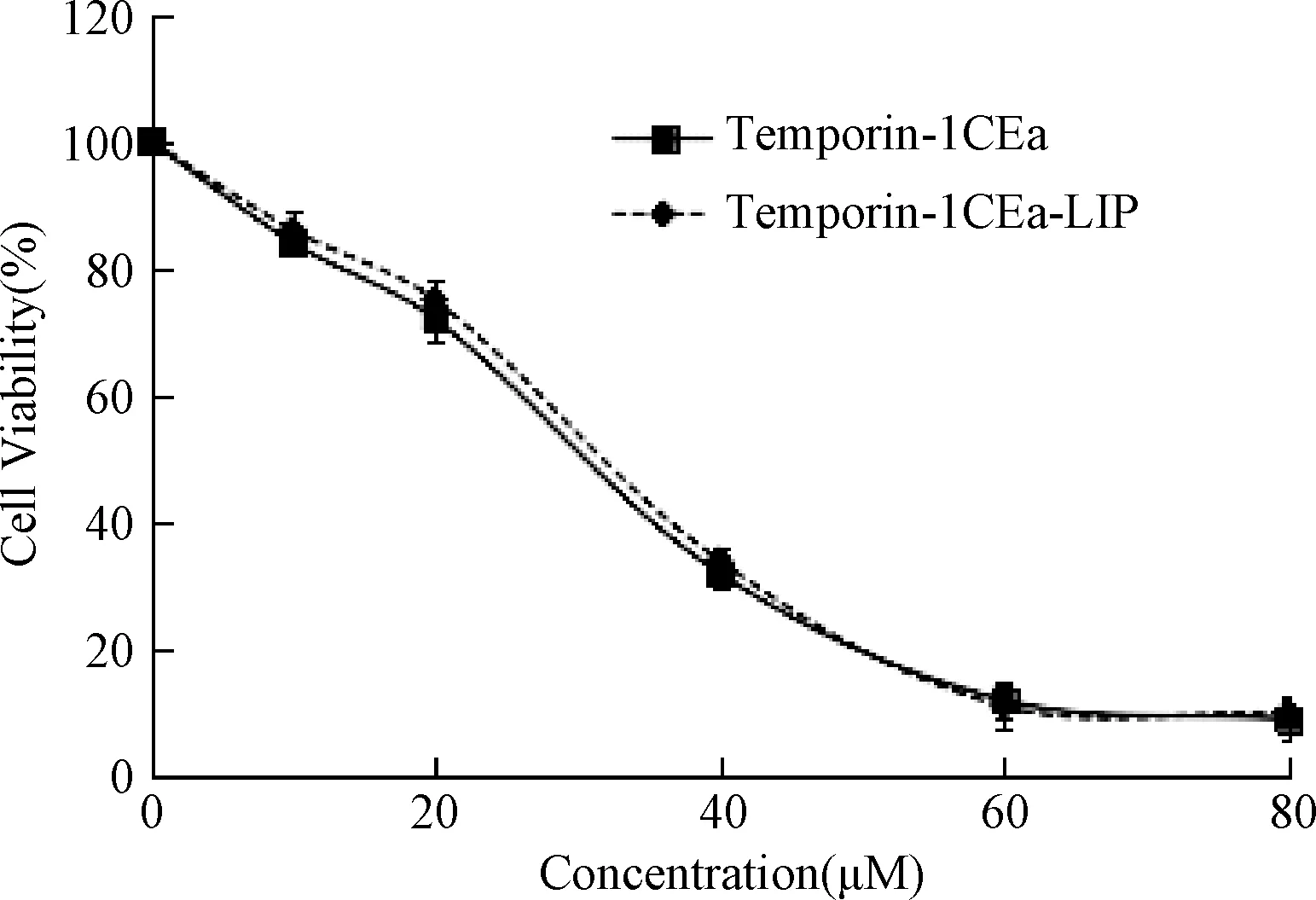
圖6 MTT法檢測Temporin1-CEa抗癌肽、Temporin-1CE-LIP對MCF-7 細胞的細胞毒作用Fig.6 Cytotoxic effects of Temporin1-CEa,Temporin-1CE-LIP by
3 討論
CAPs的抗癌活性顯著,對癌細胞不易產生耐藥性,能特異性識別癌細胞,且對正常細胞不會造成損害[16]。其中,抗癌肽Temporin-1CEa帶有3個正電荷,可以通過靜電作用與含負電荷成分的腫瘤細胞的細胞膜結合,殺死癌細胞,達到抑癌效果。本課題組的前期研究表明Temporin-1CEa對人乳腺癌MCF-7細胞具有良好的抑癌效果,在有效殺傷腫瘤細胞的同時對正常細胞無明顯毒副作用。然而,包括Temporin-1Cea在內的CAPs具有體內易降解,穩定性差[17]等局限性。
對陽離子抗癌肽進行藥學修飾并建立藥物載體系統以克服上述缺點并促進其臨床轉化已經成為目前亟待解決的問題。本研究構建了含抗癌肽Temporin-1CEa的PEG修飾的脂質體載藥系統。利用PEG的親水性,可以減少被網狀內皮系統攝取,同時脂質體到達腫瘤部位后,作為“橋梁”直接與細胞膜接觸,增加其介導脂質體入胞幾率[18-19]。前期研究發現甲醇和氯仿會對Temporin-1CEa抗癌肽理化性質產生影響,且在進行體外細胞實驗時甲醇和氯仿的存在會影響實驗結果,因此不能選用甲醇和氯仿溶解Temporin-1CEa抗癌肽,而薄膜分散法一般采用氯仿作為溶劑,故排除薄膜分散法制備脂質體,又由于抗癌肽Temporin-1CEa是一種水溶性藥物,所以本文采用逆向蒸發法制備Temporin-1CEa-LIP。
近年來,PEG被廣泛應用在納米載體的構建中。其通過滲透和EPR效應到達腫瘤部位發揮作用的被動靶向脂質體的粒徑范圍是100~200 nm[20]。本實驗中制備的Temporin-1CEa-LIP的粒徑為105.3 nm,表明通過逆向蒸發法制備的被動靶向脂質體Temporin-1CEa-LIP的粒徑滿足基本要求。此外,有研究表明,經PEG修飾后的脂質體,粒徑和Zeta電位等性質的變化,使其更易進入體內,通過EPR效應作用附集在瘤體周圍,發揮抑癌作用[21]。結果顯示,Temporin-1CEa-LIP的Zeta電位為-16.17 mV,由原來的正值變為負值,且絕對值增大,說明外層長鏈 的PEG 可以有效屏蔽內層帶正電的陽離子抗癌肽Temporin-1CEa (表 1), 而對正電荷的屏蔽有利于減少脂質體與血漿蛋白的相互作用, 延長其在體內的循環時間,增強了在生物體內的穩定性[22]。但是抗癌肽Temporin-1CEa本身帶正電荷,而本實驗中的Temporin-1CEa-LIP帶有負電荷,這可能會妨礙脂質體與癌細胞的相互作用。然而,本實驗制備的陽離子抗癌肽Temporin-1CEa-LIP克服了其體內易降解,穩定性差等局限性,并且PEG可以延長脂質體在體內的循環時間, 改變脂質體的組織分布,使其更好地發揮抑癌作用。
另一方面,體外血清穩定性實驗也進一步證明了該載藥系統的穩定性。實驗結果表明,該脂質體與血清混合后,具有良好的穩定性,這可能是因為PEG修飾后的脂質體可以延長藥物載體在體內外的循環時間[23]。此外,體外活性初步評價的實驗表明,Temporin-1CE-LIP作用人乳腺癌MCF-7細胞24h與Temporin-1CEa抗癌肽具有相近的抑癌效果,說明脂質體載藥系統較好地保留了抗癌肽本身所具有的抑癌活性。
綜上所述,PEG修飾的Temporin-1CE-LIP不但提高了抗癌肽Temporin-1CEa在血清中的穩定性還保留了抗癌肽Temporin-1CEa良好的抑癌效果,因此Temporin-1CE-LIP有望成為治療乳腺癌疾病的一種新型的載藥系統。
[1] Elmore JG.Breast cancer screening: balancing evidence with culture, politics, money, and media[J].Breast Cancer Screening,2016,1:1-27.
[2] DeSantis CE,Lin CC,Mariotto AB,et al. Cancer treatment and survivorship statistics,2014[J]. CA Cancer J Clin,2014,64:252-271.
[3] Chen HM, Leung KW, Thakur NN. Distinguishing between different pathways of bilayer disruption by the related anticancer peptides cecropin B, B1 and B3[J]. Eur J Biochem,2003,270(5): 911-920.
[4] Aarhiou J, Tjabringa GS, Verhoosel RM, et al. Mechanisms of cell death induced by the neutrophil anticancer peptides α-defensins and LL-37[J]. Inflamm Res,2006,55(3): 119-127.
[5] Yang QZ, Wang C, Lang L,et al.Design of potent, non-toxic anticancer peptides based on the structure of the antimicrobial peptide Temporin-1CEa[J]. Arch Pharm Res,2013,36(11):1302-1310.
[6] Lim SB,Banerjee A,?nyüksel H. Improvement of drug safety by the use of lipid-based nanocarriers [J]. J Control Release,2012,163(1): 34-45.
[7] Aarhiou J,Tjabringa GS,Verhoosel RM, et al. Mechanisms of cell death induced by the neutrophil anticancer peptides α-defensins and LL-37[J]. Inflamm Res,2006,55(3): 119-127.
[8] Felber AE,Dufresne MH,Leroux JC.pH-sensitive vesicles, polymeric micelles, and nanospheres prepared with polycarboxylates Advanced[J]. Adv Drug Deliv Rev, 2012,64(11):979-992.
[9] Sharma G, Modgil A, Layek B, et al.Cell penetrating peptide tethered bi-ligand liposomes for delivery to brain biN in vivob/iN: biodistribution and transfection[J]. J Control Release,2013,167(1):1-10.[10] Shi KR,Li JP,Cao ZL,et al.A pH-responsive cell-penetrating peptide-modified liposomes with active recognizing of integrin αvβ3 for the treatment of melanoma[J]. J Control Release,2015,217:138-150.
[11] Woodle MC. Controlling liposome blood clearance by surface-grafted polymers [J]. Adv drug Deliver Rev, 1998, 32(1): 139-152.
[12] Nichols JW, Bae YH. EPR: evidence and fallacy [J]. J Control Release, 2014, 190: 451-464.
[13] Torchilin V. Tumor delivery of macromolecular drugs based on the EPR effect [J]. Adv Drug Deliv Rev, 2011, 63(3): 131-135.
[14] Maeda H, Nakamura H, Fang J. The EPR effect for macromolecular drug delivery to solid tumors: improvement of tumor uptake, lowering of systemic toxicity, and distinct tumor imaging in vivo [J]. Adv Drug Deliv Rev, 2013, 65(1): 71-79.
[15] Wang H,Jia H,Cheng S,et al. PEG-stabilized micellar system with positively charged polyester core fast pH-responsible drug release [J]. Pharm Res, 2012, 29(6): 1582-1594.
[16] Kim JH,Kim YS,Park K,et al.Self-assembled glycol chitosan nanoparticles for the sustained and prolonged delivery of antiangiogenic small peptide drugs in cancer therapy[J]. Biomaterials,2008,29(12):1920-1930.
[17] Zhang W,Li J,Liu LW,et al.A novel analog of antimicrobial peptide Polybia-MPI,with thioamide bond substitution, exhibits increased therapeutic efficacy against cancer and diminished toxicity in mice[J]. Peptides,2010,31(10):1832-1838.
[18] Wang H,Jia H,Cheng S,et al. PEG-stabilized micellar system with positively charged polyester core fast pH-responsible drug release [J]. Pharm Res,2012,29(6):1582-1594.
[19] Fu H,Hu GL,He Q.Preparation of cell penetrating peptide TAT and cleavable PEG co-modified liposomes loaded with paclitaxel and its in vitro apoptosis assay [J]. Acta Pharm Sin, 2014,49(7): 1054-1061.
[20] Zong T,Mei L,Gao H,et al. Synergistic dual-ligand doxorubicin liposomes improve targeting and therapeutic efficacy of brain glioma in animals [J].Mol Pharm,2014,11(7): 2346-2357.
[21] Kibria G,Hatakeyama H,Ohga N.The effect of liposomal size on the targeted delivery of doxorubicin to Integrin ambPexpressing tumor endothelial cells[J]. Biomaterials, 2013, 34 (22): 5617-5627.
[22] Kuai R,Yuan WM,Qin Y,et al. Efficient delivery of payloadinto tumor cells in a controlled manner by TAT and thiolytic cleavable PEG co-modified liposomes [J]. Mol Pharm, 2010,7(5): 1816-1826.
[23] Zhang L,Wang Y,Gao HL, et al. The construction of cell-penetrating peptide R8 and pH sensitive cleavable polyethylene glycols co-modified liposomes[J]. Acta Pharm Sin, 2015,50(6): 760-766.
(編校:王儼儼)
Construction of cationic anticancer peptide Temporin-1CEa liposomes and evaluation of anti-breast cancer activityinvitro
WU Di1?, ZHAO Ying1?, REN Hui-dan1, SI Xin-hong1, ZHANG Lin1, WANG Che1,2Δ
(1.School of Chemistry and Chemical Engineering, Liaoning Normal University, Dalian 116029, China; 2.Liaoning Province Key Laboratory of Biotechnology and Molecular Drug R & D, Dalian 116081, China)
ObjectiveTo constract and evaluate the cationic anticancer peptide Temporin-1CEa liposomes and evaluate anti-breast cancer activityinvitro.MethodsThe polyethylene glycol (PEG)-modified liposomes containing Temporin-1CEa, one recently discovered cationic anticancer peptide (CAP), were constructed by using reverse-phase evaporation method. The encapsulation efficiency, particle size and Zeta potential of the Temporin-1CEa-containing liposomes (Temporin-1CEa-LIP) were characterized. In addition, that had the furhter evaluated of the stability and specific toxicity against human breast cancer MCF-7 cellsinvitro.ResultsThe data suggested that the PEG-modified liposomes served a promising drug delivery system for CAPs, those indicated by the encapsulation efficiency was (55.57±1.56)%, the particle size was (105.3±1.37) nm and the Zeta potential was (-16.17±0.964) mV. Moreover, theinvitrotest also indicated that Temporin-1CEa-LIP exerted good stability in serum, and it could be efficiently uptaken by MCF-7 cells. Most importantly, after 24h exposure, Temporin-1CEa-LIP showed toxicity against MCF-7 cells, as potent as Temporin-1CEa.ConclusionThe results demonstrates that the PEG-modified liposome is a good drug-delivery system and Temporin-1CEa-LIP could serve as potential anti-tumor candidate for cancer therapy.
anticancer peptide; breast cancer; lipidosome; polyethylene glycol
10.3969/j.issn.1005-1678.2016.11.006
國家自然科學基金(81202448)
吳迪,女,本科在讀,研究方向:藥學,E-mail:1051067749@qq.com;趙穎,共同第一作者,女,碩士在讀,研究方向:靶向抗癌肽脂質體的機理研究及應用,E-mail:656684966@qq.com;王澈,通信作者,女,博士,副教授,研究方向:天然藥物抗腫瘤機制研究及應用,E-mail:wangche126@126.com。
R915;TQ464.7;R737.9
A

