Runt相關基因2修飾的骨髓間充質干細胞促進兔下頜骨牽張成骨的研究
馮桂娟??鄭科??宋冬惠??吳森斌??祝頌松??胡靜.南通大學附屬醫院口腔科,南通?600;.口腔疾病研究國家重點實驗室?華西口腔醫院正頜與關節外科(四川大學),成都?6004
?
Runt相關基因2修飾的骨髓間充質干細胞促進兔下頜骨牽張成骨的研究
馮桂娟1鄭科1宋冬惠1吳森斌1祝頌松2胡靜2
1.南通大學附屬醫院口腔科,南通?226001;2.口腔疾病研究國家重點實驗室?華西口腔醫院正頜與關節外科(四川大學),成都?610041
[摘要]目的 探討Runt相關基因2(Runx2)修飾的自體骨髓間充質干細胞(MSCs)促進兔下頜牽張成骨新骨形成的可行性。方法 將48只成年雄性新西蘭大白兔隨機分為3組:A組為Runx2重組質粒組,B組為不含Runx2重組質粒組,C組為生理鹽水對照組。建立兔下頜牽張成骨模型;于牽張的第5天,A組兔牽張間隙內注射轉染重組質粒adv-hRunx2-gfp的自體骨髓MSCs;B組注射轉染adv-gfp質粒的自體骨髓MSCs;C組注射同體積生理鹽水。在牽張結束后第8周處死所有動物,進行大體、影像學、組織學觀察和三點彎曲測試。結果 CT平掃及組織學結果表明,A組牽張間隙內新骨形成和骨痂密度均明顯高于B、C組;雙能X線及三點彎曲測試表明,A組牽張間隙內新生骨組織密度、新生骨礦物質含量及最大載荷均高于B、C組(P<0.01)。結論 基于MSCs的Runx2體外基因治療可有效地促進牽張成骨新骨形成,從而縮短固定期,為臨床顱頜面骨缺損的重建提供一個極具價值的修復策略。
[關鍵詞]Runt相關基因2; 間充質干細胞; 下頜骨; 牽張成骨
內源性骨組織工程的牽張成骨最初在矯正肢體長度差異的矯形手術中得到廣泛應用,隨后被用于治療顱面短小癥和頜骨缺損。牽張成骨術是利用骨的自身愈合來增加新骨的一種方法。該技術通過牽張裝置,使骨切開處的骨組織受到緩慢而穩定的牽引和張力,從而達到增長或伸直骨骼的目的。與傳統骨移植方法相比,牽張成骨能夠避免植骨區骨吸收以及供骨區功能障礙等一系列并發癥,且這種技術能夠實現周圍軟組織的三維空間生長并行延長。療程長以及可能的纖維性愈合或不愈合是阻礙牽張成骨廣泛應用于臨床的主要因素[1]。Runt相關基因2 (Runt-related?transcription?factor?2,Runx2)編碼的核蛋白在成骨細胞分化和骨形成過程中起重要作用,并參與骨骼基因的表達和調控。研究[2]表明,Runx2在體內可以有效誘導成骨細胞的增殖分化和促進新骨生成的質量和數量。因此,促進Runx2的表達可能是一個有效促進骨形成的治療途徑。骨髓間充質干細胞(mesenchymal?stem?cells,MSCs)能在體外分化為成骨細胞和軟骨細胞,在體內促進骨形成,已成為骨組織工程的主要細胞來源[3]。本研究擬采用Runx2基因修飾的MSCs來促進下頜骨牽張成骨過程中的新骨生成,縮短治療周期,從而為臨床運用Runx2體外基因治療促進牽張成骨新骨形成的可行性提供實驗依據。
1 ?材料和方法
1.1??材料
48只成年雄性新西蘭白色家兔,體重2.6~3.0?kg。實驗動物的喂養與使用遵守南通大學動物倫理委員會的有關規定。48枚單邊純鈦釘、外固定牽張器由本課題組與四川大學華西口腔醫院共同設計和研制。牽張器最大牽張距離為20?mm,螺距1.0?mm,使用長35?mm、直徑1.8?mm的純鈦螺釘穿皮質骨固定。CT機(μ CT-80型,Scanco?Medical?AG公司,瑞士);雙能X線(dual?energy?X?ray,DXA)骨密度檢測儀(FR216Ⅲ1438型,DMS公司,法國,由四川大學華西醫院提供);INSTRON?5565型生物力學測試系統(Instron公司,美國,由四川大學口腔疾病研究國家重點實驗室提供);重組腺病毒(由北京本元正陽基因技術股份有限公司構建);兔Runx2抗體(上海博研生物工程研究中心);兔Runx2引物(上海斯信生物科技有限公司,正向引物5’-GGAATGCCTCTGCTGTTATG-3’;反向引物5’-GGATTTGTGAAGACGGTTATGG-3’)。
1.2??MSCs分離、培養與基因轉染
采用密度梯度離心法從兔脛骨中分離出骨髓MSCs進行培養,取第3代的MSCs用于體外基因轉染和體內基因移植。構建攜帶有人Runx2基因和綠色熒光蛋白(green?fluorescent?protein,GFP)復制缺陷型E1-/E3-腺病毒(adv-hRunx2-gfp),構建只含有GFP復制缺陷型E1-/E3-腺病毒(adv-gfp)。當骨髓MSCs生長至80%融合時,分別轉染adv-hRunx2-gfp和adv-gfp。轉染后GFP和Runx2的表達分別經熒光顯微鏡和Western?blot及實時定量PCR檢測證實。
1.3??制備兔下頜骨牽張成骨模型
所有的白兔均行右側下頜骨牽張成骨。以自制的純鈦口外牽張裝置,截開下頜骨后固定。3?d的延遲期后以每天2?mm的速度逐漸牽張5?d。將48只兔子隨機分為3組,A組為Runx2重組質粒組,B組為不含Runx2重組質粒組,C組為生理鹽水對照組。術后2周內喂予軟質飼料,并每日肌注青霉素預防感染。
1.4??基因治療
在牽張的第5天,A組在牽張間隙內注射含有1× 107個adv-hRunx2-gfp轉染的MSCs(重懸于0.15?mL生理鹽水中),B組注射含有相同劑量的adv-gfp轉染的MSCs(重懸于0.15?mL生理鹽水中),C組僅注射0.15?mL生理鹽水。
1.5??標本獲取及檢測
在牽張結束后第8周動物均被處死,解剖并獲取牽張側的下頜骨。
1.5.1??大體觀察 ?觀察實驗動物的一般表現、傷口愈合情況、下頜骨牽張區域新骨形成及新生骨與原宿主骨交界情況。
1.5.2???影像學觀察 ??各組動物分別行牽張成骨區CT平掃、DXA檢測,并測量下頜骨牽張間隙內的骨密度(bone?mineral?density,BMD)及骨礦物質含量(bone?mineral?content,BMC),觀察延長區新生骨生長狀況。
1.5.3???三點彎曲測試 ??每組隨機選取8個標本,在生物力學測試機上采用三點彎曲實驗測定牽張區成骨標本力學性能直到標本破壞,記錄標本破壞時的最大載荷。
1.5.4??組織學觀察 ?取牽張間隙內新生骨樣本,放置在4%多聚甲醛溶液內固定24?h,EDTA脫鈣4周,經石蠟包埋后切取組織學切片并行蘇木精-伊紅(hema-
toxylin?eosin,HE)染色分析。觀察各組牽張成骨區骨形成、鈣鹽沉積及骨細胞生長情況。
1.6??統計學分析
采用SPSS?16.0軟件進行統計分析。計量資料以均數±標準差表示,組間比較采用t檢驗。
2??結果
2.1??CT平掃
CT平掃表明,A組牽張間隙內新骨形成量明顯高于B組和C組,B組新骨形成量高于C組。A組的新生骨形態規則,與兩端自體皮質骨開始連續且與原生骨難以區分(圖1)。
2.2??組織學觀察
3組標本的組織學觀察見圖2。3組均可見新生的骨小梁。A組新生骨粗大、密集且排列規律,基本與原生骨一致;B組雖然新生骨良好,但骨小梁相對較纖細、大小不一且未能完全充滿牽張區;C組牽張間隙內零星可見纖維組織以及小而無序的骨小梁。
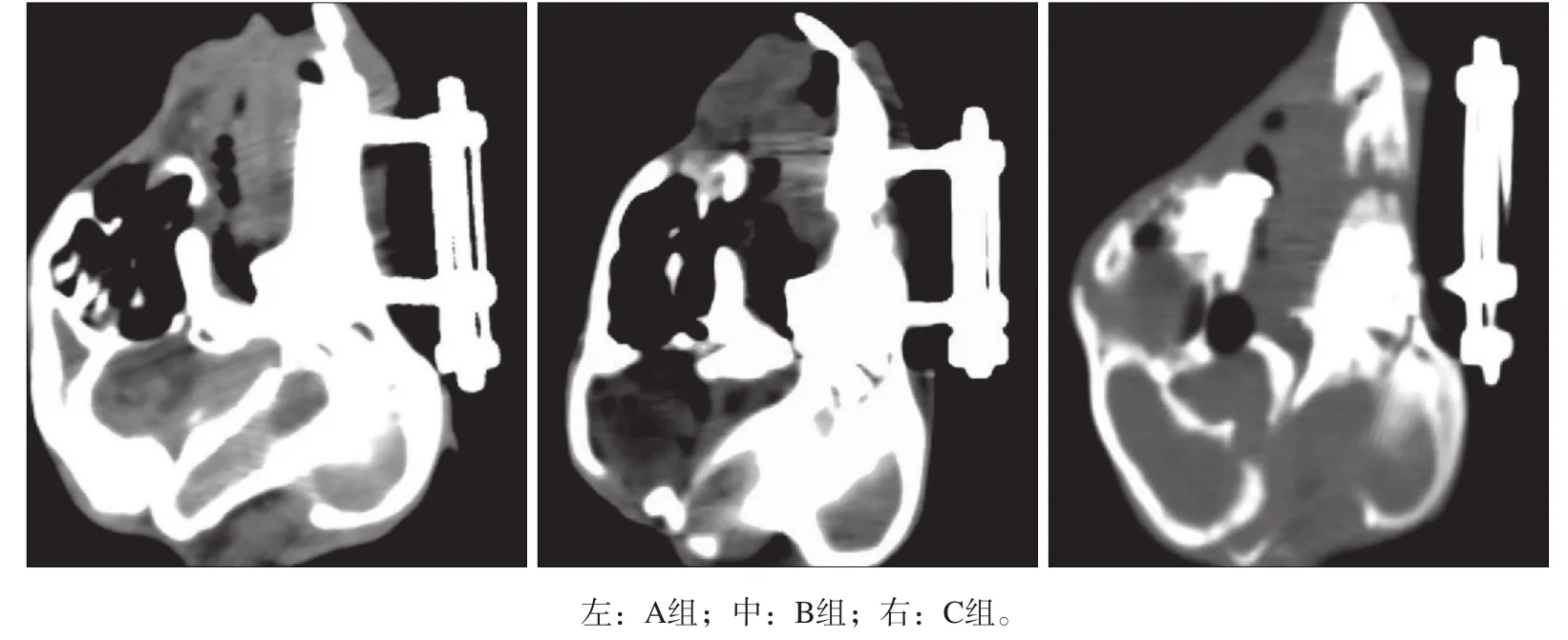
圖 1??3組的CT檢查Fig?1??CT?examination?of?three?groups
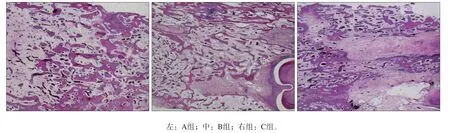
圖 2??3組的組織學觀察 ?HE??×?40Fig?2??Histological?observation?of?three?groups??HE??×?40
2.3??DXA檢測
3組的DXA檢測結果見表1。A組的BMD是C組的1.86倍,是B組的1.47倍;A組的BMC是C組的1.97倍,是B組的1.52倍。A組的BMD及BMC均高于B、C組(P<0.?01)。

表 1 3組的DXA檢測Tab 1 DXA tests of three groups
2.4??三點彎曲測試結果
A、B、C組的新生骨最大載荷分別為384、328、254?N。A組新生骨最大載荷是C組的1.51倍,是B組的1.29倍。A組新生骨的最大載荷高于B、C組(P< 0.01)。
3??討論
本實驗通過兔下頜骨快速牽張成骨動物模型的建立,評估了Runx2修飾的MSCs對骨形成和骨礦化的影響,結果表明MSCs移植可促進牽張期的骨形成,且Runx2基因修飾的MSCs的增強效果更顯著。兔下頜牽張成骨過程中,5~7?d的延遲期和0.9~1.0?mm·d-1的牽張頻率被推薦為最佳牽張方法[4]。本實驗采用快速牽張(短延遲期3?d和快速牽張率2?mm·d-1)以模擬一個匱乏的成骨情況,在牽張結束后8周牽張間隙內可見較差的或不成熟的骨再生[5]。牽張過程中在適當的機械刺激下,原始間充質細胞聚集、定型和增殖并分化為成骨細胞是牽張間隙新骨再生的關鍵步驟[5]。牽張間隙骨再生貧乏,要么是原始成骨細胞聚集和增殖的問題,要么是原始成骨細胞的分化問題。臨床中尤其在原始細胞缺乏或外傷及放療后組織受損嚴重的患者中會出現這些問題[6-7]。因此,在上述情況下需要更多的骨生成時,自體骨髓MSCs補充成骨細胞似乎是保證牽張區理想骨再生的一個合理方法。Kitoh等[8-9]報道,在牽張成骨的臨床試驗中骨髓MSCs的移植能縮短療程加速新骨形成以減少并發癥的發生。本研究表明,與注射生理鹽水的兔相比,將自體骨髓MSCs注入下頜牽張間隙可有更多的新骨形成,牽張間隙骨痂組織鈣化更快。局部移植骨髓MSCs能將更多的循環干/祖細胞向損傷區域聚集并有助于愈合[10]。此外,MSCs有保持成骨細胞表型譜系和分化成活躍成骨細胞的潛能,可能會直接分化為成骨細胞。MSCs較容易從骨髓中隔離和在體外培養。除了直接治療的潛力外,MSCs也被廣泛用作基因轉移的載體。
Runx2是一種可有效上調成骨細胞的基因表達并促進成骨的骨轉錄因子[4,11-12]。研究[13-15]顯示,Runx2的表達能促進骨膜的骨祖細胞增殖,并且促進MSCs的成骨向分化,Runx2是膜內成骨和軟骨內成骨過程中所需的生長因子,在成骨細胞分化和骨形成過程中扮演著重要的角色。局部應用Runx2基因療法可以促進新骨形成的質量[16]。本研究通過影像學、DXA、組織學檢查及生物力學測試表明,Runx2基因治療應用于下頜骨快速牽張成骨中可促進新骨生成的骨誘導效應。Runx2基因傳遞到牽張間隙的時間是本實驗的關鍵點,固定早期階段是成骨最活躍的時期,在此時大量的骨源細胞和內源性生長因子在牽張間隙內積聚[17]。另一項研究[18]表明,在早期階段Runx2可促進成骨細胞增殖,但在后期會抑制成骨細胞的分化和成熟從而導致骨質疏松。因此外源Runx2基因傳遞到牽張間隙內的最佳時間應為牽張期結束。
復制缺陷型重組腺病毒是最有效的基因轉移載體,并且被廣泛應用于傳遞外來基因到細胞內[19-21]。缺陷型腺病毒載體具有高效轉導效率和對宿主細胞的低致病性。此外,這些載體無能力整合到宿主基因組,從而保證了病毒的整組基因無法復制到宿主細胞內。治療基因的表達水平在傳遞后逐漸下降,而骨誘導作用最終消失。這些特性規避了可能激活致瘤基因和通過無限制的轉基因表達引起的不利影響[22]。研究[23-24]表明,含有目的基因的腺病毒能被直接送入再生點,但其可能誘導異位成骨的生長,這尚需要進一步的評估。因此本研究選擇使用注射骨髓間充質干細胞為Runx2基因載體而不是直接的基因傳遞,結果表明基因轉染效率和基因治療策略是滿意的。
通過細胞治療和基因技術的手段,本研究在兔下頜骨牽張成骨過程中應用了一種局部Runx2基因促進骨再生的輸送系統,這種方法可能是縮短牽張療程和簡化整個牽張成骨過程的有效方法。該方法為臨床應用顱頜面骨缺損的重建尤其是對于那些成骨潛能退化、骨質疏松癥及接受放射治療的患者提供了一個極具價值的修復策略。
[參考文獻]
[1]?胡靜,?戚孟春,?韓立赤,?等.?BMP-7基因促進大鼠下頜牽張成骨的研究[J].?實用口腔醫學雜志,?2006,?22(5):635-638. Hu?J,?Qi?MC,?Han?LC,?et?al.?Bone?regeneration?accelerated?by?bmp-7?gene?in?rat?mandibular?distraction?osteogenesis[J].?J?Pract?Stomatol,?2006,?22(5):635-638.
[2]?Bhat?BM,?Robinson?JA,?Coleburn?VE,?et?al.?Evidence?of?in vivo?osteoinduction?in?adult?rat?bone?by?adeno-Runx2?intra-femoral?delivery[J].?J?Cell?Biochem,?2008,?103(6): 1912-1924.
[3]?周諾,?黃旋平,?江獻芳,?等.?骨形態發生蛋白-2基因修飾骨髓間充質干細胞復合對氧化聚乙烯和聚丙烯共聚物移植促進兔下頜骨牽張成骨的實驗研究[J].?華西口腔醫學雜志,?2013,?31(3):247-252.?Zhou?N,?Huang?XP,?Jiang?XF,?et?al.?Experimental?study?on?transplantation?of?bone?morphogenetic?protein-2?gene?transfected?bone?mesenchymal?stem?cells?compounded?with?Pluronic?F-127?for?promoting?bone?regeneration?in?rabbit?mandibular?distraction?osteogenesis[J].?West?China?J?Stomatol,?2013,?31(3):247-252.
[4]?Tee?BC,?Sun?Z.?Mandibular?distraction?osteogenesis?assisted?by?cell-based?tissue?engineering:?a?systematic?review[J].?Orthod?Craniofac?Res,?2015,?18(Suppl?1):39-49.
[5]?Jiang?X,?Zou?S,?Ye?B,?et?al.?bFGF-Modified?BMMSCs?enhance?bone?regeneration?following?distraction?osteogenesis?in?rabbits[J].?Bone,?2010,?46(4):1156-1161.
[6]?Nolte?JW,?Jansma?J,?Becking?AG.?Distraction?osteogenesis?of?maxilla?and?midface?in?postradiotherapy?patients[J].?J?Oral?Maxillofac?Surg,?2012,?70(5):1145-1151.
[7]?Deshpande?SS,?Gallagher?KK,?Donneys?A,?et?al.?Stem?cell?therapy?remediates?reconstruction?of?the?craniofacial?skeleton?after?radiation?therapy[J].?Stem?Cells?Dev,?2013,?22 (11):1625-1632.
[8]?Kitoh?H,?Kitakoji?T,?Tsuchiya?H,?et?al.?Transplantation?of?marrow-derived?mesenchymal?stem?cells?and?platelet-rich?plasma?during?distraction?osteogenesis—a?preliminary?result?of?three?cases[J].?Bone,?2004,?35(4):892-898.
[9]?Kitoh?H,?Kitakoji?T,?Tsuchiya?H,?et?al.?Transplantation?of?culture?expanded?bone?marrow?cells?and?platelet?rich?plasma?in?distraction?osteogenesis?of?the?long?bones[J].?Bone,?2007,?40(2):522-528.
[10]?Kinnaird?T,?Stabile?E,?Burnett?MS,?et?al.?Local?delivery?of?marrow-derived?stromal?cells?augments?collateral?perfusion?through?paracrine?mechanisms.[J].?Circulation,?2004,?109 (12):1543-1549.
[11]?Sun?JJ,?Zheng?XH,?Wang?LY,?et?al.?New?bone?formation?enhanced?by?ADSCs?overexpressing?hRunx2?during?mandibular?distraction?osteogenesis?in?osteoporotic?rabbits[J].?J?Orthop?Res,?2014,?32(5):709-720.
[12]?王立媛,?劉大勇,?賈智.?人脫落乳牙干細胞骨向分化相關分子Runx2的動態表達[J].?中國組織工程研究,?2014,?18 (15):2345-2350. Wang?LY,?Liu?DY,?Jia?Z.?Dynamic?expression?of?Runx2?gene?profile?during?osteogenesis?in?stem?cells?from?human?exfoliated?deciduous?teeth[J].?Chin?J?Tissue?Eng?Res,?2014,?18(15):2345-2350.
[13]?Stein?GS,?Lian?JB,?Stein?JL,?et?al.?Temporal?and?spatial?parameters?of?skeletal?gene?expression:?targeting?RUNX?factors?and?their?coregulatory?proteins?to?subnuclear?domains [J].?Connect?Tissue?Res,?2003,?44(Suppl?1):149-153.
[14]?Chen?CG,?Thuillier?D,?Chin?EN,?et?al.?Chondrocyte-intrinsic?Smad3?represses?Runx2-inducible?matrix?metalloproteinase?13?expression?to?maintain?articular?cartilage?and?prevent?osteoarthritis[J].?Arthritis?Rheum,?2012,?64(10):3278-3289.
[15]?馬慧,?趙紅斌.?Runx2蛋白與成骨細胞分化信號[J].?醫學綜述,?2007,?13(24):1959-1962.?Ma?H,?Zhao?HB.?Runx2?and?signal?transduction?of?osteoblast?differentiation[J].?Med?Recapitulate,?2007,?13(24):1959-1962.
[16]?Zhao?Z,?Wang?Z,?Ge?C,?et?al.?Healing?cranial?defects?with?AdRunx2-transduced?marrow?stromal?cells[J].?J?Dent?Res,?2007,?86(12):1207-1211.
[17]?Kim?IS,?Song?YM,?Hwang?SJ.?Osteogenic?responses?of?human?mesenchymal?stromal?cells?to?static?stretch[J].?J?Dent?Res,?2010,?89(10):1129-1134.
[18]?Liu?W,?Toyosawa?S,?Furuichi?T,?et?al.?Overexpression?of?Cbfa1?in?osteoblasts?inhibits?osteoblast?maturation?and?causes?osteopenia?with?multiple?fractures[J].?J?Cell?Biol,?2001,?155 (1):157-166.
[19]?Li?C,?Ding?J,?Jiang?L,?et?al.?Potential?of?mesenchymal?stem?cells?by?adenovirus-mediated?erythropoietin?gene?therapy?approaches?for?bone?defect[J].?Cell?Biochem?Biophys,?2014,?70(2):1199-1204.
[20]?Zhao?C,?Wu?N,?Deng?F,?et?al.?Adenovirus-mediated?gene?transfer?in?mesenchymal?stem?cells?can?be?significantly?enhanced?by?the?cationic?polymer?polybrene[J].?PLoS?ONE,?2014,?9(3):e92908.
[21]?Sun?M,?Tan?W,?Wang?K,?et?al.?Effects?of?allogenous?periostealderived?cells?transfected?with?adenovirus-mediated?BMP-2?on?repairing?defects?of?the?mandible?in?rabbits[J].?J?Oral?Maxillofac?Surg,?2013,?71(10):1789-1799.
[22]?Kay?MA,?Glorioso?JC,?Naldini?L.?Viral?vectors?for?gene?therapy:?the?art?of?turning?infectious?agents?into?vehicles?of?therapeutics[J].?Nat?Med,?2001,?7(1):33-40.
[23]?Zhang?Y,?Cheng?N,?Miron?R,?et?al.?Delivery?of?PDGF-B?and?BMP-7?by?mesoporous?bioglass/silk?fibrin?scaffolds?for?the?repair?of?osteoporotic?defects[J].?Biomaterials,?2012,?33(28):6698-6708.
[24]?Sheyn?D,?Kallai?I,?Tawackoli?W,?et?al.?Gene-modified?adult?stem?cells?regenerate?vertebral?bone?defect?in?a?rat?model[J].?Mol?Pharm,?2011,?8(5):1592-1601.
(本文采編 ?李彩)
[中圖分類號]R?782.2
[文獻標志碼]A???[doi] ??10.7518/hxkq.2016.02.004
[收稿日期]2015-06-16;?[修回日期] ?2015-09-18
[基金項目]江蘇省 “?六大人才高峰 ”?基金(2013-WSW-048)
[作者簡介]馮桂娟,住院醫師,碩士,E-mail:fengguijuan2013@126. com
[通信作者]宋冬惠,副教授,博士,E-mail:sdh527@163.com
Mesenchymal stem cells modified with Runt-related transcription factor 2 promote bone regeneration in rabbit man-dibular distraction osteogenesis
Feng Guijuan1, Zheng Ke1, Song Donghui1, Wu Senbin1, Zhu Songsong2, Hu Jing2. (1. Dept. of Stomatology, The Affiliated Hospital of Nantong University, Nantong 226001, China; 2. State Key Laboratory of Oral Diseases, Dept. of Orthognathic and Temporomandibular Joint Surgery, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: “Top Six Types of Talents” Financial Assistance Jiangsu Province Grant (2013-WSW-048). Correspondence: Song Donghui, E-mail: sdh527@163.com.
[Abstract]Objective This?work?investigated?mesenchymal?stem?cells?(MSCs)?modified?with?Runt-related?transcription?factor?2?(Runx2)?therapy?for?bone?regeneration?in?rabbit?mandibular?distraction?osteogenesis.?Methods???Forty-eight?New?Zealand?mature?white?rabbits?were?randomly?divided?into?three?groups?after?the?rabbit?model?of?mandibular?distraction?osteogenesis?was?established:?reconstruction?plasmid?modified?with?Runx2?(group?A),?plasmid?without?Runx2?(group?B),?and?the?same?dose?of?saline?as?control?(group?C).?At?the?fifth?day?of?distraction?phase,?MSCs?with?reconstruction?plasmid?modified?with?adv-hRunx2-gfp?were?injected?into?the?distraction?gap?of?group?A.?MSCs?with?reconstruction?plasmid?modified?with?adv-gfp?was?injected?into?the?distraction?gap?of?group?B,?whereas?group?C?was?injected?with?the?same?dose?of?saline.?At?8?weeks?after?injection,?all?animals?were?sacrificed,?and?the?distracted?mandibles?were?harvested.?The?general?imaging?histological?observation?and?three-point?bending?test?were?used?for?evaluation.?Results???CT?plain?scan?and?histological?analysis?confirmed?that?the?amount?of?new?bone?forming?in?the?distraction?gap?of?group?A?was?significantly?higher?than?those?in?groups?B?and?C.?Dual-energy?X?ray?and?three-point?bending?test?results?also?showed?that?the?bone?mineral?density,?bone?mineral? content,?and?maximum?load?of?the?distraction?gap?of?group?A?were?significantly?higher?than?those?of?groups?B?and?C?(P<0.01).?Conclusion??Runx2-ex vivo?gene?therapy?based?on?MSCs?can?effectively?promote?the?bone?regeneration?in?rabbit?mandibular?distraction?osteogenesis?and?shorten?the?stationary?phase.?Therefore,?reconstruction?of?craniofacial?fracture?would?be?a?valuable?strategy.
[Key words]Runt-related?transcription?factor?2;??mesenchymal?stem?cells;??mandibular;??distraction?osteogenesis

